樹鼩呼腸孤病毒RT-nPCR檢測方法的建立及初步應用
李曉飛,殷安國,張 媛,羅 軍,孫曉梅,代解杰
(中國醫學科學院北京協和醫學院醫學生物學研究所樹鼩種質資源中心,云南省重大傳染病疫苗研發重點實驗室,昆明 650118)
哺乳動物呼腸孤病毒(mammalian orthoreovirus,MRV)在分類學上屬呼腸孤病毒科(Reoviridae)正呼腸孤病毒屬(Orthoreovirus)第一亞群[1]。基因組為10個節段的雙鏈RNA,分為3個大片段(L1~L3)、3個中片段(M1~M3)及4個小片段(S1~S4)。根據紅細胞凝集活性MRV分為三種血清型及標準株,分別為:血清1型(T1L, Long)、血清2型(T2J, Jone)和血清3型(T3D, Dearing; T3A, Abney)[2]。MRV具有廣泛的宿主譜,牛、羊、馬、豬、狗、貓、小鼠、蝙蝠、人及非人靈長類體內都已報道分離到呼腸孤病毒[3-5]。呼腸孤病毒與肺部感染、神經系統感染、消化系統感染密切相關[6]。Reo-3感染可致小鼠呼吸窘迫綜合癥,肺水腫、肺泡出血、肺纖維化和致死性間質性肺炎等癥狀,最后顯現病毒血癥及神經系統感染所致腦炎心肌炎等[7],Reo-3型是國標要求SPF級實驗小鼠必檢的項目之一。
近年來,樹鼩(tree shrews)由于其獨特的生物學特性和分類學地位正在被培育成為實驗動物新品種,研究證實它在感染性疾病動物模型方面獨具價值。中國醫學科學院醫學生物學研究所樹鼩種質資源中心目前正在開展實驗樹鼩飼養繁殖和標準化研究工作。
2011~2012年期間,本中心先后從同一地區野外引進了三批樹鼩,少數樹鼩出現精神萎靡、眼角膜及鼻分泌物增多,足爪皮膚潰爛脫皮等類似病毒性感染的臨床癥狀。為探明何種感染病原體,我們對死亡動物糞便中的未知病毒進行分離鑒定,確認得到三株呼腸孤病毒毒株,分別命名為TRV1、TRV2、TRV3。鑒于樹鼩對呼腸孤病毒易感,且在抵抗力差的情況下可出現致死性后果,需建立相應的靈敏快速的檢測方法,作為實驗樹鼩種群病原微生物質量控制的有效手段。
1 材料和方法
1.1 病毒及樣品
呼腸孤病毒III型(Reo3)由中國食品藥品檢定研究院實驗動物資源研究所贈予;輪狀(RV)病毒Wa株,甲肝(HAV)病毒,單純皰疹(HSV-1)病毒由中國醫學科學院醫學生物學研究所保存;三株樹鼩呼腸孤病毒TRV1、TRV2、TRV3來源于三只動物(表1);25只樹鼩病毒感染疑似病例的糞便處理樣本。
1.2 設備及試劑
美國產Forma恒溫培養箱,日本產Nikon顯微鏡,Hitachi透射電鏡,美國產Bio-Rad梯度PCR儀、Bio-Rad電泳儀系統、Bio-Rad凝膠成像系統。 病毒DNA/RNA提取試劑盒購自Axygen公司;逆轉錄試劑盒購自Fermentas;PCR試劑盒購自Thermo公司;膠回收試劑盒購自TakaRa公司。
1.3 病毒分離及電鏡觀察
采集發病樹鼩糞便(1~2)g,用磷酸鹽緩沖液(PBS) 制成10%~20%糞便懸液,5 000 r/min離心30 min,取上清液經0.22 μm微孔濾膜過濾,濾液加入終濃度10%的雙抗(青霉素和鏈霉素),按1/10(V/V)接種比接種于鋪滿80%~90%的VERO單層細胞,37℃吸附30 min,棄接種液,立即加入2%胎牛血清MEM維持液,37℃,5% CO2培養并觀察CPE,繼續盲傳并收集病毒液,反復凍融三次置-80℃保存待鑒定。

表1 從不同批次野外引入樹鼩中分離到的MRV
收集的病毒液于4 500 r/min離心30 min,取上清液,經40%、20%、10%蔗糖密度梯度離心(35 000 r/min,2.5 h,4℃),以100 μL PBS 4℃過夜溶解,次日取20 μL經1%磷鎢酸常規染色,于Hitachi透射電鏡下觀察病毒形態。
1.4 病毒RNA提取
對正常VERO細胞,TRV1、TRV2、TRV3感染的VERO細胞上清液,呼腸孤病毒III型(Reo3),輪狀(RV)病毒Wa株,甲肝(HAV)病毒,單純皰疹(HSV-1)病毒以及25只樹鼩病毒感染疑似病例的糞便處理樣本按照AxyPrep體液病毒DNA/RNA小量試劑盒操作步驟提取核酸。提取后的RNA立即反轉錄合成cDNA,剩余的RNA凍存于-80℃冰箱備用。
1.5 聚丙烯酰胺凝膠電泳鑒定
將TRV1、TRV2、TRV3三株病毒細胞培養上清液中提取的病毒RNA按9∶1與10× loading buffer 混勻后經核酸聚丙烯凝膠電泳(積層膠3.5%,分離膠10%),每孔上樣15 μL,90 V恒壓電泳9 h,硝酸銀染色觀察[8]。
1.6 反轉錄巢式PCR
1.6.1 引物設計:哺乳動物呼腸孤病毒(MRV)的L1基因片段編碼呼腸孤病毒內衣殼蛋白λ3,λ3具有RNA依賴的RNA聚合酶活性,在呼腸孤病毒的整個基因組中是最保守的[9]。分析已報道的MRV的L1基因的保守區域,用Primer Premier 5.0軟件設計巢式引物見表2,依次使用兩對引物進行巢式PCR擴增后的目的片段為513 bp。引物由寶生物工程(大連)有限公司合成。
1.6.2 反轉錄合成cDNA:參照Fermentas RevertAidTMFirst Strand cDNA Synthesis Kit使用說明書確定反轉錄體系為:病毒RNA 8 μL、 Random Hexamer Primer 1 μL、nuclease-free water 3 μL、5× reaction buffer 4 μL、RiboLock RNase inhibitor (20 U/μL) 1 μL、10 mM dNTP Mix 2 μL、RevertAid M-MuLV RT (200 U/μL) 1 μL。反應條件為:25℃ 5 min,42℃孵育60 min,70℃ 5 min獲得cDNA。
1.6.3 巢式PCR:對巢式PCR反應體系的引物、模板及反應體系的退火溫度及循環次數等進行優化,確定最佳反應模式。第一次PCR反應體系:反轉錄cDNA 模板3 μL、DreamTaq Green PCR Master Mix 12.5 μL、nuclease-free water 7.5 μL,以外圍引物TRV-F1 (5 μM)、TRV-R1 (5 μM)各1 μL進行巢式第一次PCR擴增。擴增條件:95℃變性5 min;95℃ 30 sec,50℃ 30 sec,72℃ 2 min,35個循環;72℃延伸10 min。取第一次PCR產物3 μL,以內圍引物TRV-F2 (5 μM)、TRV-R2 (5 μM)各1 μL 進行第二次PCR擴增,反應體系及反應條件同第一次PCR擴增。利用此RT-nPCR方法對正常VERO細胞、TRV1、TRV2、TRV3感染的細胞上清液進行檢測。
1.6.4 RT-nPCR產物的檢測:取10 μL擴增產物于1.5%瓊脂糖凝膠(含0.5 μg/mL EB)進行電泳檢測,在1× TAE電泳緩沖液中,90 V電泳40 min,于凝膠成像系統紫外燈下觀察并切下PCR產物條帶,使用膠回收試劑盒純化PCR產物,由寶生物(大連)工程公司測序,測序結果于NCBI BLAST 進行序列相似性和同源性分析,以確定RT-nPCR檢測的準確性。
1.6.5 特異性的試驗:使用巢式引物TRV-F1,R1;TRV-F2,R2分別以三株樹鼩呼腸孤病毒(TRV1、TRV2、TRV3),呼腸孤病毒III型(Reo3),輪狀(RV)病毒Wa株,甲肝(HAV)病毒RNA的cDNA及單純皰疹(HSV-1)病毒的DNA為模板,用所建立的RT-nPCR方法進行擴增,擴增產物于1.5%瓊脂糖凝膠電泳檢測。
1.6.6 敏感性的試驗:將起始濃度為10.2 ng/μL的RNA樣本做倍比稀釋,分設100、10-1到10-10濃度梯度進行RT-nPCR擴增,擴增產物于1.5%瓊脂糖凝膠電泳檢測,判斷可擴增的最小RNA模板濃度。

表2 用于擴增L1基因的巢式引物序列及位置
1.6.7 初步應用:對25只樹鼩病毒感染疑似病例的糞便處理樣本(編號:1 ~25號,其中1~15號為存活動物組,16~25號樣本為死亡動物組)提取RNA,進行RT-nPCR擴增,擴增產物于1.5%瓊脂糖凝膠電泳檢測。
2 結果
2.1 病毒的細胞病變、電鏡形態及聚丙烯酰胺凝膠電泳圖譜
接種病毒后的VERO細胞于12 h即出現明顯的細胞病變(cytopathic effects,CPE),繼續盲傳第2~6代均出現穩定的CPE,細胞顆粒感增強、圓縮、聚集最終脫落;病毒液濃縮純化后透視電鏡下觀察,可見病毒為球形顆粒,完整直徑約70 nm,雙層衣殼,為呼腸孤病毒的典型形態特征見圖1;提取三株TRV RNA進行聚丙烯凝膠電泳鑒定,結果顯示三株病毒均由10個基因片段組成,按分子量大小可分為大(L1、L2、L3)、中(M1、M2、M3)和小(S1、S2、S3,S4)三個類群,呈現典型的3:3:4排列。各分離株的PAGE電泳圖譜特征見圖2。

圖1 樹鼩呼腸孤病毒株TRV2透視電鏡觀察
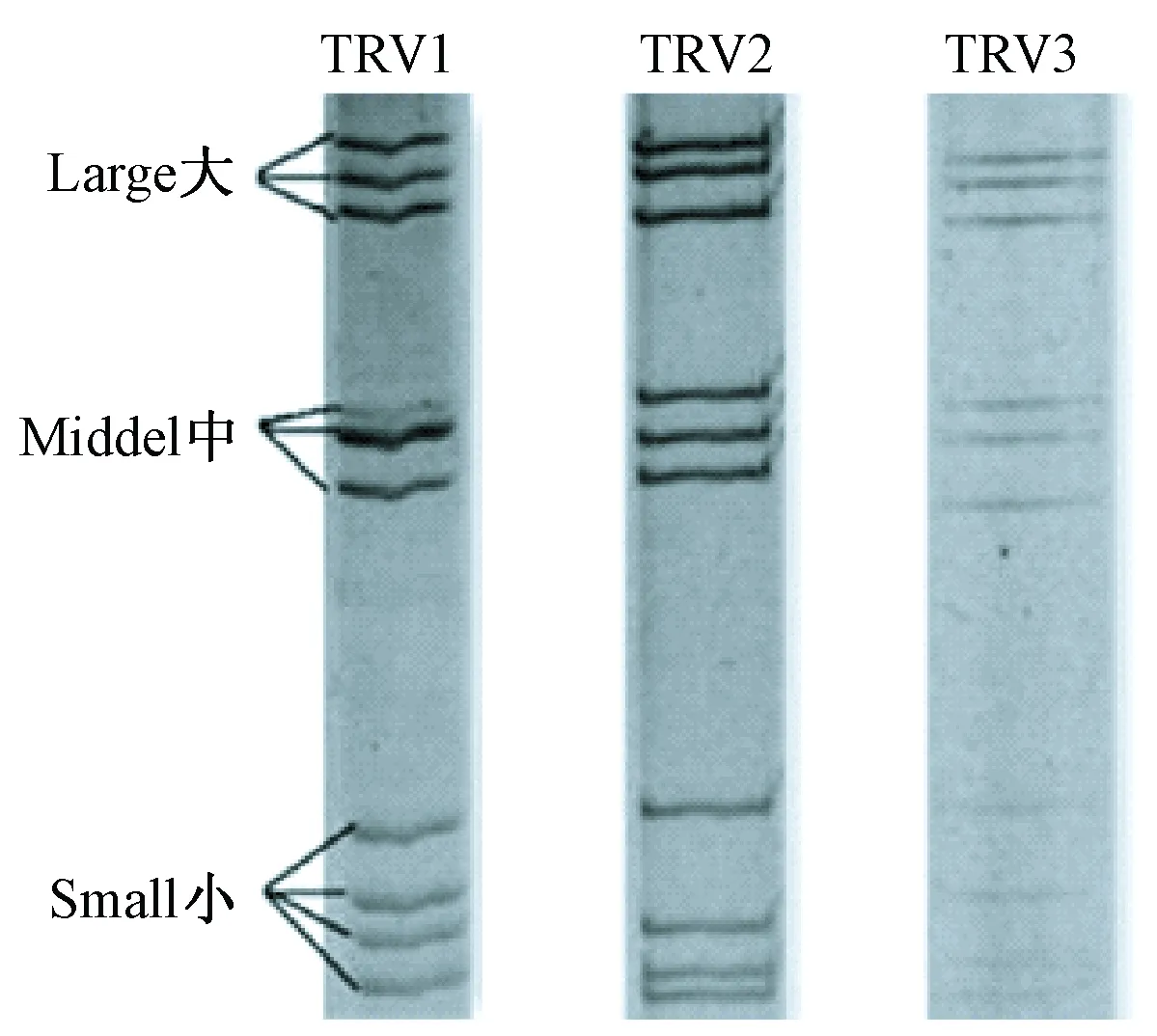
圖2 三株呼腸孤病毒PAGE電泳圖譜
2.2 RT-nPCR產物的檢測
巢式引物TRV-F1,R1;TRV-F2,R2對三株樹鼩呼腸孤病毒(TRV1、TRV2、TRV3)擴增均得到長度為513 bp的特異性目的條帶;VERO細胞陰性對照未擴增到特異性目的條帶(圖3)。目的片段純化后測序,測序結果經BLAST分析,TRV1與GenBank中MRV分離株T3/Bat/Germany/342/08株和SI-MRV01株的序列同源性最高,為96%;TRV2與MRV分離株Ndelle virus株的序列同源性為90%;TRV3與MRV分離株MRV-HLJ/2007株的序列同源性為94%。
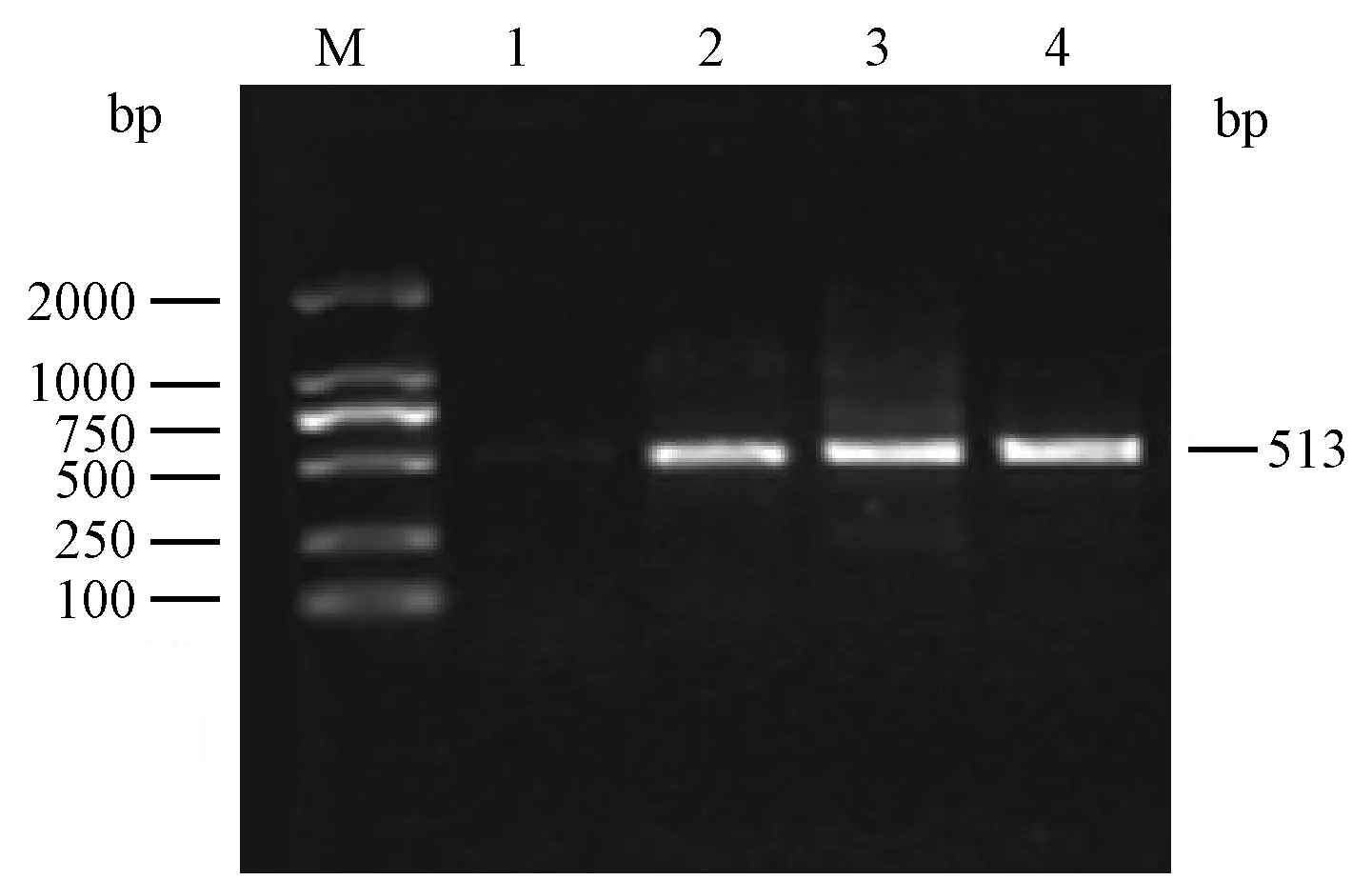
M: 2 000 bp DNA marker;1:VERO細胞對照;2:TRV1;3:TRV2; 4: TRV3
2.3 特異性試驗
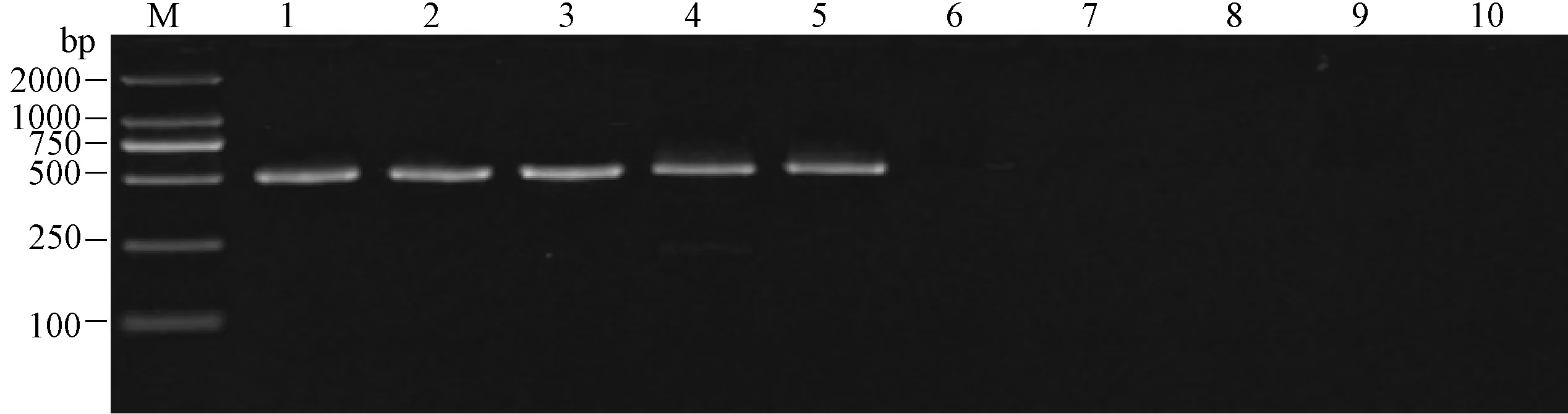
巢式引物TRV-F1,R1;TRV-F2,R2在以TRV1、TRV2、TRV3及呼腸孤病毒III型(Reo3)為模板進行擴增有明顯目的條帶出現,輪狀(RV)病毒Wa株,甲肝(HAV)病毒及單純皰疹(HSV-1)均無目的條帶(圖4)。

M:2000bp DNA marker;1:呼腸孤病毒Ⅲ型;2:輪狀(RV)病毒Wa株;3:甲肝(HAV)病毒;4:單純皰疹(HSV-1);5:TRV1;6:TRV2;7:TRV3
M: 2000 bp DNA marker;1:RNA原液;2:10-1稀釋;3:10-2稀釋;4:10-3稀釋;5:10-4稀釋;6:10-5稀釋;7:10-6稀釋;8:10-7稀釋;9:10-8稀釋;10:10-9稀釋。

M: 2000 bp DNA marker;1~15:存活動物組;16~25號:死亡動物組
2.4 敏感性試驗
巢式引物TRV-F1,R1;TRV-F2,R2在起始濃度為10.2 ng/μL的 TRV2 RNA模板稀釋至10-4時仍可見清晰的目的條帶(圖5),即所能檢測到的最小RNA模板濃度至少能達到0.01 pg/μL。
2.5 初步應用
應用建立的RT-nPCR方法對25只樹鼩病毒感染疑似病例的糞便處理樣本的檢測結果如下:存活動物組(1~15號)中2、7、10、12號糞便樣本及死亡動物組(15~25號)的15~25號糞便樣本均擴增出513 bp的目的片段。 死亡動物(15~25號)中TRV陽性攜帶率為100%;存活動物(1~15號)中TRV陽性攜帶率為27%。(圖6)
3 討論
我中心在實驗樹鼩種群建立過程中,先后三次從昆明郊區同一地域野外引進的部分樹鼩中發現了病毒感染的臨床癥狀,通過病毒分離培養鑒定,發現所分離的TRV1、TRV2和TRV3病毒株具有呼腸孤病毒獨特的CPE和典型的電鏡形態,獨特的3:3:4基因組帶型,且三株病毒的L1基因序列與哺乳動物呼腸孤病毒有較高的序列同源性。采用建立的RT-nRCR方法對25只野外來源樹鼩疑似病例樣本進行檢測,發現具有較高的感染率,說明MRV的宿主范圍確實廣泛,建議作為樹鼩微生物質量控制必須考慮的指標之一。
目前已建立的呼腸孤病毒檢測方法有:ELISA檢測[10]、免疫熒光檢測[11]、電鏡法(DEM)、聚丙烯酰胺凝膠電泳(PAGE)、PCR[12,13]等。電鏡法需擴增病毒、純化濃縮、超速離心,耗時耗力;PAGE法需謹慎防止RNA酶的降解影響,靈敏度有限,易出現假陰性;PCR方法具簡單、快捷、靈敏的優點,我們曾嘗試使用Leary TR[14]報道的引物rv5m和rv4m對所分離的3株TRVs進行擴增,但未獲得理想結果。因此改用針對L1基因保守區域設計巢式引物,并建立RT-nPCR的方法。該方法對Reo3和3株TRVs通用,且不針對同為呼腸孤病毒科的輪狀病毒、單鏈RNA的甲肝病毒和雙鏈DNA的單純皰疹病毒進行擴增,特異性好;最低RNA模板檢測濃度為0.01pg/μL,不僅可檢測到經細胞培養增殖后的病毒,亦可直接檢測到動物糞便中的病毒RNA。當前我們正在研究TRV對樹鼩的致病性及致病機理,以進一步揭示TRV的感染機制,此RT-nPCR方法可作為TRV檢測的有效手段。此外,我們提議利用此方法對野外引進的樹鼩在隔離檢疫期間進行TRV的篩查,這對樹鼩TRV進行微生物控制有重要意義。
分析三株呼腸孤病毒TRV1、TRV2、TRV3基因組的聚丙烯酰胺凝膠電泳的帶型,不難發現三株病毒的基因組10個片段分布特征有區別,M片段和S片段差異較大。另外,經RT-nPCR得到的L1基因的513 bp片段序列也有差異。推導不同時間來源的三株病毒具有一定遺傳差異,這對今后開展樹鼩呼腸孤病毒的分子流行病學研究提供了基礎。至于TRV1、TRV2、TRV3之間的變異關系或與已報道的哺乳動物呼腸孤病毒(MRV)的親緣性關系,有賴于今后全基因序列的測定結果作進一步的研究。
參考文獻:
[1] 張云,劉明,歐陽歲東, 等. 呼腸孤病毒及其分類學依據研究進展 [J]. 動物醫學進展,2004, 25(6):46-49.
[2] 孫穎,辛紹杰,貌盼勇. 呼腸病毒的生物學特征及其致病性 [J]. 國外醫學. 流行病學傳染病學分冊,2005, 32(3):145-148.
[3] Tyler KL. Mammalian reoviruses.In: Knipe DM and Howley PM (eds): Fields Virology [M]. 4th edition. Philadelphia, Lippincott-Raven, 2001,1729-1745.
[4] Kohl C, Lesnik R, Brinkmann A, et al. Isolation and characterization of three mammalian orthoreoviruses from European bats [J]. PloS One, 2012, 7(8):e43106.
[5] Hrdy DB, Rosen L, Fields BN. Polymorphism of the migration of double-stranded RNA genome segments of reovirus isolates from humans, cattle, and mice [J]. Jf Virol, 1979, 31(1):104-111.
[6] 左庭婷, 端青. 呼腸病毒感染實驗動物致病性的研究進展 [J]. 軍事醫學科學院院刊, 2008, 32(4):389-391.
[7] Gauvin L, Bennett S, Liu H, et al. Respiratory infection of mice with mammalian reoviruses causes systemic infection with age and strain dependent pneumonia and encephalitis [J]. Virol J, 2013, 10:67.
[8] 徐娟, 黃曉燕, 李曉飛, 等. 樹鼩呼腸孤病毒的分離鑒定 [J]. 動物學研究, 2013, 34(2):116-120.
[9] Leary TR, Erker JC, Chalmers ML, et al. Detection of mammalian reovirus RNA by using reverse transcription-PCR: sequence diversity within the λ3-encoding L1 gene [J]. J Clini Microbiol, 2001, 1368-1375.
[10] 侯麗波, 佟巍, 謝軍芳, 等. 小鼠呼腸孤病毒III型標準化血清制備及ELISA檢測方法的建立 [J]. 中國比較醫學雜志, 2010, 20(8):60-64.
[11] 王吉, 衛禮, 岳秉飛, 等. 呼腸孤病毒III型免疫熒光檢測方法的建立及初步應用 [J]. 中國比較醫學雜志, 2011, 21(8):1-4.
[12] 冉旭華. 犬蝠源呼腸孤病毒的分離鑒定及其生物學特性的研究 [D]. 中國農業科學院研究生院哈爾濱獸醫研究所, 2006:1-106.
[13] 王吉, 衛禮, 賀爭鳴, 等. 呼腸孤病毒III型(Reo3)RT-PCR檢測方法的建立 [J]. 中國比較醫學雜志, 2012, 22(9):46-50.
[14] Leary TR, Erker JC, Chalmers ML, et al. Detection of reovirus transcription-polymerase chain reaction using primers corresponding to conserved regions of the viral L1 genome segment [J]. J Virol Methods, 2001, 104(2):161-165.

