α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡與Rho GTPases信號通路的活化相關
丁雪冰 王雪晶 馬明明 滕軍放
1)鄭州大學第一附屬醫院神經內科 鄭州 450052 2)河南省神經系統分子構象病分子診斷實驗室 鄭州 450052 3)河南省人民醫院神經內科 鄭州 450003
α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡與Rho GTPases信號通路的活化相關
丁雪冰1,2)王雪晶1,2)馬明明3)滕軍放1,2)
1)鄭州大學第一附屬醫院神經內科 鄭州 450052 2)河南省神經系統分子構象病分子診斷實驗室 鄭州 450052 3)河南省人民醫院神經內科 鄭州 450003
目的 探討α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡的分子機制。方法 構建α-Syn寡聚體誘導SH-SY5Y細胞凋亡模型,流式細胞技術檢測SH-SY5Y細胞凋亡;免疫熒光檢測SH-SY5Y細胞內α-Syn陽性包涵體;Pull down檢測SH-SY5Y細胞Rac1、Cdc42、RhoA活性。結果 與對照組相比,α-Syn寡聚體誘導SH-SY5Y細胞凋亡率顯著增加,細胞內α-Syn陽性包涵體數量增加,Rac1、Cdc42、RhoA活性增高。結論 α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡與Rho GTPases信號通路的活化相關。
Rho GTPases信號通路;α-突觸核蛋白;人神經母細胞瘤細胞;凋亡
帕金森病(Parkinson’s Disease, PD)病理特征為多巴胺神經元胞漿中α-突觸核蛋白(α-synuclein,α-Syn)陽性路易小體的形成及多巴胺神經元的缺失[1]。目前,帕金森病的發病機制尚不明確,研究發現DA神經元大量吞噬異常聚集的α-Syn后,啟動自身凋亡程序,并激活周圍小膠質細胞釋放大量氧自由基及炎性因子,導致DA能神經元的損傷[2-3]。推測α-Syn陽性包涵體在神經元間的播散在PD進展中起到重要作用。
Rho GTPase具有GTP激酶活性,在活性型(GTP限制型構象)和失活型(GDP限制型構象)之間循環,參與調節細胞骨架解聚的動態過程,重塑細胞形態,從而影響細胞吞噬功能[4]。其中Rac1、Cdc42和RhoA是關鍵的調控因子。在神經細胞和巨噬細胞中,RhoA的活化導致突起回縮、胞體變圓,Cdc42的激活促進絲狀偽足的形成,Rac1的激活促進板裝偽足的形成。研究表明,在多種細胞成熟過程中,活化型Rac1、Cdc42的水平參與調節細胞吞噬作用,細胞成熟后Cdc42的活化降低,吞噬現象消失[5]。提示Rho GTPase信號通路的調控因子在細胞吞噬功能中發揮重要的作用。
本研究試圖以α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡為切入點,檢測α-突觸核蛋白誘導的人神經母細胞瘤細胞凋亡過程中Rho GTPases信號通路的活性,探索PD神經元凋亡的分子機制。
1 材料與方法
1.1 材料 SH-SY5Y細胞購自中國科學院上海生命科學研究院細胞資源中心。DMEM培養基、胎牛血清購于美國GIBCO公司。α-Syn抗體購于美國 Santa Cruz Biotechnology公司,過氧化物酶標記山羊抗兔IgG購于美國Promega公司,Alexa Fluor 633 標記 Phalloidin購于美國Molecular Probes公司。DAPI購于美國Molecular Probes公司。細胞裂解液購于美國Cell Signaling公司。Rac/Cdc42 Assay Reagent (PAK1 PBD,agarose)或 Rho Assay Reagent (Rhotekin RBD,agarose) 購于美國Millipore公司。人源重組α-Syn凍干粉購于Sigma公司。Annexin V-FITC/PI凋亡檢測試劑盒(南京凱基生物科技發展公司)。
1.2 α-Syn寡聚體誘導SH-SY5Y細胞凋亡模型的構建 SH-SY5Y細胞以1×106接種并培養24 h后,換無血清培養基,實驗組中加入終濃度0.5μm的α-Syn寡聚體,對照組加入相應體積PBS,并于37℃ 5% CO2中孵育24 h。
1.3 流式細胞技術檢測SH-SY5Y細胞凋亡 采用Annexin V-FITC/PI雙染法分組處理后,流式細胞儀分析細胞凋亡。0.25%胰蛋白酶消化細胞后PBS洗滌3次,收集5×105個細胞,加入500 μL Binding Buffer及5 μL Annexin V-FITC及5 μL PI混勻,反應10 min,用美國BD公司流式細胞儀進行數據分析。
1.4 免疫熒光檢測SH-SY5Y細胞內α-Syn陽性包涵體 收獲SH-SY5Y細胞,PBS洗2次。加入-20℃預冷的丙酮于-20℃孵育10 min,加入0.1% Triton,常溫孵育5 min。5% BSA 37℃孵育30 min。加入α-Syn抗體(1∶1000)4℃孵育過夜,PBS洗3次。加入Alexa Fluor 488 標記羊抗兔二抗(1∶1 000) 4℃孵育3 h,PBS洗3次。加入DAPI(1∶400),常溫孵育3 min。于干凈的載玻片滴加封片劑,常溫下避光晾干過夜,于激光共聚焦顯微鏡下觀察。
1.5 Western blot檢測SH-SY5Y細胞GTP-Rac1、GTP-Cdc42、GTP-RhoA蛋白表達 以含蛋白酶抑制劑的裂解液提取細胞總蛋白,90 mA恒流SDS電泳;90V恒壓轉膜120 min,將蛋白轉至硝酸纖維膜。于含5%脫脂奶粉的TBST封閉液常溫封閉常溫孵育1 h。4℃分別孵育GTP-RhoA、GTP-Rac1及GTP-Cdc42 (1∶1 000)過夜,TBST洗膜10 min 3次。常溫孵育過氧化物酶標記山羊抗兔IgG(1∶5000) 1 h,TBST洗膜10 min 3次。TBST洗膜10 min 3次,ECL光化學法顯色。凝膠成像系統分析掃描。
1.6 Pull down檢測Rac1、Cdc42、RhoA活性 0.5 mL預冷的細胞裂解液MLB裂解細胞10 min,離心收集上清。加入GST(100 μL/1 mL細胞裂解液),冰上孵育10 min,離心去除GST,收集上清。冰上取1 mL細胞提取液加入離心管中,并在離心管中加入20 μL Rac/Cdc42 Assay Reagent (PAK1 PBD,agarose)或 Rho Assay Reagent (Rhotekin RBD,agarose)冰上孵育2 h。離心去上清。500 μL Wash Buffer 洗滌沉淀,離心去上清。沉淀所得蛋白做Western blot 分析檢測GTP-Rac1、GTP-Cdc42、GTP-RhoA蛋白表達。
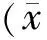
2 結果
2.1 流式細胞技術檢測SH-SY5Y細胞凋亡 Annexin V-FITC/PI雙染及流式細胞術檢測結果顯示,與對照組相比,α-Syn寡聚體誘導SH-SY5Y細胞凋亡率顯著增加。如圖1所示。
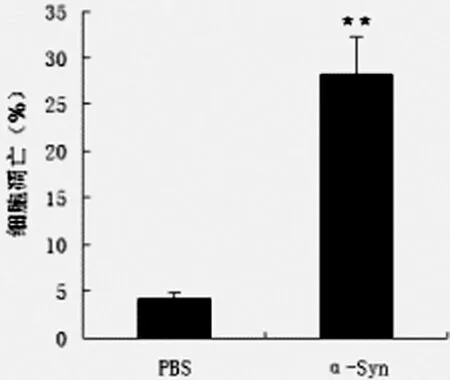
注:與 PBS對照組比較,**P<0.05
圖1 流式細胞技術檢測SH-SY5Y細胞凋亡的變化
2.2 免疫熒光檢測SH-SY5Y細胞內α-Syn陽性包涵體 α-Syn寡聚體誘導SH-SY5Y細胞凋亡模型。免疫熒光結果顯示,與對照組相比,α-Syn誘導SH-SY5Y細胞中α-Syn陽性包涵體數量增多。如圖2所示。
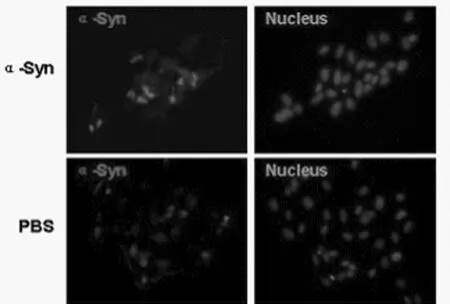
圖2 免疫熒光檢測SH-SY5Y細胞中α-Syn陽性包涵體(免疫熒光×400)
2.3 Pull down檢測Rac1、Cdc42、RhoA活性 α-Syn寡聚體誘導SH-SY5Y細胞凋亡模型。Pull down及Western blot檢測結果顯示,與對照組相比,α-Syn誘導SH-SY5Y細胞中GTP-Rac1、GTP-Cdc42、GTP-RhoA表達水平增高。表明Rac1、Cdc42、RhoA活性增高。如圖3所示。
3 討論
最近的研究提出,PD的病理生理過程可能與α-Syn陽性路易小體在中樞神經系統細胞間的播散有關[6]。研究發現,α-Syn寡聚體可以像“朊蛋白”一樣作為“種子”誘導正常構象的α-Syn蛋白錯誤折疊并成核聚集,在細胞內顆粒狀聚集,最終形成α-Syn陽性包涵體[7]。通過這種模式α-Syn陽性包涵體在細胞間播散通過這種模式α-Syn陽性包涵體在細胞間播散,導致神經元的損傷從黑質向其他腦區擴散。而抑制α-Syn寡聚體的胞間傳遞能夠阻斷LB的細胞間播散,從而減少神經元的損傷。
α-Syn寡聚體在神經元間傳遞過程中大量激活小膠質細胞。活化小膠質細胞爆發釋放氧自由基及細胞因子,最終導致DA能神經元損傷[8-9]。其次α-Syn寡聚體在多巴胺神經元中的傳遞啟動其自身凋亡程序,誘導多巴胺神經元的凋亡及壞死。因此,尋找α-Syn寡聚體多巴胺神經元間傳遞的相關信號通路,抑制α-Syn寡聚體神經元間的播散對于抑制PD的進展具有重要意義。
α-Syn寡聚體在神經元間傳遞與細胞吞噬功能密切相關。調節細胞吞噬功能的分子機制非常復雜,涉及胞內多條信號轉導通路。其中Rho GTPase尤其Rac1、Cdc42和RhoA是關鍵的調控因子,其在活性型和失活型之間循環,參與調節細胞骨架蛋白的聚合、解聚及重組的動態循環啟動并參與完成細胞吞噬全過程[10]。
本研究發現,α-Syn誘導的人神經母細胞瘤細胞凋亡與Rho GTPases信號通路的活化相關。由此我們推測,Rho GTPases信號通路的活化促進了α-Syn誘導的人神經母細胞瘤細胞凋亡。調控Rho GTPases信號通路的活性可能成為PD治療一個新的方向。
[1] Mollenhauer B, Forstl H, Deuschl G, et al. Lewy body and parkinsonian dementia: common, but often misdiagnosed conditions[J]. Deutsches Arzteblatt International, 2010,107(39): 684-691.
[2] Beraud D, Maguire-Zeiss KA. Misfolded alpha-synuclein and Toll-like receptors: therapeutic targets for Parkinson's disease[J]. Parkinsonism & Related Disorders, 2012,18(Suppl 1): S17-S20.
[3] Hosoi T, Ozawa K. Molecular approaches to the treatment, prophylaxis, and diagnosis of Alzheimer's disease: endoplasmic reticulum stress and immunological stress in pathogenesis of Alzheimer's disease[J]. Journal of Pharmacological Sciences, 2012, 118(3): 319-324.
[4] Mao Y, Finnemann SC. Essential diurnal Rac1 activation during retinal phagocytosis requires alphavbeta5 integrin but not tyrosine kinases focal adhesion kinase or Mer tyrosine kinase[J]. Molecular Biology of the Cell, 2012,23(6): 1 104-1 114.
[5] Tourkova IL, Shurin GV, Wei S, et al. Small rho GTPases mediate tumor-induced inhibition of endocytic activity of dendritic cells[J]. J Immunol, 2007, 178(12): 7 787-7 793.
[6] Braak H, Del Tredici K, Rub U, et al. Staging of brain pathology related to sporadic Parkinson's disease[J]. Neurobiology of Aging, 2003, 24(2): 197-211.
[7] Olanow CW, Brundin P. Parkinson's disease and alpha synuclein: is Parkinson's disease a prion-like disorder[J].Movement Disorders, 2013,28(1): 31-40.
[8] Depboylu C, Stricker S, Ghobril JP, et al. Brain-resident microglia predominate over infiltrating myeloid cells in activation, phagocytosis and interaction with T-lymphocytes in the MPTP mouse model of Parkinson disease[J]. Experimental Neurology, 2012, 238(2): 183-191.
[9] Kakita H, Aoyama M, Nagaya Y, et al. Diclofenac enhances proinflammatory cytokine-induced phagocytosis of cultured microglia via nitric oxide production[J]. Toxicology and Applied Pharmacology,2013,405(2):307-317.
[10] Tzircotis G, Braga VM, Caron E. RhoG is required for both Fcgamma R- and CR3-mediated phagocytosis[J]. Journal of Cell Science,2011,124(17):2 897-2 892.
(收稿2014-05-23)
Apoptosis induced by α-synuclein in SH-SY5Y cells associates closely with Rho GTPases signaling pathway activation
DingXuebing*,WangXuejing,MaMingming,TengJunfang
*DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhu450052,China
Objective To investigate the mechanism of the apoptosis induced by α-synuclein in SH-SY5Y cells. Methods SH-SY5Y cells apoptosis model induced by α-synuclein oligomers was established. Flow cytometry was performed to analyze the SH-SY5Y cell apoptosis. Immunofluorescence?stain was performed to detect α-synuclein-positive inclusions in SH-SY5Y cells. Pull down was performed to detect Rho GTPases signaling pathway activation in SH-SY5Y cells. Results Compared with the control group, the percentage of apoptotic cells,α-synuclein-positive inclusions and Rho GTPases signaling pathway in SH-SY5Y cells activity significantly increased in theα-synuclein oligomers group. Conclusion The apoptosis induced by α-synuclein oligomers in SH-SY5Y cells associate closely with Rho GTPases signaling pathway activation.
Rho GTPases signaling pathway; α-synuclein; SH-SY5Y cells; Apoptosis
國家自然科學基金項目(81301086,81100949)
R329.2+5
A
1673-5110(2014)23-0012-03

