兔脂肪間充質干細胞向胰島素樣分泌細胞分化及鑒定
郭 偉,孫 昱,楊海山
(吉林大學白求恩醫學部中日聯誼醫院 放射線科,吉林 長春130033)
脂肪間充質干細胞(adipose-derived mesenchymal stem cells,ADSCs)最早由Zuk[1]等人于2001年從抽脂術中抽取的脂肪組織中分離培養,近年來已成為醫學領域乃至整個生命科學領域的研究熱點。ADSCs是一種來源于脂肪組織中的多能干細胞,和骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs) 類似,也有很強的增殖能力和分化潛能。ADSCs能在不同的誘導微環境下向不同的組織細胞(如脂肪細胞、成骨細胞、內皮細胞、心肌細胞和神經細胞等) 分化[1]。本實驗在體外分離培養兔的脂肪間充質干細胞,通過相應的試劑使其誘導分化為類胰島素分泌細胞,并研究其生物學特性,以期為臨床采用ADSCs治療Ⅰ型糖尿病提供理論依據。
1 材料與方法
1.1 實驗動物
清潔級新西蘭大白兔3只,2.0-2.5 kg,雄性,購自吉林大學實驗動物中心,實驗過程中對實驗動物的處置符合《實驗動物管理條例》要求。
1.2 ADSCs的分離培養
將新西蘭大白兔以2 ml/kg標準,用濃度為1.5%的戊巴比妥經耳緣靜脈注射麻醉,無菌條件下獲取其腹股溝部位的脂肪組織,然后仔細清除脂肪外包被的筋膜及血管,用含雙抗的PBS反復沖洗多次,并將其剪碎成糊狀,再加入適量的0.15%Ⅰ型膠原酶,于37℃水浴恒溫搖床消化30-50 min。然后將其用100目篩網過濾,濾液以1 200 r/min離心5 min,棄去上層的脂肪滴及上清,將底部的沉淀用含10%胎牛血清的DMEM培養液重新懸浮,然后接種于培養瓶中。24小時后首次更換培養液,以后每三天更換一次。當貼壁細胞長滿瓶底壁面積的70%-80%后用0.25%的胰蛋白酶消化,以1∶2或1∶3比例傳代。
1.3 繪制細胞生長曲線
采用MTT法繪制ADSCs生長曲線:分別取第3、5、10代的ADSCs,以1×104/mL的密度分別接種于96孔培養板內,每孔200 μl;每天同一時間,每組各取3孔細胞,每孔加入5%四唑鹽(MTT)20 μl,孵育4小時后棄去孔內液體;用培養液洗兩次后分別加入150 μl二甲基亞砜(DMSO),輕微震蕩20 min后用酶標儀測定波長490 nm處各孔的吸光度(OD)。以3個平行樣品的平均值為縱坐標,以時間 (d) 為橫坐標,來繪制細胞生長曲線。
1.4 ADSCs向胰島素分泌細胞誘導分化并進行雙硫腙染色鑒定
取第三代脂肪間充質干細胞,以1×105/mL的密度接種于6孔板中,先用原有的無血清培養液于37℃,5%CO2條件下孵育12 h后,撤去上述培養液,然后根據實驗目的將培養的細胞分為對照組和誘導組分別培養。其中對照組只用單純的高糖DMEM進行培養,誘導組將分三個階段逐步進行誘導分化:(1)加入含有1 mmol/L 2-巰基乙醇、2 mmol/L 谷氨酰胺的高糖DMEM,培養2天;(2)加入含有10 μg/L 堿性成纖維生長因子、2% B27、10 μg/L 表皮生長因子、2 mmol/L 谷氨酰胺的高糖DMEM,培養6天;(3)加入含20 mmol/L 尼克酰胺、100 nmol/L胰高血糖素樣肽-1(glucagons-like peptide-1,GLP-1)、1 mmol/L 2-巰基乙醇的高糖DMEM,培養6天,并于相差顯微鏡下觀察各階段細胞的形態變化。然后分別取對照組和誘導組14 d的細胞爬片,再用0.1 mg/ml的雙硫腙溶液(將50 mg雙硫腙加入5 ml DMSO溶解作為儲備液,使用時取0.1 ml加入10 ml PBS中,將其抽濾后作為染色液)進行染色,于37℃下孵育15 min后,于倒置顯微鏡下觀察兩組細胞的著色情況。
1.5 葡萄糖刺激胰島素釋放試驗
取第三代脂肪間充質干細胞,以2×105/mL的密度接種于24孔板中,每孔細胞數量為1×105個,將其分為空白對照組、低糖刺激組和高糖刺激組。對照組為未誘導的脂肪間充質干細胞。低糖刺激組和高糖刺激組以上述方法進行誘導,并于誘導后第7天、14天和21天時,每組各取8個培養孔,分別加入低糖DMEM(10.0 mmol/L)和高糖DMEM(30.0 mmol/L)培養液0.5 ml,繼續培養24 h后,收集24孔板中的上清液,用Insulin-ELISA試劑盒檢測其胰島素含量。同時檢測對照組的細胞培養液,將其作為陰性對照。
1.6 ADSCs表面抗原標志檢測
取第三代脂肪間充質干細胞,先用0.25%的胰蛋白酶消化10 min,PBS沖洗3遍,離心后的沉淀用500 μL Binding Buffer緩沖液懸浮,然后分別與5 μL CD29-FITC,CD44-FITC,CD45-FITC,CD80-FITC室溫下避光孵育30 min,再用流式細胞儀檢測CD29,CD44,CD45,CD80的表達。
1.7 統計學方法
用SPSS 14.0軟件對數據進行統計,組間比較采用Student’st檢驗方法進行統計學分析。結果以Mean±S.D.表示,P<0.05表示結果具有顯著性差異。
2 結果
2.1 ADSCs的細胞形態
原代培養的兔ADSCs12小時開始逐漸貼壁,24小時完成貼壁, 其形態多呈短梭形或多角形。瓶內懸浮的球形或圓形的未貼壁細胞多為未除盡的血細胞,其在第一次更換培養液時即可除去。隨著培養時間延長,貼壁的細胞數量逐漸增多,形態變為長梭形,呈團簇狀生長,逐漸形成細胞集落(圖1)。第一代傳代細胞約2-4小時開始貼壁,12小時后開始快速增殖,約3天即可長滿培養瓶底壁(圖2)。實驗觀察結果顯示,兔的ADSCs可連續傳多代而保持原有的細胞形態和活力,適合作為組織工程的種子細胞。
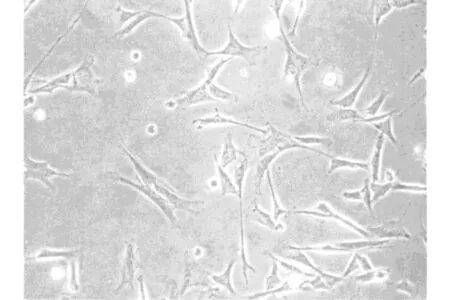
圖1 原代培養的兔ADSCs(×200倍)
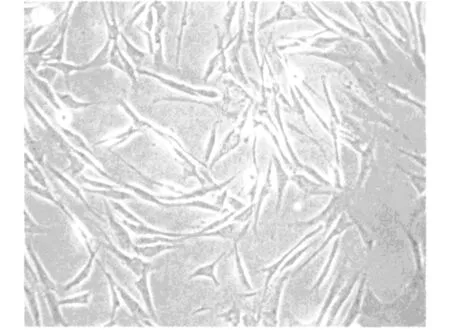
圖2 傳代培養的兔ADSCs(×200倍)
2.2 ADSCs的生長曲線分析
結果顯示,多代ADSCs的生長曲線形態相似(圖3),都于第3天進入對數生長期,第6天時達到峰值,約從第7天開始進入平臺期,呈典型的“S”形細胞成長曲線。說明兔ADSCs具有相對穩定的遺傳特性。

圖3 ADSCs的生長曲線
2.3 ADSCs向胰島素分泌細胞的分化
顯微鏡下觀察顯示,在誘導分化過程中的第一階段ADSCs細胞形態無明顯變化;第二階段細胞形態變橢圓,且折光度增強;到第三階段時細胞周邊突觸逐漸縮短,中心漸變圓,14天時可見半懸浮的胰島樣細胞團。誘導14天時的雙硫腙染色結果顯示:對照組細胞不著色;誘導組的細胞染色后呈棕紅色(圖4),證明該細胞團中有胰島素成分。
2.4 葡萄糖刺激胰島素釋放試驗結果
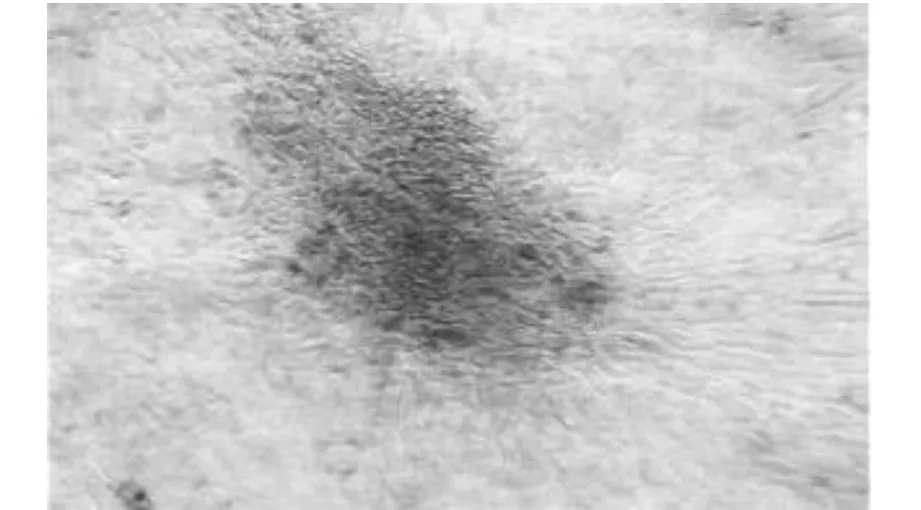
圖4 14天時ADSCs的雙硫腙染色結果
兔ADSCs誘導后第7天時低糖刺激組和高糖刺激組胰島素表達均為陰性;第14天培養液中可以檢測到胰島素分泌,低糖刺激組胰島素分泌量為13.2±2.1 μIU/ml,高糖刺激組其值為14.1±1.7 μIU/ml,兩組之間無顯著性差異(t=1.622,P>0.05);第21天時兩組胰島素濃度較第14天時均增高,其中低糖刺激組為17.1±2.2 μIU/ml,高糖刺激組為20.7±1.8 μIU/ml,兩組之間有顯著性差異(t=6.847,P<0.05)。空白對照組均未檢測出胰島素。
2.5 ADSCs表面標志檢測結果
結果(圖5)可見,CD29和CD44表達陽性,陽性率分別為99.98%和98.88%,而CD45和CD80表達陰性,檢出率分別為1.32%和2.32%。
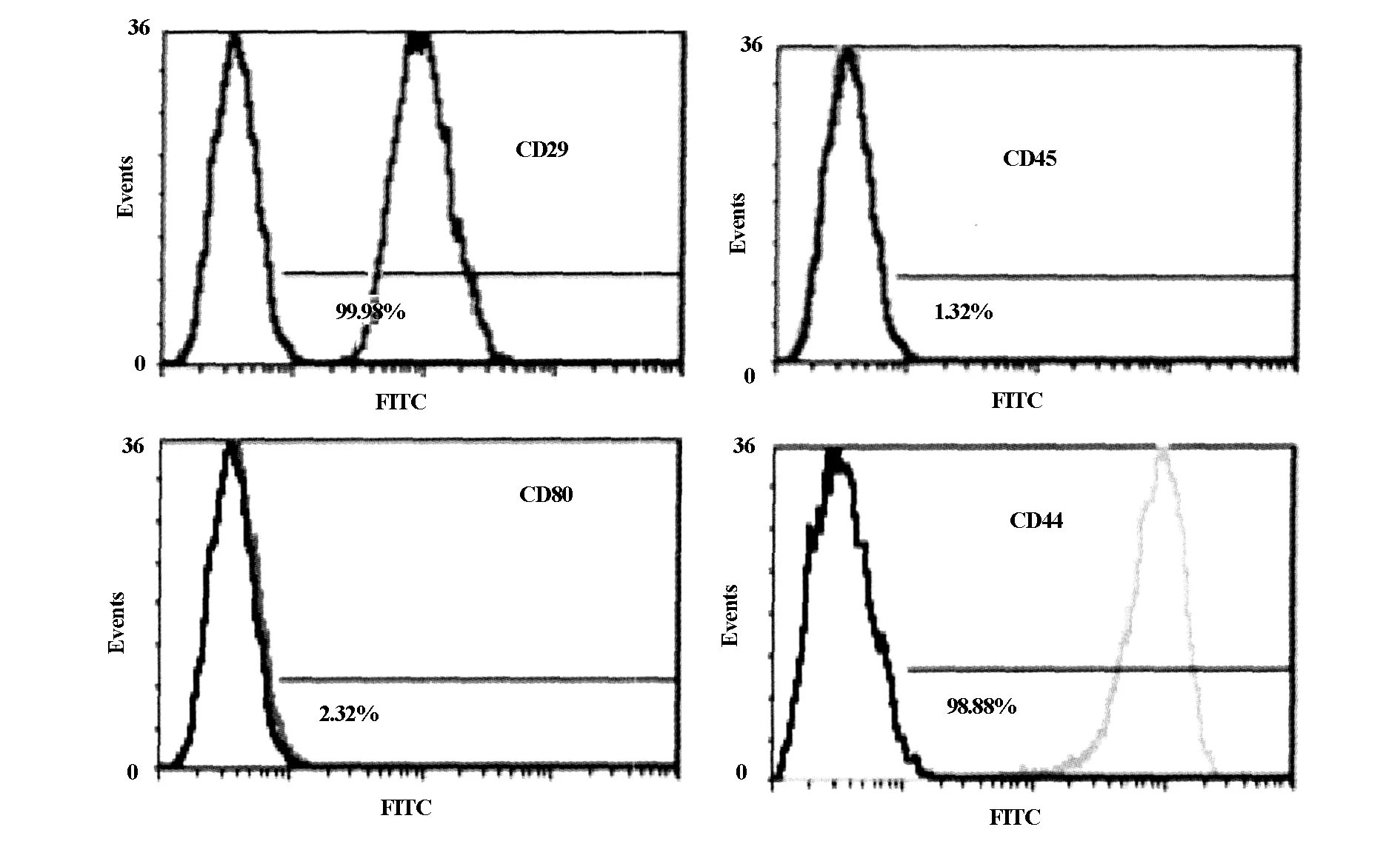
圖5 ADSCs的表面標志的流式檢測結果
3 討論
本實驗選用了以尼克酰胺和GLP-1為主要試劑的誘導方案,將ADSCs誘導分化為胰島素樣分泌細胞。其中尼克酰胺是一種ADP-核糖合成酶抑制劑,能促進內分泌細胞的分化,其主要是通過它的代謝產物煙酰胺腺嘌呤二核苷酸(NAD+)起作用。有研究表明尼克酰胺還可以促進干細胞的分化,促進胰島素分泌細胞的生成[2,3]。此外,尼克酰胺還能增加胚胎干細胞(ESCs)分化成胰島素分泌細胞的數量[4]。GLP-1是小腸L細胞分泌的一種腸降血糖素。它能刺激胰腺β細胞的分化和增殖,抑制β細胞凋亡[5],增加胰島β細胞的數量,從而促進胰島素的分泌。體外研究表明,GLP-1還可以誘導骨髓干細胞[6]、nestin陽性的胰島源性干細胞[7],使其分化為胰島素分泌細胞并分泌胰島素。
雙硫腙可與多種重金屬離子(鋅、鎘、鉛等)形成螯合物,是測定重金屬離子濃度的高靈敏試劑。胰島細胞由于含有鋅離子,能與雙硫腙螯合形成紫紅色的絡合物,呈陽性反應,因此可以用雙硫腙染色來鑒定胰島細胞[8]。在本實驗中,經過誘導14天后的ADSCs,培養瓶內的細胞團能夠被雙硫腙特異染色,說明該經過誘導14天后的ADSCs有細胞分化為胰島細胞。而且葡萄糖刺激胰島素釋放試驗陽性,說明ADSCs誘導分化的胰島素樣細胞可以分泌胰島素,并且隨著葡萄糖濃度的增加,其分泌量也明顯增加,證明ADSCs誘導后的胰島素樣細胞對糖刺激敏感,其胰島素的分泌受到外部環境中糖濃度的影響。實驗表明,誘導后的ADSCs具有類似體內胰島細胞的功能,并通過血糖變化調節胰島素分泌。
本實驗探討了CD29、CD44、CD45、CD80等相關表面抗原分子在ADSCs上的表達及其意義。CD29作為整合素家族之一,能介導細胞與細胞外基質黏附,參與免疫細胞黏附,為T細胞活化提供協同刺激信號;CD44是基質細胞表面抗原;CD45是造血干細胞表面標志[9];CD80,即B7-1,是一種重要的共刺激分子,表達在活化B細胞及其他APC表面,是T細胞表面CD28分子和細胞毒性T細胞相關抗原-4(CTLA-4)的配體,具有協同刺激分子的作用。本實驗中,用流式細胞儀檢測ADSCs表面的抗原標志物的表達,結果顯示CD29、CD44高表達,CD45、CD80表達呈陰性,與文獻報道相一致[10,11]。ADSCs高表達CD44,而不表達CD45說明ADSCs來自于基質細胞,而非血液循環中的造血干細胞,這也與其組織來源相吻合。
與干細胞的其他來源組織相比較,脂肪間充質干細胞易于體外培養,且可抑制免疫排斥反應,是一種適合的組織工程種子細胞。本實驗證明脂肪間充質干細胞還能誘導分化為類胰島素分泌細胞,發揮胰島素降血糖的作用,這為今后脂肪間充質干細胞用于Ⅰ型糖尿病的治療提供了理論依據。
作者簡介:郭偉(1981-),男,在讀醫學博士,主要從事脂肪間充質干細胞向胰島素分泌細胞的分化研究。
參考文獻:
[1]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279.
[2]Ramiya VK,Maraist M,Arfors KE,et al.Reversal of insulin-dependent diabetes using islets generated in vitro from pancreatic stem cells[J].Nat med,2000,6(3):278.
[3]Yang L,Li S,Hatch H,Ahrens K,et al.In vitro trans-differentiation of adult hepatic stem cells into pancreatic endocrine hormone-producing cells[J].PNAS,2002,99(12):8078.
[4]Vaca P,Bernat G,Martin F,et al.Nicotinamide induces differentiation of embryonic stem cells into insulin-secreting cells[J].Transplantation Proceedings,2003,35(5):2021.
[5]Brubaker PL,Drucker DJ.Glucagon-like peptides regulate cell proliferation and apoptosis in the pancreas,gut and central nervous system[J].Endocrinology,2004,145(6):2653.
[6]Tang DQ,Gao LZ,Brant R,et al.In vivo and in vitro characterization of insulin-producing cells obtained from murine bone marrow[J].Diabetes,2004,53(7):1712.
[7]Abraham EJ,Leech CA,Lin JC.Insulinotropic hormone glucagons-like Peptide-1 differentiation of human pancreatic islet-derived progenitor cells into insulin-producing cells[J].Endocrinology,2002,143(8):3152.
[8]孫 昱,王文加,楊海山,等.兔脂肪間充質干細胞胰島素分泌功能的體外誘導[J].中國生物制品學雜志,2008,05:378.
[9]Kim DH,Yoo KH,Choi KS,et al.Gene expression profile of cytokine and growth factor during differentiation of bone marrow-derived mesenchymal stem cell[J].Cytokine,2005,31(2):119.
[10]Suarez-Pinzon WL,Lakey JRT,Brand SJ,et al.Combination therapy with epidermal growth factor and gastrin induces neogenesis of human islet β-cells from pancreatic duct cells and an increase in functional β-cell mass[J].J Clin Endocrinol Metab,2005,90 (6):3401.
[11]De Ugarte D A,Morizono K,Elbarbary A,et al.Comparison of multi-lineage cells from human adipose tissue and bone marrow[J].Cells Tissues Organs,2003,174(3):101.

