水通道蛋白-8對結腸癌細胞凋亡及凋亡抑制蛋白的影響
李建強 張宏蕊 石曉明 呂柏楠
·論著·
水通道蛋白-8對結腸癌細胞凋亡及凋亡抑制蛋白的影響
李建強 張宏蕊 石曉明 呂柏楠
目的通過表達水通道蛋白-8(AQP-8)真核表達載體,觀察水通道蛋白AQP-8對HT-29細胞凋亡及凋亡抑制蛋白(IAPs)表達的影響。方法取對數生長期的人結腸癌HT-29細胞株用于實驗。構建AQP-8真核表達載體并轉染HT-29細胞,通過Western blot檢測GFP-AQP-8轉染效率;采用MTT法檢測各組細胞增殖抑制率;流式細胞術檢測細胞凋亡率;通過Real Time-PCR和Western blot檢測轉染GFP-AQP-8的HT-29細胞凋亡抑制蛋白(IAPs)家族成員c-IAP1、c-IAP2、XIAP、NIAP、Survivin和Livin表達水平。結果Western blot結果顯示,GFP-AQP-8轉染后結腸癌HT-29細胞AQP-8基因表達顯著上調(P<0.05)。MTT分析結果顯示,轉染了GFP-AQP-8的結腸癌HT-29細胞增殖抑制率顯著增加(P<0.05);流式細胞分析發現,轉染了GFP-AQP-8的HT-29細胞凋亡率顯著增加(P<0.05)。Real Time-PCR和Western blot結果顯示,與轉染GFP-N1的陰性對照組相比較,轉染了GFP-AQP-8的HT-29細胞c-IAP1、c-IAP1、XIAP、Livin和Survivin的mRNA和蛋白表達水平下降(P<0.05),NIAP表達變化不明顯(P<0.05)。結論過表達AQP-8可抑制HT-29細胞生長,并能通過下調c-IAP1、c-IAP1、XIAP、Livin和Survivin表達誘導HT-29細胞凋亡。
水通道蛋白-8;結腸腫瘤;凋亡;凋亡抑制蛋白
結腸癌是一種常見的消化道惡性腫瘤,世界范圍內惡性腫瘤死因中,其病死率居第二位[1]。結腸癌易發生浸潤和轉移的特點往往導致治療效果不佳。而在腫瘤浸潤和轉移過程中的代謝與營養交換離不開水分子的參與。水通道蛋白(aquaporins,AQPs)是一類廣泛存在于細胞膜上的、具有高選擇性的、特異轉運水分子的通道[2]。研究顯示,水通道蛋白在腫瘤的發生發展過程中發揮重要的作用[3],其中包括對腫瘤細胞凋亡的影響[4]。細胞凋亡抑制蛋白(inhibitaors of apoptosis proteins,IAPs)是一類重要的凋亡抑制因子,參與了多種細胞的凋亡調控。本文通過體外過表達AQP-8,觀察其對結腸癌細胞凋亡及IAPs家族成員表達的影響,報道如下。
1 材料與方法
1.1 實驗材料 結腸中分化腺癌細胞株HT-29,購自中國科學院上海生命科學研究院細胞資源中心。MTT,美國Sigma公司;DMEM/F12培養液、胰蛋白酶,Gibco公司;熒光定量RT-PCR試劑盒,美國Promega公司;ABI 7500 PCR儀,美國ABI公司;AQP-5、c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin及GAPDH抗體,美國Santa Cruz公司;PCR引物由上海生工生物工程有限公司合成;FASCalibur流式細胞儀,BD公司。
1.2 實驗方法
1.2.1 細胞培養:人HT-29細胞于含有10%胎牛血清、100 U/ml青霉素和100 g/ml鏈霉素的DMEM/F12培養基中培養,于37℃、5% CO2飽和濕度的恒溫培養箱中孵育。用0.25%胰蛋白酶溶液消化傳代。取對數生長期的細胞用于實驗。
1.2.2 GFP-AQP-8轉染和實驗分組:用軟件設計AQP-8基因特異性引物,提取HT-29細胞總RNA,采用RT-PCR法擴增AQP-8基因,與質粒載體GFP-N1進行酶切、鏈接,經過轉化、篩選、鑒定并測序。轉染前24 h于6孔板中接種HT-29細胞,密度為4×106個/ml。轉染前用無血清無抗生素的DMEM/F12清洗細胞,經脂質體介導法,按照試劑說明書用轉染試劑LipofectamineTM 2000將GFP-AQP-8或對照質粒GFP-N1轉染HT-29細胞。轉染24 h后,檢測轉染效率及PCNA和P53表達。實驗分組為:正常對照組、GFP-N1空載體組和GFP-AQP-8組。
1.2.3 MTT法檢測細胞增殖率:對數生長期的HT-29細胞用0.25%胰蛋白酶(含0.02% EDTA)溶液消化并接種于96孔板,接種密度為5×104個/ml,每組設6個復孔。各組細胞于實驗結束前4 h加入5 mg/ml的MTT 20 μl,繼續培養4 h后,棄去培養液,每孔加入DMSO 150 μl,室溫振蕩15 min至結晶完全溶解,用酶標儀于波長490 nm測吸光度OD值。以上實驗重復3次。增殖抑制率(%)=(1-試驗組OD值/對照組OD值)×100%。
1.2.4 流式細胞術檢測細胞凋亡率:用0.25%胰蛋白酶溶液消化細胞,4℃,500 g離心,去上清,沉淀中加入1 ml預冷的70%乙醇,輕輕吹打,4℃固定過夜。4℃,500 g,離心10 min,去上清,用1×PBS清洗2次。加入1 ml PI染液將細胞重懸,4℃避光染色30 min,流式細胞儀檢測。以上實驗重復3次。
1.2.5 RNA提取及Real Time-PCR:收集細胞,按照Invitrogen公司Trizol試劑的產品說明書要求,采用一步法提取RNA。測定RNA純度和濃度,并經1% 瓊脂糖凝膠電泳鑒定RNA完整性后,各組都取1 μg RNA,按試劑盒說明書要求進行反轉錄反應及熒光實時定量PCR反應。PCR反應參數為:95℃ 5 min預變性后,95℃變性30 s,60℃退火30 s,72℃延伸30 s,進行40個循環,于每個循環的延伸階段采集熒光信號。擴增結束后,以GAPDH為內參照基因,計算目的基因表達的相對定量值(RQ值)及以此為依據進行統計學分析。所用引物序列為如下:c-IAP1上游引物:5’-GAAGACATCTCTTCATCGAGG-3’,下游引物:5’-CCACAGGTGTATTCATCATGAC-3’c-IAP2上游引物:5’-TCCTAGCTGCAGATTCGTTC -3’,下游引物:5’-GGTAACTGGCTTGAACTTGAC-3’。XIAP上游引物:5’-GCACGAGCAGGGTTTCTTTATACTGGTG-3’,下游引物:5’-CTTCTTCACAATACATGGCAGGGTTCCTC-3’。NIAP上游引物:5’-CTGGGCCTAGATGCAGTTCAG -3’,下游引物:5’-ACGGCTCATAAGTCACAAAAGTC-3’。Survivin上游引物:5’-CTTTCTCAAGGACCACCGCA-3’,下游引物5’-GCCTCGGCCATCCGCT-3’。Livin上游引物:5’-AGTTCCTGCTCCGGTCAAAA-3’,下游引物5’-GCTGCGTCTTCCGGTTCTT-3’。GAPDH上游引物:5’-TGAACGGGAAGCTCACTGG-3’,下游引物5’-GCTTCACCACCTTCTTGATGTC-3’。
1.2.6 Western blot法檢測目的蛋白質表達:收集細胞,用預冷的1×PBS洗滌3次,于細胞裂解液中重懸細胞,冰上裂解間斷渦旋30 min后,4℃,8 000 r/min離心10 min,上清即為細胞總蛋白。用改良的Lowry法定量后,各組取等量的蛋白依次經聚丙烯酰胺凝膠電泳分離、電轉移至PVDF膜、5%脫脂奶粉室溫封閉后,分別用稀釋后的AQP-8、c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin及GAPDH一抗4℃孵育過夜,TTBS于室溫搖床振搖漂洗三次后加入相應二抗,室溫孵育2 h,化學發光法進行顯色,對條帶進行吸光度積分掃描。用各蛋白吸光度值/內參照吸光度值的比值進行比較。

2 結果
2.1 AQP-8真核表達載體轉染效率的鑒定 Western-blot結果顯示,轉染了GFP-N1空載體組的對照細胞中AQP-8表達非常低,而轉染了GFP-AQP-8的HT-29細胞AQP-8的表達顯著上調,表明GFP-AQP-8質粒轉染HT-29細胞后能高效表達AQP-8,而轉染GFP-N1空載體的陰性對照組與正常對照組的細胞相比,AQP-8的表達差異無統計學意義(P>0.05)。見圖1。
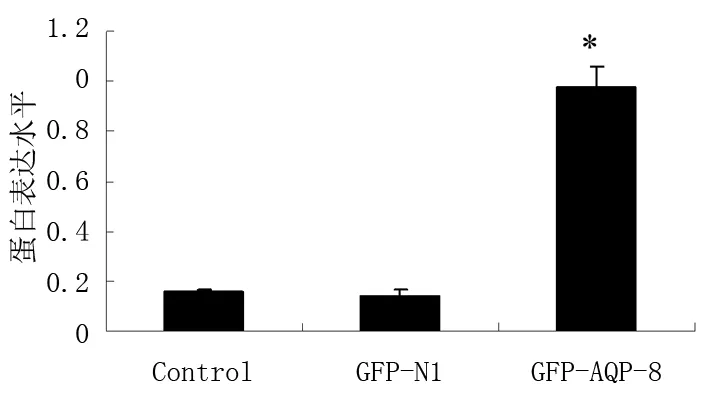
A
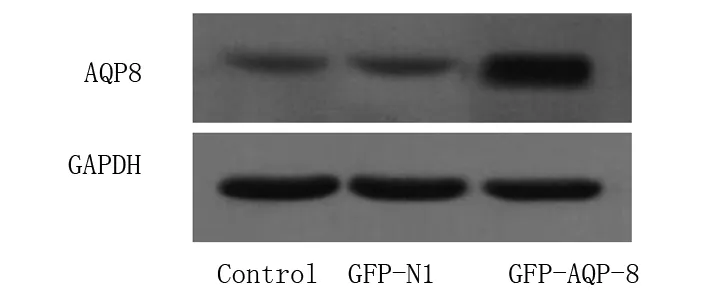
B
2.2 轉染GFP-AQP-8對HT-29細胞增殖的影響 MTT檢測轉染GFP-AQP-8對細胞增殖活力的影響,結果顯示,與轉染和GFP-N1的陰性對照組相比,轉染了GFP-AQP-8的HT-29細胞增殖抑制率顯著增加(P<0.05),提示上調AQP-8的表達可抑制HT-29細胞增殖。轉染GFP-N1空載體的陰性對照組與正常對照組的細胞相比,增殖抑制率差異無統計學意義(P>0.05)。見表1。
2.3 轉染GFP-AQP-8對HT-29細胞凋亡的影響 流式細胞術檢測轉染GFP-AQP-8對HT-29細胞凋亡的影響,結果顯示,與轉染和GFP-N1的HT-29的陰性對照組相比,轉染了GFP-AQP-8的HT-29的細胞凋亡率顯著增加(P<0.05),提示上調AQP-8的表達可促進HT-29細胞凋亡。轉染GFP-N1空載體的陰性對照組與正常對照組的細胞相比,細胞凋亡率差異無統計學意義(P>0.05)。見表1。
表1 HT-29細胞增殖抑制率和細胞凋亡率無變化 ±s
注:與GFP-N1組比較,*P<0.05
2.4 轉染GFP-AQP-8對HT-29細胞IAPs家族成員表達的影響 Real Time-PCR和Western blot分別檢測HT-29細胞IAPs家族成員c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin mRNA和蛋白表達,結果顯示,與轉染GFP-N1的陰性對照組相比,轉染了GFP-AQP-8的HT-29細胞c-IAP1、c-IAP1、XIAP、Livin和Survivin的mRNA和蛋白表達水平下降(P<0.05),NIAP表達變化不明顯(P>0.05),轉染GFP-N1空載體的陰性對照組與正常對照組相比,各因子表達差異無統計學意義(P>0.05)。圖2~4。
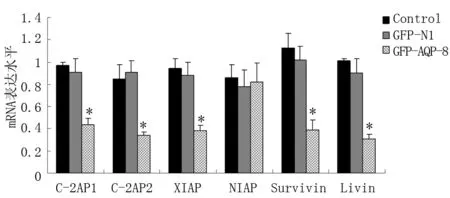
圖2 3組c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin mRNA 表達的變化
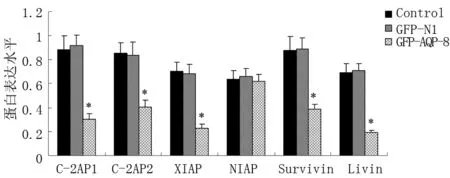
圖3 3組c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin 蛋白 表達的變化
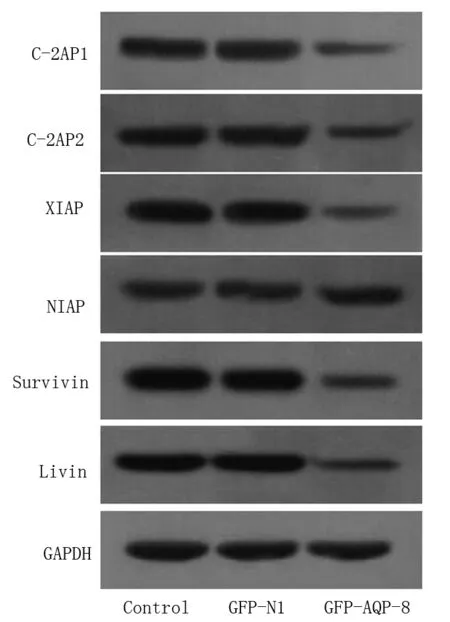
圖4 3組c-IAP1、c-IAP2、XIAP、NIAP、Survivin、Livin 蛋白 表達的變化(Western blot)
3 討論
細胞凋亡是細胞內正常的生理過程,可以消除機體內有害細胞,防止細胞的過度增殖。可見,凋亡是機體維持正常細胞功能的關鍵。而腫瘤的發生機制之一是細胞凋亡異常導致細胞的過度增生。近年來,一組廣泛存在于多種細胞內、具有抑制凋亡作用,被稱為凋亡抑制蛋白家族(inhibitor of apoptosis proteins,IAPs)的一類內源性凋亡抑制蛋白逐漸被關注。該家族成員具有結構同源性,與腫瘤、神經細胞凋亡有關,在人體內的過度表達可導致細胞凋亡不足最終形成腫瘤。以IAPs為靶點的治療可為臨床腫瘤治療提供新思路。
水通道蛋白(aquaporins,AQPs)是特異的轉運水分子的蛋白家族,主要功能是調節水進出細胞。在腫瘤細胞的高代謝過程中,水通道蛋白發揮這重要的作用。已有研究表明,AQPs表達與細胞凋亡密切相關,通過直接或間接改變AQPs表達可影響凋亡過程[5,6]。
然而,AQPs家族成員的表達模式不盡相同,比如在結腸癌組織中, AQP-5表達上調,AQP-8表達下調[7]。此外,AQP-8在結腸癌組織中低表達,在星形細胞瘤組織中AQP-8則高表達[8]。AQP-8在結腸癌組織中表達下調,且與淋巴結轉移及TNM分期相關[9],提示AQP-8在人結腸癌的發生、發展及轉移的過程中可能發揮重要作用。目前,AQP-8 在結腸癌中表達下調的機制研究相對較少。本研究通過體外過表達的方式,首次研究AQP-8對HT-29細胞凋亡及IAPs表達的影響。
本研究發現,過表達AQP-8可抑制HT-29細胞生長,促進其凋亡。細胞是否凋亡取決于促凋亡和抑凋亡蛋白之間的平衡,促凋亡蛋白表達增高和/或抑凋亡蛋白表達降低均可促進細胞凋亡。IAPs 蛋白通過與執行凋亡的酶類Caspase3/7/9結合,抑制其催化活性,阻斷細胞凋亡進程。本文明確了過表達AQP-8表達能促進凋亡后,接著對IAPs家族蛋白的表達進行檢測。c-IAP1和c-IAP2可直接抑制Caspase的活性[10]。XIAP的作用廣泛、穩定、高效,被認為最有效的Caspase抑制劑[11]。NIAP結構和功能與其他成員差別較大,大多關于NIAP的研究集中于神經系統。不過,已有研究顯示,乳腺癌中NIAP高度表達,且與預后相關[12]。Livin高表達于多種腫瘤,可通過抑制Caspase和激活TAK1/JNK1通路抑制細胞凋亡[13]。Survivin也是作用較強的凋亡抑制蛋白,在腫瘤的發生發展過程中發揮重要作用。我們的結果表明,過表達AQP-8不同程度下調了c-IAP1、c-IAP1、XIAP、Livin和Survivin的表達,但不影響NIAP表達,表明HT-29細胞中還存在其他分子調控IAPs家族成員的表達。
綜上所述,過表達AQP-8可能通過下調c-IAP1、c-IAP1、XIAP、Livin和Survivin表達誘導HT-29細胞凋亡,本研究為AQPs對結腸癌的作用研究及靶向性治療提供了新的依據。
1 László L.Predictive and Prognostric Factors in the complex treatment of patients with colorectal cancer.Magy Onkol,2010,54:383-394.
2 Maqni F,Sarto C,Ticozzi D,et al.Proteomic knowledge of humanaquaporins.Proteomics,2006,6:5637-5649.
3 Nico B,Ribatti D.Aquaporins in tumor growth and angiogenesis.Cancer Lett,2010,294:135-138.
4 Jablonski EM,Mattocks MA,Sokolov E,et al.Decreased aquaporin expression leads to increased resistance to apoptosis in hepatocellular carcinoma.Cancer Lett,2007,250:36-46.
5 Bell CE,Larivière NM,Watson PH,et al.Mitogen-activated protein kinase(MAPK) pathways mediate embryonic responses to culture medium osmolarity by regulating Aquaporin 3 and 9 expression and localization,as well as embryonic apoptosis.Hum Reprod,2009,24:1373-1386.
6 Lakner AM,Walling TL,McKillop IH,et al.Altered aquaporin expression and role in apoptosis during hepatic stellate cell activation.Liver Int,2011,31:42-51.
7 Wang W,Li Q,Yang T,et al.Expression of AQP5 and AQP8 in human colorectal carcinoma and their clinical significance.World J Surg Oncol,2012,10: 242.
8 朱淑娟,孫善全,許士葉,等.水通道蛋白4和8 在人不同病理級別星形細胞瘤組織中的表達.中國病理生理雜志,2012,28:796-801.
9 Fischer H,Stenling R,Rubio C,et al.Differential expression of aquaporin 8 in human colonic epithelial cells and colorectal tumors.BMC Physiol,2001,1: 1.
10 Sarela AI,Macadam RC,Farmery SM,et al.Expresssion of the antiapoptosis gene surviving predicts death from recurrent colorectal carci noma.Gut,2000,46: 645-650.
11 Eckelman BP,Drag M,Snipas SJ,et al.The mechanism of peptide-binding specificity of IAP BIR domains.Cell Death Differ,2008,15:920-928.
12 Maier JK,Balabanian S,Coffill CR,et al.Distribution of neuronal apoptosis inhibitory protein in human tissues.J Histochem Cytochem,2007,55:911-923.
13 Crnkovic-Mertens I,Hoppe-Seyler F,Butz K.Induction of apoptosis in tumor cells by siRNA-mediated silencing of the livin/ML-IAP/KIAP gene.Oncogene,2003,22:8330-8336.
·消 息·
請作者在寫論文時使用參考文獻
參考文獻不僅增加論文的學術性,而且表明論文的科學依據,也是對他人勞動成果的尊重。另外,凡無參考文獻的文章,國家進行論文統計時不予統計。因此,希望作者在寫論文時,凡在文中引用他人數據或觀點時,應使用參考文獻。并希望作者使用參考文獻時參照我刊稿約,按參考文獻的書寫要求書寫完整,且依論文中引用出現的先后進行參考文獻排序和在論文中作相應標注。參考文獻宜選用新近2~3年內的權威性國內外學術期刊,目前網上非文獻數據庫資料不宜引用。
本刊編輯部
EffectofAQP-8oncellapoptosisandexpressionofIAPsinhumancoloncancerHT-29cellsinvitro
LIJianqiang*,ZHANGHongrui*,SHIXiaoming,etal.
*DepartmentofSurgery,XinleSocialInsuranceWorkers’Hospital,Hebei,Xinle050700,China
ObjectiveTo investigate the effects of aquaporin-8 (AQP-8) on cell apoptosis and expression of inhibitors of apoptosis proteins(IAPs) by means of eukaryotic expression vector that expresses AQP-8 in human colon cancer HT-29 cells in vitro.MethodsHuman colon cancer HT-29 cells at logarithm growth period were used in the experiment.AQP-8 eukaryotic expression vector was constructed and transfected into HT-29 cells.Western Blot was used to detect the transfection efficiency;MTT assay was used to detect the cell growth inhibition rate;flow cytometry(FCM) was used to measure the cell apoptosis rate.The expression levels of mRNA and protein of IAPs including c-IAP1,c-IAP2,XIAP,NIAP,Survivin and Livin were detected by fluorescence quantitative Real-time RT-PCR and Western Blot.ResultsThe results by Western Blot showed that the expression levels of AQP-8 were significantly up-regulated in colon cancer HT-29 cells after GFP-AQP-8 transfection (P<0.05).MTT analysis showed that the proliferation inhibition rate was increased significantly in HT-29 cells after GFP-AQP-8 transfection,as compared with that in GFP-N1 control group (P<0.05).FCM analysis showed that GFP-AQP-8 transfection obviously induced HT-29 cell apoptosis (P<0.05).The results of fluorescence Real-time quantitative RT-PCR and Western Blot showed that the expression levels of mRNA and protein of c-IAP1,c-IAP1,XIAP,Livin,and survivin in HT-29 cells were significantly decreased by AQP-8 overexpression (P<0.05).However,the expression levels of NIAP mRNA and protein had no obvious change (P>0.05).ConclusionThe overexpression of AQP-8 can inhibit growth of HT-29 cell and can induce HT-29 cell apoptosis by down-regulating the expression levels of c-IAP1,c-IAP1,XIAP,Livin and survivin.
aquaporin-8;colonic neoplasms;apoptosis;inhibitor of apoptosis proteins
10.3969/j.issn.1002-7386.2014.22.005
050700 河北省新樂市社會保險職工醫院外科(李建強、張宏蕊);河北省人民醫院普外二科(石曉明、呂柏楠)
呂柏楠,050051 石家莊市,河北省人民醫院;
E-mail: shixiaoming1999@126.com
R 753.3+5
A
1002-7386(2014)22-3378-04
2014-05-15)

