USP22及其可能靶點在結直腸癌中的表達研究
姜爭 劉彥龍 王錫山
細胞周期對于維持細胞的正常生長發育分化是必須的,其各個水平都受到多種因子的嚴格調控以確保其正常進行,其中去泛素化酶也是近年來發現的細胞周期的一個關鍵調控因子。細胞周期中許多重要的調控因子如細胞周期蛋白激酶CDKs和蛋白激酶抑制因子等均通過泛素化,進而由蛋白酶體降解。去泛素化酶可在蛋白酶體上將底物蛋白的泛素分子解離出來再循環,從而維持泛素水平與蛋白酶體功能穩定,控制細胞周期調控因子的活性和功能,這一類去泛素化酶又被稱為管家去泛素化酶。有些去泛素化酶是通過調控泛素連接酶的穩定性和活性來發揮調節細胞周期的作用。去泛素化酶還可以通過影響細胞核轉錄因子的穩定性發揮調控細胞周期的作用。關于USP22如何調控細胞周期的機制并不明了。本文著重探討了USP22與可能靶點之間的聯系,以期初步確定USP22調控細胞周期的機制。
材料與方法
一、材料
選取哈爾濱醫科大學附屬三院2006至2007年間手術切除的82例結直腸癌患者的新鮮組織作為實驗對象,包括癌旁黏膜82例及其相配對的腺癌82例。同時收集研究病例的臨床病理資料,包括患者的年齡、性別、分化程度、腫瘤大小、浸潤深度及有無淋巴結和遠處轉移等。
二、實驗方法
1.儀器與試劑:二氧化碳(CO2)培養箱、熒光定量PCR儀、凝膠成像分析儀、水浴搖床、超純水儀。USP22、BMI-1、c-Myc、cyclin D2、p14ARF、p16INK4a、GAPDH探針購自于美國Applied Biosystems公司。定量PCR相關試劑:RNA抽提試劑盒(上海生工)、TRIzol試劑(Invitrogen)、High-Capacity cDNA Reverse Transcription Kits(Applied Biosystems)、TaqMan?Universal PCR Master Mix(Applied Biosystems)。
2.USP22及其靶點的mRNA檢測:采用RT-PCR法,按試劑盒操作說明書分別提取總RNA 1 μg,RNA水平(μg/ml)=稀釋倍數×OD260值×40。RT-PCR反應體系:0.1 μg/μl cDNA 2.0 μL,上下游引物各0.5 μL,TaqMan?Universal PCR Master Mix 10 μl,加雙蒸水(ddH2O)至20 μl。擴增條件:先95℃預變性10 min;接著進行40個循環,包括95℃ 15 s和60℃ 1 min。
三、統計學分析
用配對t檢驗 mRNA 表達差異;用One-Way ANOVA 分析各與臨床病理參數間的關聯性;用 Pearson coefficient 分析各基因間的關聯性。P<0.05為差異有統計學意義。
結 果
一、與癌旁組織相比,USP22 mRNA在癌組織中的表達顯著升高
經t檢驗分析,USP22mRNA在癌癥組織中的表達顯著高于癌旁組織(P<0.0001,圖1)。
二、USP22及其靶點在轉錄水平上的關聯性分析結果
去泛素化酶是近年來發現的細胞周期的一個關鍵調控因子。這一調控過程是極為復雜的,涉及到細胞周期的多個水平。在這里,我們首先分析了USP22、BMI-1、c-Myc、p16INK4a、p14ARF和cyclin D2 在轉錄水平上的關聯性(表1)。統計學分析顯示,USP22 mRNA的表達與BMI-1 mRNA(r=0.790,P<0.0001),c-Myc mRNA(r=0.528,P<0.0001)、cyclin D2 mRNA(r=0.657,P<0.0001),但是與p16INK4a mRNA(r=0.103,P=0.358)和p14ARF mRNA(r=0.039,P=0.731)無關。
三、mRNA聚類分析結果
為了確定上述基因的mRNA表達特點,我們采用k-均值聚類分析。分析結果顯示USP22、BMI-1、c-Myc和cyclin D2的表達呈聚集現象。按照四者的表達量可將其分為三組:高表達組16例、中表達組55例和低表達組11例。與臨床資料相對比,四者的表達與AJCC的分期進展顯著相關(P=0.005,圖2)。
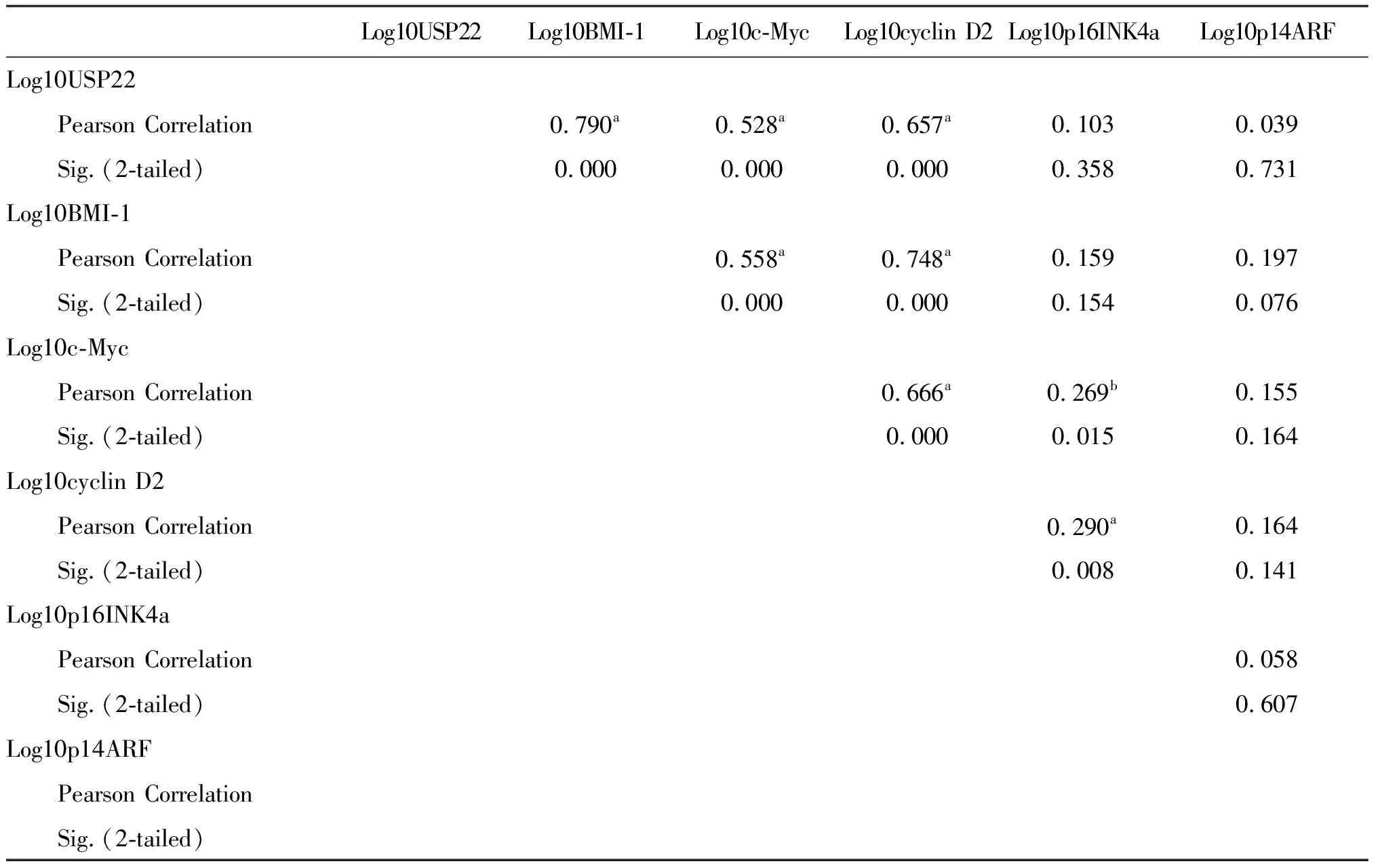
表1 82例腸癌患者mRNA轉錄水平上的關聯性分析

注:c為腫瘤組;n為對照組
討 論
越來越多的實驗證實了BMI-1致癌基因相關的PcG途徑是調節正常干細胞和癌癥干細胞的主要機制[1-3]。到目前為止,很多實驗結果都顯示USP22和BMI-1在功能上存在很多交叉。因此,有學者提出USP22和BMI-1可能構建一個共同體來調節腫瘤的進展[4]。此外,USP22為c-Myc功能所需,而BMI-1與c-Myc一起參與小鼠T、B細胞淋巴瘤的發生。這些資料提示我們USP22、BMI-1、c-Myc三者間存在密切聯系。故我們首先探討了USP22、c-Myc和BMI-1之間的關聯性。在我們的實驗中,無論是在轉錄水平還是在蛋白水平,USP22、c-Myc和BMI-1之間均呈顯著正相關。
PI3K/Akt通路廣泛存在細胞中,是參與細胞生長、增殖、分化調節的信號轉導通路。關于PcG蛋白參與Akt通路調節的研究少有報道。Lee JY[5]等報道在乳腺癌組織中,MEL-18與AKT的活性呈負相關;MEL-18的表達減弱乳腺癌細胞的增長,導致G1期停滯,其可能的機制為通過不依賴INK4a/ARF的方式促使Akt通路失活進而下調cyclin D和p27 KIP1。為了確認USP22是否能夠調控Akt通路,我們檢測并確認了USP22、BMI-1、pAkt(Ser 473)和pAkt(Thr 308)的關聯性。我們發現,USP22和BMI-1均與pAkt(Ser 473)和pAkt(Thr 308)呈正相關,這提示我們USP22可直接或者通過BMI-1介導活化 Akt通路。因為PI3K可通過Akt、mTOR將有絲分裂信號傳遞給 p70 S6K1,使細胞周期主要蛋白如細胞周期素(cyclin D)的翻譯上調,促進G1期進展,使細胞周期加速,因此我們同時檢測并分析了cyclinD2與pAkt(Ser 473)和pAkt(Thr 308)的相關性。我們發現,cyclin D2的表達與pAkt(Ser 473)和pAkt(Thr 308)的表達呈明顯正相關。因此,USP22調節細胞周期的機制有可能是通過cyclin D2介導Akt通路的活性。
總之,USP22、BMI-1、c-Myc、cyclin D2無論在轉錄水平還是在蛋白水平均呈顯著相關性,并且通過k-均值聚類分析示四者表達的高低與結直腸癌的臨床分期呈正相關,提示USP22、BMI-1、c-Myc、cyclin D2四者間存在調控結直腸癌進展的機制。另外,上述四者的蛋白表達與p16INK4a和p14ARF的蛋白表達無相關性,但是均與Akt的活性呈正相關,提示USP22可能是通過不依賴INK4a/ARF的方式,而通過調節Akt的活性來控制細胞周期的進展。
[1] Park IK,Qian D,Kiel M,et al.Bmi-1 is required for maintenance of adult self-renewing haematopoietic stem cells.Nature,2003,423(6937):302-305.
[2] Lessard J,Sauvageau G.Bmi-1 determines the proliferative capacity of normal and leukaemic stem cells.Nature.,2003,423(6937):255-260.
[3] Brabletz T,Jung A,Reu S,et al.Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment.Proc Natl Acad Sci USA,2001,98(18):10356-10361.
[4] Molofsky AV,Pardal R,Iwashita T,et al.Bmi-1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation.Nature,2003,425(6961):962-967.
[5] Zhang XY,Varthi M,Sykes SM,et al.The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell-cycle progression.Mol Cell,2008,29(1):102-111.

