海帶灼燒后碘元素存在形式的實驗探究
方向東 但世輝
(1湖北襄陽市第一中學 湖北 襄陽 441000;2湖北襄陽市東風中學 湖北 襄陽 441004)
一、問題的提出
人教版《化學必修2》第四章第一節[實驗4-2]“證明海帶中存在碘元素”的實驗中有這樣的描述:“海帶灼燒后的灰燼中碘元素以I-形式存在,H2O2可以將I-氧化為碘單質”[1]。我們知道海帶中碘的確是以I-的形式存在的,那么為什么灼燒后碘元素還能以I-形式存在呢?灰化過程中I-會不會被氧化呢?I-需要什么樣的外界條件以及氧化產物是什么?這幾個問題很是值得探索,為此筆者作了如下探究。
二、對書中結論的驗證
根據教材中描述,再加上實驗經驗,我們可以得出有關I-存在形式的兩個結論:一、含I-固體在加熱過程中不會被氧化,即不會變質生成I2;二、含I-固體久置后會變質,并且呈現淺黃色[2]。為驗證這兩條結論,我們做了如下對照實驗(簡稱實驗1):分別取含有I-、純凈的KI固體和已經泛黃的KI固體置于表面皿中,將漏斗倒扣在固體上方,并且用細線系上濕潤的淀粉試紙懸在漏斗內 (圖1)加熱,實驗現象見表1。
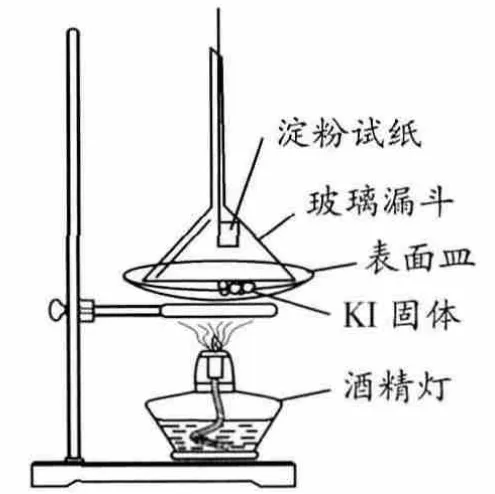
圖1 加熱KI固體實驗裝置圖

表1 加熱兩種固體時的不同現象
從上述現象可以發現:空氣中久置的KI固體已經變質,變質產物為碘單質,而純凈KI固體即使在空氣中加熱也可穩定存在。這一不同現象說明含I-的KI的氧化條件除了氧氣之外還必然存在其它的限制條件,否則KI在被加熱時一定會被氧化,于是筆者做了進一步探究。
三、對變質條件的探究
空氣中的氣體主要有N2、O2、CO2等氣體,顯然可排除N2對I-被氧化的影響,那么會不會是CO2參與了I-被氧化的過程? 對此猜測,筆者又進行了如下實驗:將實驗1中加熱變質KI的剩余固體溶于試管中,向其中加入BaCl2溶液(濃度較大),可觀察到有少量白色沉淀產生。這一現象也驗證了筆者的猜測:CO2參與了氧化KI的過程并且生成了CO32-。那么CO2在氧化過程中到底起何作用呢?筆者又進行了如下實驗:取10mL KI溶液(濃度較大)于5支試管中,向試管中通入CO2氣體或者滴加鹽酸,一段時間后對比試管中的顏色深淺,之后向試管中滴入淀粉溶液,再次對比試管中的顏色深淺,具體實驗現象見表2。
通過以上實驗現象我們可以得出以下結論:CO2氣體同鹽酸一樣在KI被氧化的過程中用于提供酸性環境,并且酸性越強生成的碘單質越多,氧化越容易。因此,KI在空氣中變質至少有O2、CO2、H2O這3種氣體的參與,H2O作為CO2的溶劑產生H+(筆者曾將純凈的KI固體放入一瓶干燥的CO2氣體中,數日后觀察KI仍未變黃),具體的化學反應方程式應為:4KI+
四、對已有結論的反駁
有人認為KI在空氣中泛黃變質是由于發生了如下反應:4KI+O2+2H2O=4KOH+I2,筆者照此反應模
擬了相對應的條件:在試管中加入10mL蒸餾水,用燃燒匙盛放純凈的KI固體置于試管中,并向其中通入純凈的O2,密封試管(圖2)。數日觀察后發現KI依然為白色粉末,不曾見有任何黃色。根據這一現象可知上述方程式顯然不符合事實。并且,假如按照上述反應進行生成KOH和I2,根據常識可知I2和KOH是不能共存的。
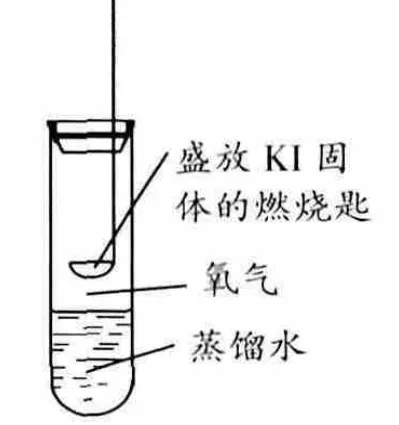
圖2 Kl固體氧化裝置
此外將圖2裝置中的氣體換成純凈的CO2氣體,數日之后可觀察到KI固體 “泛黃”,這一現象再次證明CO2的參與是KI被氧化必須具備的條件。
綜上:含I-的KI固體被氧化的過程除了應有O2的參與外,CO2和水蒸氣也是必備的物質。由于空氣中CO2和水蒸汽的含量很低,導致在加熱含I-的KI的過程中這兩種氣體很容易被“驅散”,不能很好地與KI接觸,KI自然就不能被氧化。但在保存碘化鉀固體的時候,雖然空氣中CO2和水蒸氣的含量較低,但碘化鉀遇光和空氣會緩慢游離出碘單質而變黃。所以,實驗4-2“證明海帶中存在碘元素”的實驗中的描述是準確的,灼燒后碘元素還能以I-形式存在,灰化過程中I-會不會被氧化。
[1] 宋心琦主編.普通高中課程標準實驗教科書:化學2(必修)[M].北京:人民教育出版社,2007:91
[2] 劉懷樂編.中學化學思維[M].重慶:重慶出版社,2009:279-281

