髓樣相關蛋白8/14在痛風急性發作期的表達
張卓君 孫穎 陳慧勇 馬莉莉 魏蕾 姜林娣
(復旦大學附屬中山醫院風濕免疫科,上海 200032)
髓樣相關蛋白(myeloid-related protein,MRP)主要在單核細胞和巨噬細胞等髓系來源的細胞中表達,以MRP8/14復合物形式存在于細胞質內。MRP8/14被證實在多種疾病中高表達,包括感染性疾病、自身免疫性疾病、急性冠脈綜合征以及某些腫瘤等,它參與調控腫瘤壞死因子α(tumor necrosis factor α,TNF-α),白細胞介素1(interleukin-1,IL-1)、IL-8、IL-12、IL-16[1-7]。目前,尿酸鹽結晶誘導IL-1β分泌被認為是痛風性關節炎發作的主要機制[8]。Holzinger等[9]的研究發現,MRP8/14是促使尿酸鹽結晶誘導IL-1β分泌的內生因子。本研究旨在觀察MRP8/14在痛風急性發作階段的變化規律,探討其臨床價值。
1 資料與方法
1.1 一般資料 選擇2012年7月—2013年8月在復旦大學附屬中山醫院風濕免疫科門診就診的痛風急性發作患者40例以及痛風間歇期患者24例。40例痛風急性發作患者中男性39例,女性1例;年齡16~79歲,平均年齡(51.25±12.44)歲;平均體質量指數(body mass index,BMI )為(25.26±4.02)kg/m2;平均病程為(90.58±86.85)個月。痛風急性發作患者入選標準:(1)按照1977年美國風濕病學會(American College of Rheumatology,ACR)標準診斷為急性痛風性關節炎;(2)發作3 d內;(3)不伴有其他可能導致MRP升高的合并疾病(包括感染性疾病、自身免疫性疾病、急性冠脈綜合征以及腫瘤等)。24例痛風間歇期患者中男性23例,女性1例;年齡39~89歲,平均年齡(57.75±12.49)歲;平均BMI為(26.23±3.29)kg/m2;平均病程為(47.00±59.35)個月。痛風間歇期患者入選標準:(1)既往診斷為痛風但近3個月內無急性發作;(2)不伴有其他可能導致MRP升高的疾病。同時,收集我院內科門診12例健康體檢志愿者,其中男性5例,女性7例;年齡23~39歲,平均年齡(28.08±4.56)歲。收集樣本前均獲得研究對象的知情同意。
1.2 方法 采集研究對象隨機外周靜脈血,分離血清并保存于-80 ℃,采用MRP8/14酶聯免疫吸附(enzyme-linked immunosorbent assay,ELISA)試劑盒(美國Alpco 公司)定量檢測MRP8/14水平。痛風采集急性發作期患者關節炎緩解前后的靜脈血,同步測定血清尿酸(serum uric acid,SUA)、血沉(erythrocyte sedimentation rate,ESR)、高敏C-反應蛋白(high-sensitivity C-reactive protein,hs-CRP)水平。
1.3 統計學處理 采用SPSS 17.0 統計軟件進行統計學分析。痛風急性期患者關節炎緩解前后血清MRP8/14水平的比較采用配對t檢驗;多組間比較采用Kruskal-Wallis H檢驗,進一步兩兩比較采用Mann-Whitney U檢驗;MRP與ESR及hs-CRP的相關分析采用Pearson相關系數法。采用受試者工作特征(receiver operating characteristic,ROC)曲線計算MRP8/14診斷痛風急性發作的最佳分界值,計算ROC曲線下面積以及敏感度和特異度。以P<0.05為差異有統計學意義。
2 結 果
2.1 一般資料比較 本研究中痛風急性期患者及間歇期患者的年齡、性別構成、BMI差異均無統計學意義,但急性期患者病程較長(P<0.05)。12例既往無特殊疾病史的健康體檢志愿者中女性比例較高(P<0.01),且相對年輕(P<0.01)。目前尚無文獻報道年齡及性別與MRP水平有明顯相關性。
2.2 痛風患者急性期和緩解期MRP8/14水平比較 32例急性發作患者在癥狀緩解后3個月內復診,癥狀緩解后患者MRP8/14水平為(337.62±285.79)mg/L,明顯低于發作時的(1165.58±878.62)mg/L(P<0.01)。
2.3 急性期痛風患者、間歇期痛風患者、健康體檢者MRP8/14水平比較 痛風急性發作患者MRP8/14水平明顯高于間歇期患者及健康體檢者(P<0.01),而間歇期患者MRP8/14水平與健康體檢者比較差異無統計學意義。見表1。
患者ESR及hs-CRP在急性期、緩解期、間歇期差異無統計學意義,見表1;將ESR、hs-CRP分別與MRP8/14水平行相關分析,未見明顯相關性(|r|分別為0.03、0.23,P>0.05)。
因多數痛風患者在急性發作后3個月內已開始接受降尿酸治療,故SUA水平較急性期低;間歇期患者多處于降尿酸治療中,故SUA水平也較低。見表1。
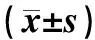
表1 各組患者SUA、ESR、hs-CRP、MRP8/14比較
2.4 MRP8/14診斷痛風急性發作的分界值 建立MRP8/14診斷痛風急性發作的ROC曲線,Youden指數達到最大值為55.3%,取得相對應最佳分界值為504.00 mg/L,ROC曲線下面積為0.852(95%CI:0.770~0.934),靈敏度為77.5%,特異度為77.8%。見圖1。
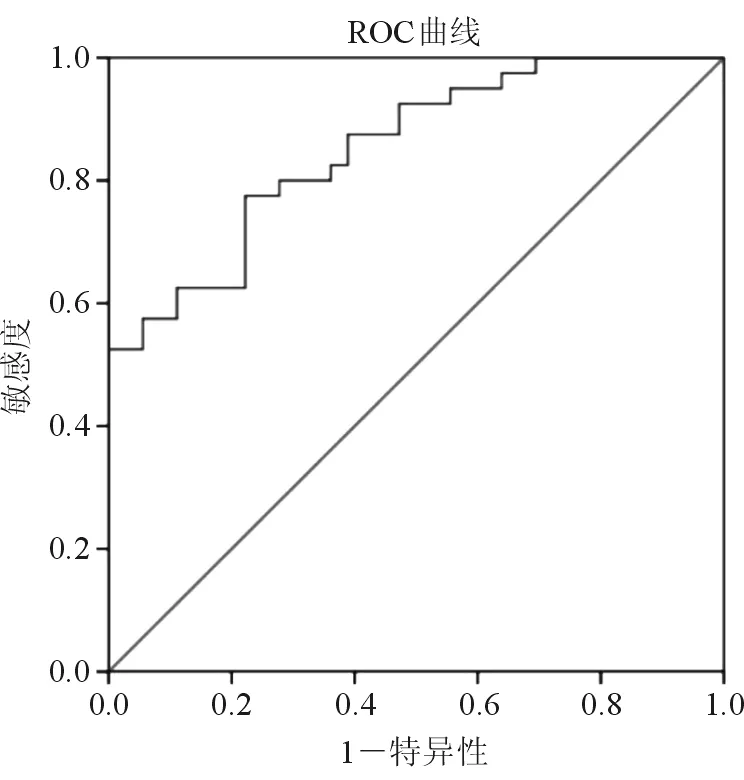
圖1 MRP8/14診斷痛風急性發作的ROC曲線
3 討 論
MRP8和MRP14具有特征性鈣衛蛋白S100家族4-螺旋環形和EF手型結構,同時具有強烈的形成異源二聚體的趨勢。異源二聚體的形成導致鉸鏈區3-螺旋和2-鈣黏環結構改變,暴露其與靶蛋白的結合位點,通過與相應的效應靶蛋白相互作用,可傳遞Ca2+信號并調節胞質中的Ca2+濃度,從而發揮其在調節體內鈣離子穩態、平滑肌收縮、細胞增殖和凋亡、炎性反應等生理和病理過程中的重要生物學功能[1-2]。MRP8/14在單核細胞和巨噬細胞中高表達,而炎性病變早期滲出的炎性細胞也表達MRP8/14;MRP8/14作為中性粒細胞化學趨化性和黏附性的強有力的誘導劑,在炎性反應過程中發揮重要作用[10]。
高尿酸血癥患者并不一定出現痛風發作,在體外研究[9]中,如果沒有促IL-1β前體因子(例如脂多糖類)的協同刺激,尿酸結晶不會誘導IL-1β分泌。MRP8/14作為誘導IL-1β分泌的內生因子,在炎性反應被激活后分泌增加,與其他促IL-1β內生因子協同作用,導致IL-1β分泌增加,當IL-1β積累到一定量時,即出現急性發作。本研究結果證實,痛風急性發作患者血清MRP8/14水平較間歇期及健康體檢者顯著升高,在癥狀緩解后明顯下降,而間歇期患者的MRP8/14水平與健康體檢者相似,由此證明MRP8/14可作為痛風急性發作的生化標志物。
本研究顯示,ESR及hs-CRP在痛風急性期、緩解期、間歇期差異無統計學意義,提示兩者對痛風性關節炎的診斷效率較低。MRP8/14濃度與ESR及hs-CRP水平并不相關,結果與國外的文獻[4-5]報道一致,表明MRP升高的內在機制與ESR及hs-CRP不同,提示其特定的臨床價值。
本研究嘗試建立MRP8/14診斷痛風急性發作的分界值,在滿足較高靈敏度及特異度的前提下,最佳分界值為504.00 mg/L,但此結論尚需大樣本研究進一步的驗證和完善。
目前,對于預測痛風疾病活動度缺乏客觀有效的評價方法。臨床實踐中,很多患者在降尿酸治療初期因SUA波動致痛風急性發作或發作持續時間延長,影響患者的治療信心和用藥依從性。我國痛風治療指南推薦在急性發作緩解至少2周后加用降尿酸藥物,在最初1個月,需聯合應用抗炎藥物以預防急性關節炎復發;而2012年ACR痛風治療指南中提及,在急性發作期,如果已有抗炎藥物有效預防,降尿酸治療并非禁忌,其中合并預防發作用藥的推薦時間比國內指南更長,為達標后3~6個月。
綜上所述,應盡可能地減少痛風患者在治療過程中的急性發作,以提高患者的生活質量及治療依從性,同時也不應忽視長期應用預防發作用藥的不良反應。如果進一步的研究能證實MRP8/14可作為疾病活動度的長期監測指標,將有利于制定個體化治療方案,更合理地選擇藥物種類、用藥時機以及藥物劑量。MRP8/14參與痛風急性發作的作用機制尚待進一步研究。
[1]Malemud CJ.Myeloid-related protein activity in rheumatoid arthritis[J].Int J Inflam, 2011,2011: 580295.
[2]Katano M,Okamoto K,Suematsu N,et al.Increased expression of S100 calcium binding protein A8 in GM-CSF-stimulated neutrophils leads to the increased expressions of IL-8 and IL-16[J].Clin Exp Rheumatol,2011,29(5):768-775.
[3]Rahman MT,Myles A,Gaur P,et al.TLR4 endogenous ligand MRP8/14 level in enthesitis-related arthritis and its association with disease activity and TLR4 expression[J].Rheumatology(Oxford),2014,53(2):270-274.
[4]Poon PY,Szeto CC,Kwan BC,et al.Relationship between myeloid-related protein 8/14 and survival of Chinese peritoneal dialysis patients[J].Kidney Blood Press Res,2012,35(6):489-496.
[5]Vora AN,Bonaca MP,Ruff CT,et al.Diagnostic evaluation of the MRP-8/14 for the emergency assessment of chest pain[J].J Thromb Thrombolysis,2012,34(2):229-234.
[6]Nistala K,Varsani H,Wittkowski H,et al.Myeloid related protein induces muscle derived inflammatory mediators in juvenile dermatomyositis[J].Arthritis Res Ther, 2013,15(5):R131.
[7]Kim HA,An JM,Nam JY,et al.Serum S100A8/A9,but not follistatin-like protein 1 and interleukin 18,may be a useful biomarker of disease activity in adult-onset Still′s disease[J].J Rheumatol,2012,39(7):1399-1406.
[8]Burns CM,Wortmann RL.Gout therapeutics:new drugs for an old disease[J].Lancet,2011, 377(9760):165-177.
[9]Holzinger D,Nippe N,Vogl T,et al.Myeloid-related proteins 8 and 14 contribute to monosodium urate crystal-induced inflammation in gout[J].Arthritis Rheumatol,2014.[Epub ahead of print]
[10]Schnekenburger J,Schick V,Krüger B,et al.The calcium binding protein Sl00A9 is essential for pancreatic leukocyte infiltration and induces disruption of cell-cell contacts[J].J Cell Physiol,2008,216(2):558-567.

