microRNAs在脂多糖誘導的結腸癌細胞炎性反應模型中的表達
吳海波 才志剛 張紹明 張珩 汪雷 徐小平
(中國人民解放軍第四五五醫院心胸外科,上海 200052)
結腸癌的發生、發展與結腸細胞的炎性反應密切相關。長期慢性炎性反應能夠促使結腸細胞過度增殖,引起DNA的不可逆損傷,進而啟動并促進細胞的惡性轉化,最終導致腫瘤的發生、發展及免疫抑制[1]。結腸癌細胞炎性反應的發生與Toll樣受體、C反應蛋白(CRP)、白介素-6 (IL-6)等多種分子的表達異常密切相關[2-3]。最近有研究[4]表明,腫瘤局部炎性反應的發生與微小核糖核酸microRNAs(miRNAs)的異常表達有關。miRNAs是一類具有轉錄后調節活性的單鏈小分子RNA,能夠與其他分子組裝成沉默復合體 (RISC)。RISC通過作用于mRNA的3′端非編碼區,可抑制翻譯或直接促使mRNA降解,從而在轉錄或轉錄后水平負性調節蛋白的表達,調控細胞活動,進而參與機體的生理病理過程[5-7]。本研究探討了miRNAs在脂多糖(LPS)誘導的結腸癌細胞HT-29細胞炎性反應模型中的表達。
1 資料與方法
1.1 試劑 實時熒光定量PCR反應混合液購自日本TOYOBO 公司,Trizol購自美國Invitrogen公司,三氯甲烷、異丙醇、乙醇購自中國國藥集團化學試劑有限公司,高糖型DMEM購自美國Gibco公司,LPS購自美國Sigma公司。
1.2 實驗方法
1.2.1 細胞培養及炎性反應誘導 HT-29細胞培養于含10%胎牛血清和100 U/mL青鏈霉素混合液的DMEM培養基中,待細胞增殖達培養皿底的80%時,棄培養液,用磷酸鹽緩沖液(PBS)清洗,0.25% EDTA-胰酶消化細胞;加入培養基,調整細胞密度至1×105個/mL,按每孔2 mL接種于6孔細胞培養板中繼續培養,12 h后,加入終濃度為400 ng/mL的LPS,孵育48 h后收獲細胞(LPS組)。將未經LPS處理的細胞作為對照組。
1.2.2 細胞總RNA抽提 將6孔細胞培養板中的HT-29細胞用預冷的PBS漂洗后,加入1 mL Trizol室溫裂解5 min;將裂解后的細胞移至離心管中,加入200 μL氯仿,劇烈混勻,室溫放置2 min;12 000 r/min 4 ℃離心15 min,上層水相轉移至新的無RNA酶的1.5 mL離心管中;向離心管中加入1 mL的異丙醇,-20 ℃沉淀過夜;12 000 r/min 4 ℃離心15 min,可見白色的沉淀,棄上清液,以75%乙醇清洗RNA斑塊,7500 r/min于4 ℃離心5 min,棄上清,自然晾干,以無RNA酶的水溶解。
1.2.3 實時熒光定量PCR檢測miRNA的表達 先應用反轉錄引物(頸環結構)將miRNAs反轉錄成cDNA,然后采用實時熒光(SYBR染料)定量PCR檢測miRNAs的表達量。PCR結束后,以GAPDH作為內參,采用2-△△Ct方法,計算各樣本的miRNAs的相對濃度。miRNAs反轉錄及定量PCR引物序列見表1~2。

表1 miRNAs反轉錄引物序列
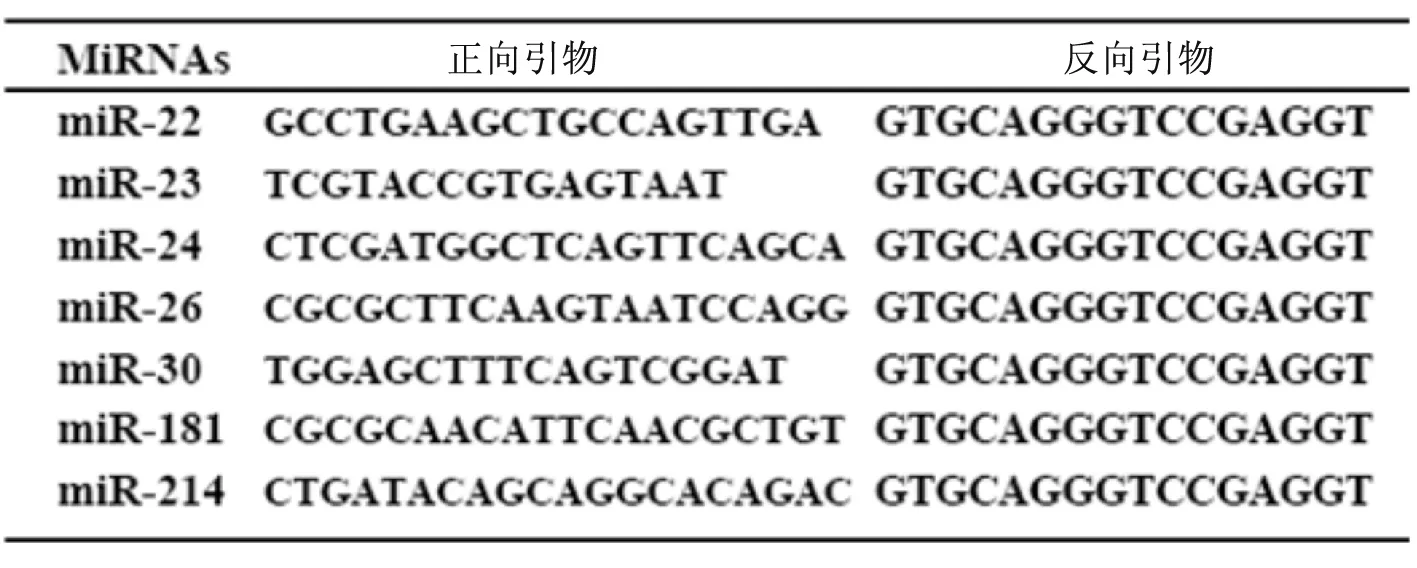
表2 miRNAs定量PCR引物序列
2 結 果
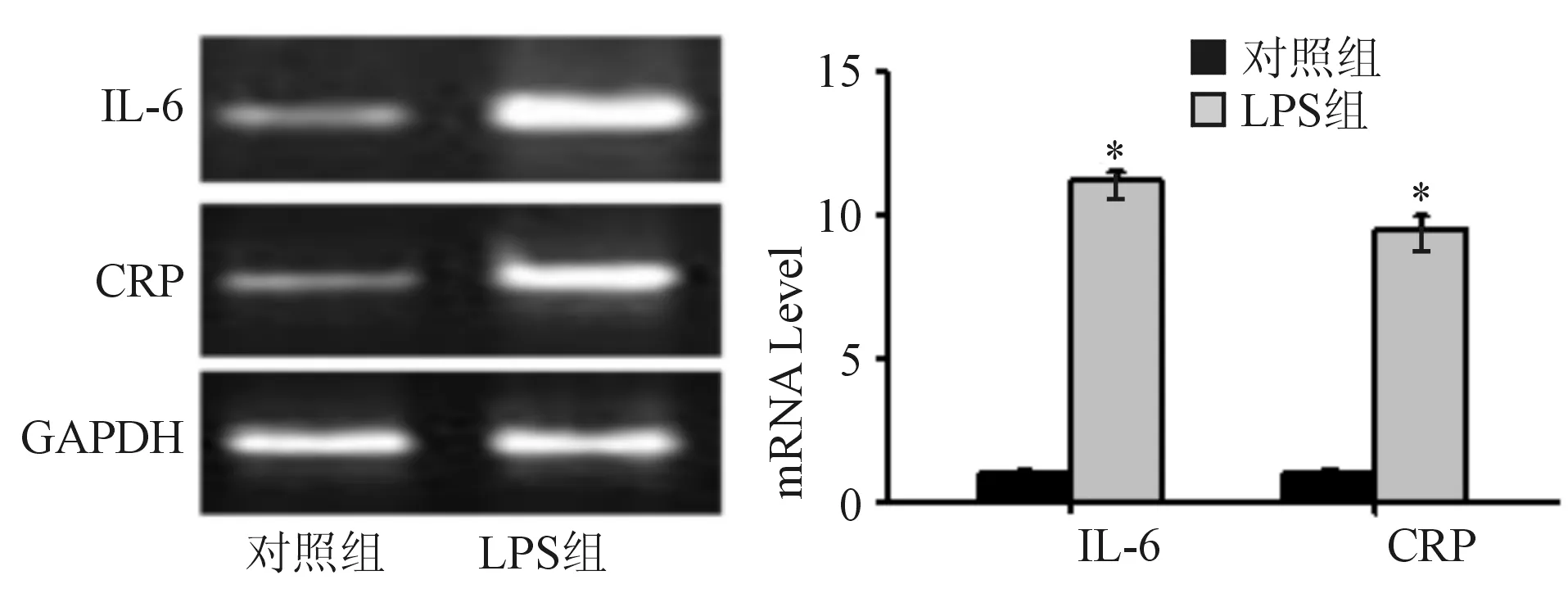
圖1 LPS組與對照組IL-6和CRP的表達水平比較
與對照組比較,*P<0.01
2.1 HT-29細胞炎性反應模型的建立 實時熒光定量PCR結果表明,LPS組細胞中IL-6和CRP的表達水平較對照組高,差異有顯著統計學意義(P<0.01),表明LPS誘導的HT-29細胞炎性反應模型建立成功。見圖1。
2.2 miRNAs在兩組細胞中的表達水平 通過文獻[8-10]分析,我們初步篩選了在腫瘤發生中發揮重要作用的miRNAs,在本實驗中,我們將miR-22、miR-23、miR-24、miR-26、miR-30、miR-181和miR-214作為檢測對象。實時熒光定量PCR檢測發現,LPS組細胞中miR-22、miR-26、miR-214的表達水平較對照組低,而miR-23的表達較對照組高(P<0.05);兩組miR-24、miR-30、miR-181的表達水平差異無統計學意義,見圖2。
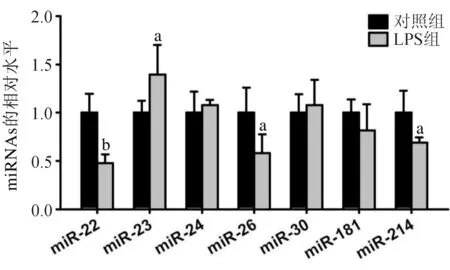
與對照組比較,aP<0.05, bP<0.01
3 討 論
miRNAs參與結腸癌發生的各個環節,miR-21的表達從癌前病變到晚期癌組織逐漸增加[11];miR-135a和miR-135b通過調控Wnt信號通路在結直腸癌發病機制中發揮重要作用[12];miR-21和miR-196a參與結直腸癌的轉移調控[13-14]。
由于結腸癌是一種炎性反應相關性腫瘤,本實驗研究了結腸癌細胞受到LPS誘導的炎性反應刺激后,miRNA表達的改變,結果發現,LPS組細胞中miR-22、miR-26、miR-214的表達較對照組下降(P<0.05),miR-23的表達則升高,提示miRNAs參與結腸癌的局部炎性反應。雖然本研究中miR-24、miR-30、miR-181在LPS誘導的HT-29細胞炎性反應模型中表達未發生改變,但這并不代表這些miRNAs在結腸癌細胞炎性反應中不發揮作用。因此,miRNAs在不同類型的結腸癌細胞炎性反應模型中的表達和功能仍有待于進一步探討。
目前,臨床上已經開始將多種抗炎藥物,如糖皮質激素、維生素D3受體激動劑、趨化因子拮抗劑、非類固醇類抗炎藥等試驗性應用于腫瘤的預防和癌癥的輔助治療[9-10],而在腫瘤炎性反應起到關鍵作用的細胞、細胞因子和酶等都有潛力作為腫瘤治療的靶點。隨著在腫瘤炎性反應中miRNA研究的深入,其有望成為控制結腸癌炎性反應的新靶點,以miRNA為靶點的新型抗癌藥也將在抑制腫瘤的炎性反應中發揮重要作用。
[1]Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature,2008,454(7203): 436-444.
[2]Machida K, Tsukamoto H, Mkrtchyan H, et al. Toll-like receptor 4 mediates synergism between alcohol and HCV in hepatic oncogenesis involving stem cell marker Nanog [J]. Proc Nat l Acad Sci USA,2009,106(5):1548-1553.
[3]Sun Q, Liu Q, Zheng Y, et al. Rapamycin suppresses TLR4-triggered IL-6 and PGE(2) production of colon cancer cells by inhibiting TLR4 expression and NF-kappaB activation [J]. Mol Immunol,2008, 45(10):2929-2936.
[4]馬一杰,陳貝貝,尚藝曼,等. microRNA在大腸癌診治中的研究進展[J].中國醫藥導報,2012,9(15):8-23.
[5]Nie J, Liu L,Zheng W, et al. microRNA-365, down-regulated in colon cancer, inhibits cell cycle progression and promotes apoptosis of colon cancer cells by probably targeting Cyclin D1 and Bcl-2 [J]. Carcinogenesis,2012, 33(1): 220-225.
[6]Zhang L, Volinia S, Bonome T,et al. Genomic and epigenetic alterations deregulate microRNA expression in human epithelial ovarian cancer [J]. Proc Natl Acad Sci USA,2008, 105(19): 7004-7009.
[7]Frankel LB, Christoffersen NR,Jacobsen A, et al.Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells [J]. J Biol Chem,2008, 283(2): 1026-1033.
[8]Nesaretnam K, Meganathan P. Tocotrienols: inflammation and cancer [J]. Ann N Y Acad Sci,2011, 1229(1):18-22.
[9]Mbeunkui F, Johannn DJ Jr. Cancer and the tumor microenvironment: a review Of an essential relationship [J]. Cancer Chemother pharmacol, 2009, 63(4):571-582.
[10]Umezawa K. Possible role of peritoneal NF-K B in peripheral inflammation and cancer: Lessons from the inhibitor DHMEQ [J]. Biomed Pharmacother, 2011, 65(4):252-259.
[11]Yamamichi N, Shimomura R, Inada K, et al. Locked nucleic acid in situ hybridization analysis of miR-21 expression during colorectal cancer development [J]. Clin Cancer Res, 2009, 15(12):4009-4016.
[12]Nagel R, le Sage C, Diosdado B, et al. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer [J]. Cancer Res, 2008, 68(14):5795-5802.
[13]Schimanski CC, Frerichs K, Rahman F, et al. High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells[J].World J Gastroenterol, 2009,15(17):2089-2096.
[14]Asangani IA, Rasheed SA, Nikolova DA, et al. MicroRNA-21 (miR-21) post transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J].Oncogene, 2008, 27(15):2128-2136.

