免疫組化法檢測非小細胞肺癌EGFR突變的進展
劉暢 徐東波 鐘殿勝
目前,全世界范圍內肺癌的發病率和病死率居各類惡性腫瘤之首[1].大部分肺癌患者診斷時已是晚期而喪失了手術機會,也因此無法獲得手術標本[2].約70%的肺癌患者是靠小的活檢標本和/或細胞學切片標本診斷的,并且這些小標本是僅有的可用于突變檢測的材料[3,4].經典的DNA直接測序法可檢測所有已知和未知突變,被稱為表皮生長因子受體(epidermal growth factor receptor,EGFR)突變檢測的"金標準",但其靈敏度較低,對樣本所含腫瘤細胞數量要求較高,僅能對含量大于30%的突變基因進行檢測[5],當其用于小標本檢測時,會使其假陰性率大幅增加[4,5].因此,相當一部分本可以從EGFR酪氨酸激酶抑制劑(EGFR-tyrosine kinase inhibitor, EGFRTKI)獲益的患者仍不能被檢出.隨著介入影像學和微創活檢技術的進展,如支氣管內超聲引導下經支氣管針吸活檢術(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA),應用小標本進行臨床病理檢測的趨勢勢必會延續[6].近些年來隨著分子水平技術的發展,涌現出一些檢測基因突變更為靈敏的方法,如應用特異性探針的實時定量聚合酶鏈式反應(TaqMan PCR assay)、擴增阻滯突變系統技術(amplified refractory mutation system, ARMS)、聚合酶鏈式反應-單鏈構象多態性分析(PCR-single-strand conformation polymorphism,PCR-SSCP)、變性高效液相色譜分析(denaturing highperformance liquid chromatography, dHPLC)和高分辨率熔解曲線分析(high-resolution melting analysis, HRMA)等[7-10].但這些方法或因其價格昂貴,操作復雜,耗時長,對實驗環境、操作人員水平及設備要求高,尚未廣泛應用于臨床.免疫組織化學染色法較分子水平的檢測手段價格低廉,操作簡便、迅速,可在幾乎所有病理實驗室開展.因此,對突變特異性抗體的免疫組化法應用可作為分子水平檢測方法的一種輔助手段.
已有大量文獻及臨床資料[11,12]證實存在EGFR基因突變的非小細胞肺癌(non-small cell lung cancer, NSCLC)患者對EGFR-TKIs的治療有良好反應,歐美地區NSCLC患者EGFR突變發生率約為10%-16%,亞裔NSCLC患者的EGFR突變發生率約為30%-50%.其突變主要發生在EGFR酪氨酸激酶結構域的ATP結合位點的編碼區,即第18-21外顯子,其中發生在19外顯子的E746_A750缺失突變(屬于15-bp/5AA缺失)和21外顯子上的L858R點突變被稱為經典型突變,約占EGFR突變的85%-90%[13,14].19外顯子缺失突變包含如9-bp、12-bp、15-bp、18-bp、24-bp缺失突變等,其中以15-bp缺失的E746_A750del突變最為常見,約占19外顯子缺失突變的68%,其余稍常見的少見型諸如18-bp缺失的L747_P753>S(6.7%),15-bp缺失的L747_T751del(6.4%),9-bp缺失的L747_E749del(6.4%)等[15].21外顯子突變中,L858R點突變為最常見的類型,約占所有EGFR突變的39%[16],其它少見型如L861Q突變等.除此之外,約有6%-10%為發生在18和20外顯子的突變[16].
2009年,Yu等[l7]在新西蘭大白兔體內獲得了兩種單克隆抗體,即抗E746_A750缺失突變抗體和抗L858R點突變抗體,隨后他們搜集了340例原發性NSCLC患者,并用這兩種抗體測試上述腫瘤標本,所得的免疫組化結果與DNA直接測序結果比較顯示靈敏度92%,特異度99%.近些年來,多項研究[4,15-24]應用上述相同的兩種抗體進一步檢測NSCLC患者EGFR突變情況,免疫組化結果示靈敏度范圍波動于24%-100%,特異度范圍波動于77%-100%(表1).在表1所列的11項有關免疫組化法檢測特異性EGFR突變的研究中,均表現出較高的特異度,其中9項的特異度可高達96%及以上;但靈敏度浮動范圍較大,最低僅有24%.回顧上述文獻,分析影響免疫組化結果的原因,主要可能與免疫組化過程中抗原修復液的不同、免疫組化結果評判標準不同、是否加做總EGFR抗體檢測等有關.下文將對上述主要影響因素做詳細闡述.
1 抗原修復液的不同對免疫組化染色結果的影響
抗原修復是免疫組化染色中的重要步驟之一,通常用于福爾馬林固定的石蠟包埋組織切片,由于組織中的部分抗原在甲醛固定過程中發生了蛋白之間的交聯,加之醛基的封閉作用,從而使抗原決定簇暴露不完善.此時則需抗原修復液,使抗原決定簇充分暴露,以利抗原抗體結合,提高檢測的陽性率[25].
北京大學第一醫院的熊焰等[24]在2013年研究免疫組化法檢測EGFR突變的實驗中,選取了三種不同的抗原修復液:檸檬酸鈉溶液(pH 6.0)、EDTA(pH 8.0)和EDTA(pH 9.0),分別用于50例經福爾馬林固定、石蠟包埋的肺腺癌組織切片免疫組化染色過程中.染色結果示:EDTA(pH 8.0)處理過的組織切片顯色最佳,即特異性染色強,背景色最淺;檸檬酸鈉(pH 6.0)組陽性細胞染色太淺以致很難將其識別出;EDTA(pH 9.0)組背景染色太強以致難以區分出腫瘤細胞染色.讀片病理醫師間的一致度在EDTA(pH 8.0)組最高,檸檬酸鈉(pH 6.0)組次之,EDTA(pH 9.0)組最低,并且其差異有統計學意義.究其理論依據:抗原在不同pH值環境中,等電點會發生改變,抗原抗體表面電荷的改變影響二者結合,造成在不同pH值的抗原修復液中染色強度不同[25].
2 免疫組化染色結果的不同評判標準
目前對于免疫組化法的特異性染色結果尚無統一的評判標準,由于評分方法紛繁眾多,尚缺乏大宗實驗驗證所有方法中哪種方法最優,但大部分方法都是以陽性細胞百分比與染色強度相結合的方式評判[4,15-24].陽性細胞標準有僅基于胞膜染色的[15,19,23],也有基于胞膜和/或胞漿染色的[4,17,18,22].應用較多的是Yu等[17],在大白兔體內獲得兩種特異性抗體之后,行特異性免疫組化染色所用標準.其將結果分為0-3+四個等級,以腫瘤細胞的胞膜和/或胞漿染色為基準,0為腫瘤細胞無染色或<10%的腫瘤細胞淺染;1+為>10%的腫瘤細胞淺染;2+為腫瘤細胞中度染色;3+為腫瘤細胞強染.1+-3+為陽性,0為陰性[17].此后,Simonettis[18]、Hofman等[22]也應用同樣方法判讀結果,與分子水平的檢測手段相比,均表現出較高的特異度,但靈敏度變化范圍較大,低至24%,高至93%,考慮其差異還可能來源于評判標準以外的因素:比如所選樣本中突變樣本所占比例不同(所含突變樣本越多,被檢出突變的概率越高);除最常見的19外顯子的E746_A750缺失突變和21外顯子的L858R點突變外,其它少見型突變由于不能與上述兩種特異性抗體反應進而不能被檢出.
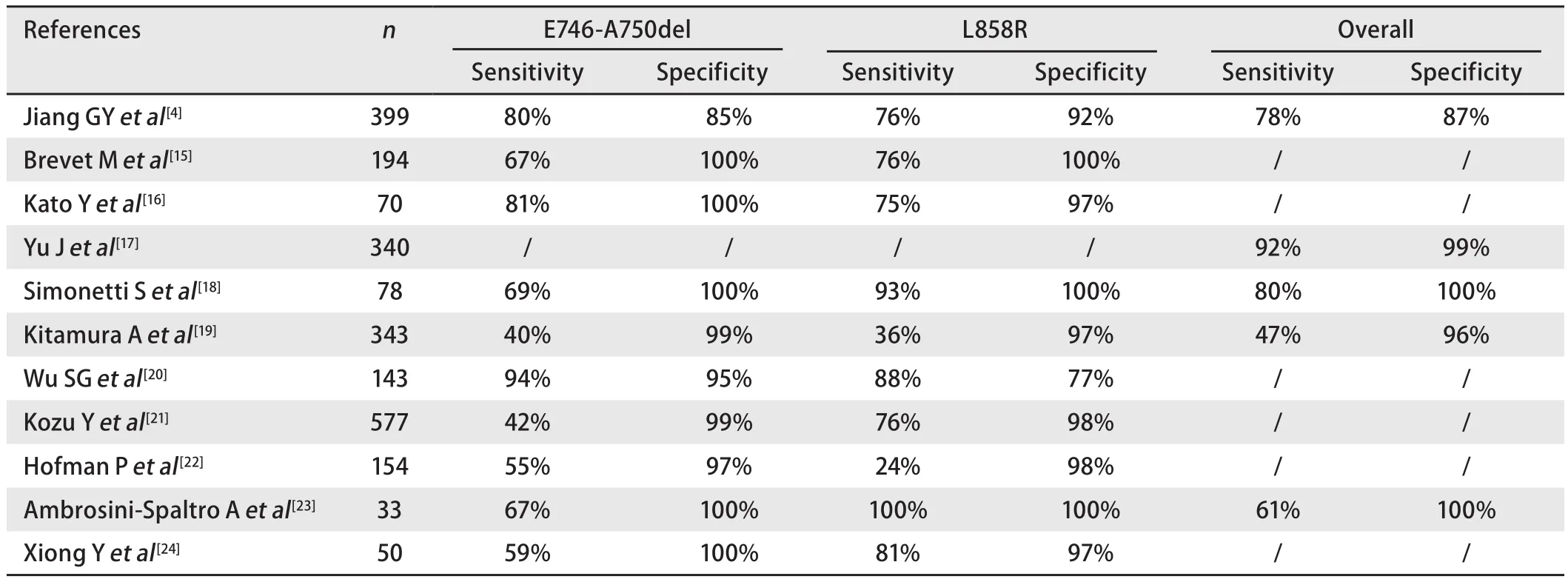
表 1 免疫組化法檢測EGFR突變靈敏度及特異度的文獻回顧("/"表示相關數據缺少)Tab 1 Sensitivity and specificity of immunohistochemical detections of EGFR mutations in eleven studies ("/ " indicates that data are not available)
2013年,熊等[23]針對特異性抗體檢測EGFR突變的免疫組化染色,以DNA直接測序法為金標準,比較了三種評判標準各自的可靠程度.A法[26]以>10%的腫瘤細胞胞膜和/或胞漿中到強度染色為陽性;B法[19]以>10%的腫瘤細胞胞膜任意強度染色為陽性;C法[21]以>50%的腫瘤細胞胞膜和/或胞漿任意強度染色染色為陽性.結果示A法最為理想,應用此法可檢測出E746_A750缺失突變和L858R點突變的特異度分別為100%和97%,靈敏度分別為59%和81%.從可靠程度來講,對于L858R突變的檢測,A法較B、C法有統計學差異;但對E746_A750缺失突變的檢測,A法較B、C法無統計學差異[23].總結A、B、C法,我們可以推出強調腫瘤細胞胞膜和/或胞漿染色的方法(A法)優于僅強調腫瘤細胞胞膜染色的方法(B法),同時也優于僅考慮染色區域而忽略染色強度的方法(C法).除此之外,還有將染色強度與陽性細胞百分比相乘的方法,以結果大于某一界定數值為陽性,小于該數值為陰性,如Colorado大學的免疫組化H評分法[16]和Kozu等[21]所使用的方法.
縱觀上述文獻,考慮免疫組化法檢測EGFR特異性突變的特異度高,則誤診率較低;但靈敏度浮動范圍較大,最低僅有24%,則提示其假陰性率較高,會有較多實際為EGFR突變的病例漏診,此時則需借助其他靈敏度較高的分子水平手段進一步檢測已明確是否存在EGFR突變.2013年,蔣等[4]針對免疫組化法檢測EGFR特異性突變結果的特點,制定了一套EGFR突變篩查流程圖.其收集了399例NSCLC患者的標本(包括145例手術標本,220例活檢小標本和34例細胞學標本),應用特異性抗體對上述標本進行免疫組化染色(對于活檢小標本或細胞學標本,僅當腫瘤細胞數超過5個時才評價其免疫組化染色結果),并將染色結果分為0-3+四個等級,標準為:0:無染色;1+:腫瘤細胞淺黃染不伴明顯顆粒或不超過10%的腫瘤細胞黃染伴明顯顆粒;2+:超過10%的腫瘤細胞黃染伴明顯顆粒或不超過10%的腫瘤細胞棕染伴明顯顆粒;3+:超過10%的腫瘤細胞棕染伴明顯顆粒.另外應用TaqMan PCR法(較DNA直接測序靈敏度更高)作為金標準,檢測每份標本各自EGFR突變情況.當以0和1+為陰性,2+和3+為陽性時,免疫組化法和TaqMan PCR法結果的一致度是最高的(κ=0.644),然而在1+的評分里仍會有24例(24/104, 23.08%)為假陰性病例,在2+的評分里仍有33例(33/103, 32.04%)為假陽性病例,致免疫組化法的靈敏度為77.63%,特異度為86.64%,因此簡單用此結果指導臨床是不理想的.但在免疫組化染色評分為3+的標本中,特異度和陽性預測值均可達100%;免疫組化染色為評分為0的標本中,陰性預測值可達93.06%,加做總EGFR抗體(D38B1,非突變特異性抗體,可檢測出所有EGFR蛋白表達無論其突變與否)檢測,陰性預測值可高達97.22%.蔣等[4]根據上述結果的特點,制定的EGFR突變篩查流程為:若IHC染色結果評分為3+,可不行其他分子水平的檢測,直接接受EGFR-TKI治療;若評分為0,加做總EGFR抗體的免疫組化染色,篩查出的結果可達97%的陰性預測;當評分為1+或2+時,由于結果不可靠,需進一步接受分子水平的檢測手段以明確是否存在EGFR突變.相比Yu等[17]對2+(中度染色)及3+(強染)級別僅設定籠統強度指標的方法,蔣等[4]對這兩個級別進行了更為具體的百分比劃分,因此考慮后者在指導病理醫師對染色結果評分方面更為客觀、嚴謹.另外蔣等[4]對不同類型的標本進行分析,推斷免疫組化法用于手術切除標本優于活檢小標本,活檢小標本優于體液來源的細胞學標本.
目前大多數實驗研究認為基于腫瘤細胞胞膜和/或胞漿的染色強度與染色區域的百分比設定的評分標準,并按程度分為0-3+四個等級,是所有評分系統中最佳的方法[4,15,17,22,24].盡管不同研究者實驗所得免疫組化法檢測突變靈敏度的結果波動范圍較大且大多不甚理想,但這并不能成為限制其臨床應用的障礙,根據蔣等[4]提出的流程圖,當免疫組化法不能明確是否存在EGFR突變時,應進一步行靈敏度更高的分子水平檢測手段驗證.設置嚴格的免疫組化陽性標準可減少假陽性率,以避免患者因誤診予以TKI藥物治療而帶來的損失.
3 加做EGFR單克隆抗體(D38B1)檢測對免疫組化結果的影響
與突變特異性抗體不同的是,EGFR單克隆抗體(D38B1)可識別所有EGFR蛋白表達無論是否存在EGFR基因突變[4].應用D38B1抗體檢測出總EGFR表達為陰性的腫瘤標本,也不應被檢測出特異性EGFR突變[19].反之,特異性突變蛋白的表達水平受總EGFR表達水平影響,若腫瘤細胞內總EGFR表達水平很低,即便該樣本的腫瘤細胞的確存在特異性EGFR基因突變,應用該特異性抗體行免疫組化染色的結果也可能為陰性,因此應用EGFR單克隆抗體(D38B1)檢測總EGFR表達水平可減少特異性突變假陰性結果的產生,提高檢測的靈敏度[4,19,20].2011年Wu等[20]首次提出,加做總EGFR抗體(D38B1)檢測并將其納入對免疫組化結果的解釋中可增加EGFR突變檢測的可靠性,尤其對于21外顯子的L858R點突變.其結論為,根據邏輯回歸分析模型得出的最佳曲線下面積(area under the curve,AUC),對于L858R的檢測,綜合L858R的Q評分(Q=強度X百分比)與總EGFR表達的Q評分得出的結果最佳,且與僅以L858R染色強度為評分標準的方法相比具有統計學差異(0.891 vs 0.853, P=0.036).對于E746_A750缺失的檢測,曲線下面積最優的方法為綜合E746_A750缺失表達Q評分與總EGFR表達染色強度,但與僅以E746_A750表達強度為評分標準的方法相比,不具有統計學差異(0.969 vs 0.958, P=0.087)[20].另外,Wu等[20]將免疫組化結果與患者臨床服用靶向藥物療效相結合發現,上述免疫組化法陽性組的患者對EGFR-TKI治療的反應及無進展生存期(progression free survival, PFS)均強于陰性組的患者.后來,蔣等[4]也發現,加做總EGFR抗體的免疫組化染色可以將E746_A750缺失突變和L858R點突變檢出的靈敏度分別提高到82.56%和90%[4].
4 其他
影響免疫組化結果可靠程度的因素有很多,然而其最終的可靠性取決于整個過程的質量控制,包括抗體的公司來源、免疫組化方法的選擇、評分系統的選擇、對結果的解釋及是否能與分子水平檢測方法的恰當結合等等[2,24].
5 小結
對于最常見的兩種EGFR突變類型的檢測,應用特異性抗體的免疫組化法具有快速、簡便、經濟、易于在眾多病理實驗室開展、可以保留形態學資料等特點,這些是其較目前新興的分子水平檢測手段最為明顯的優勢.另外,與經典的DNA直接測序相比,其更適于DNA含量較少的小標本檢測,如在Kitamura[19]的實驗中就曾發現一例EGFR基因檢測為野生型,但免疫組化法結果陽性且對酪氨酸激酶抑制劑治療反應良好的病例.因此不排除在那些與DNA直接測序法相比,免疫組化結果為"假陽性"的病例中,實際對酪氨酸激酶抑制劑治療反應良好的病例,此時需借助靈敏度更高的分子水平檢測進一步驗證.合理應用特異性抗體的免疫組化法篩查EGFR突變具有實際臨床意義,但要嚴格保證整個過程的質量控制,選擇合理的試劑、制定恰當的結果評判標準、檢測總EGFR表達水平等等.未來仍需大宗臨床資料驗證免疫組化法診斷陽性的患者,其靶向藥物治療反應.

