重組人粒細胞集落刺激因子動員骨髓干細胞對大鼠腦梗死血管新生的影響
王 宇 王 燕 王 波 史小琴 張明艷 張建麗 許文杰
(河北大學基礎醫學院,河北 保定 071002)
腦梗死是嚴重威脅人類健康的疾病之一,其致殘和致死率均較高〔1〕。目前治療手段無法修復或逆轉壞死的腦組織,更不能促進血管和神經再生,且因適應證和并發癥的限制,溶栓治療并未取得良好療效。缺血性梗死雖然誘導內源性干細胞增殖,但產生的自身修復作用有限。本課題組利用細胞因子(趨化因子)使骨髓干細胞進入外周血,并在特定的組織微環境下分化為受損細胞的特性〔2〕,達到修復缺血損傷的作用。本研究利用重組人粒細胞集落刺激因子(rhG-CSF)動員骨髓干細胞治療大鼠腦梗死模型,探討骨髓干細胞能否在腦梗死的特定環境中發揮保護作用并促進血管新生,為治療腦梗死尋找更有效的治療方法提供依據。
1 材料和方法
1.1實驗動物與分組 健康雄性SD大鼠(清潔級)共150只,體重300~400 g。在SPF恒溫恒濕條件下飼養,并隨機分為模型動員組、模型組、假手術組,每組50只。在大腦中動脈閉塞模型建立后,于24、48、72 h、1 w和1個月五個不同時間點對各組的10只(n=10)大鼠分別處死。在處死前對不同時點的各組10只大鼠進行神經功能Longa評分〔3〕。
1.2主要藥物與試劑 rhG-CSF:武漢博士德生物工程有限公司;抗大鼠CD34、VEGF和Flk-1單抗:北京中杉科技有限公司;抗大鼠Ⅷ單抗:北京博奧森生物技術有限公司。
1.3大腦中動脈閉塞模型的建立 在無菌條件下,用10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉SD大鼠。取仰臥位固定和消毒術野,頸正中線切口并分離左側頸總動脈(CCA)、頸外動脈(ECA)和頸內動脈(ICA),在CCA遠心和近心端及ECA掛線備用;用微動脈夾夾閉ICA,近心端結扎CCA、ECA;在距CCA分叉處3~5 mm剪一小口,將拴線插入到CCA,這時用繞在CCA遠心端的細線輕輕系牢拴線。用眼科鑷輕推拴線,從血管分叉處開始算距離,當插入深度在18 mm時,送線至剛有阻力感時停止進線,緊緊系牢CCA遠心端的細線,扎緊切口處之活結備線,外留1 cm長線頭,縫合皮膚。Longa評分:再灌注2 h后,按照5分法分級(0分:無神經缺損癥狀;1分:對側前肢不能完全伸直;2分:向對側旋轉;3分:向對側傾倒;4分:不能自己行走或昏迷)。1~4分為大鼠模型成功建立的標志。
1.4檢測指標 腹腔注入過量麻醉劑致死后,碘酒和酒精消毒,快速斷頭并將頭皮充分分離;然后從近頸部開始分離頭骨,咬骨鉗迅速掀去顱骨,眼科剪分離神經,最后將大腦完整分離。腦梗死面積:腦組織冷凍后選取肉眼下梗死明顯部分制成蘇木素-伊紅(HE)染色組織病理切片,每只大鼠制作3張,光學顯微鏡下記錄最大梗死灶長度及寬度,長度×寬度即為梗死灶面積。微血管密度:以Ⅷ因子陽性表達為微血管所在區域,主要發生在梗死灶周圍。免疫組化結果均使用image pro-plus軟件進行分析。

2 結 果
2.1神經功能分級 骨髓干細胞動員后24 h,模型組與模型動員組Longa評分未見明顯差異(P>0.05),但均優于假手術組;在48 h、72 h、1 w和1個月后,模型動員組明顯優于模型組(P<0.05),而假手術組未見明顯神經功能改善;且模型動員組改善情況更為明顯(P<0.05)。見表1。
2.2腦梗死面積測定 假手術組未見梗死區,模型組和模型動員組梗死面積均大于假手術組(P<0.05);而模型動員組梗死面積不同時間點均小于模型組(P<0.05);且發現兩組在不同時間梗死面積變化趨勢各異,模型組呈緩慢增加,而模型動員組逐漸減少,且在72 h和1 w時間點梗死面積與前一時間點比較有統計學意義(P<0.05)。見表2。
2.3微血管密度 兩組微血管密度均大于假手術組(P<0.05);模型動員組在各時間點均表達大于模型組(P<0.05);且在模型動員組中發現,48 h比24 h時間點的Ⅷ因子表達明顯增加(P<0.05)。見表3。

表1 各組不同時間點Longa評分比較
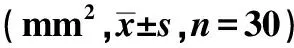
表2 各組不同時間點腦梗死面積比較

表3 各組不同時間點Ⅷ因子表達情況比較
3 討 論
雖然機體在腦缺血應激狀態下可促進生成微血管,本實驗也證實了這點,但遠不能達到治療和改善病情的目的,且目前治療方式局限,不能得到很好的治療效果。血管內皮系統是血管新生的根本途徑,而血管生成因子參與的信號傳導起決定性作用〔4〕。
粒細胞集落刺激因子(G-CSF)是調節骨髓粒系造血的重要細胞因子。體外實驗發現G-CSF可誘導中性粒細胞分泌血管生成因子〔5〕。大鼠經G-CSF治療后內皮細胞增殖和梗死區血管密度均顯著高于對照組,且其具有同時動員造血干細胞和間充質干細胞的能力,所以G-CSF動員骨髓造血干細胞的同時也動員了內皮前體細胞〔6〕。實驗證明,G-CSF在體內、體外均可促進內皮前體細胞的生長、增殖和遷移,從而增加缺血區域組織的血管新生〔7〕。因此,應用骨髓干細胞動員治療腦梗死成為可能。本研究發現,使用了rhG-CSF的模型動員組無論在血管新生、微血管密度、梗死面積,還是神經功能等方面均有明顯改善,但隨治療時間推移,血管新生不能看到明顯的變化,這可能與機體對藥物抵抗等有關,但具體機制有待進一步研究。陳運賢等〔8〕用G-CSF動員自體骨髓干細胞治療大鼠急性腦梗死的實驗發現,G-CSF治療梗死體積明顯小于對照組,病理損傷也輕于對照組,提示G-CSF動員可能對缺血性腦梗死有保護作用,術后48 h在腦梗死灶中只發現CD34陽性的單個核浸潤,這一結果也與本研究一致。腦梗死的干細胞動員,其具體治療效果還需大量實驗和臨床研究來證實。
4 參考文獻
1Kalaria RN. Cerebrovascular disease and mechanisms of cognitive impairment: evidence from clinicopathological studies in humans〔J〕. Stroke,2012;43(9): 2526-34.
2靳鳳艷,邱錄貴,李橋川,等. 基質細胞衍生因子-1及其受體在G-CSF誘導的造血干/祖細胞動員中的作用〔J〕. 中華血液學雜志,2007;28(2):98-102.
3賽音巴雅爾,林貴軍,饒芝國. 外源性血管內皮生長因子對大鼠腦血腫周圍血管新生及神經功能恢復的影響〔J〕. 中華神經外科雜志,2012;28(5):522-5.
4Emanueli C,Madedu P. Angiogenesis gene therapy to rescue ischaemic tissues: achievements and future directions〔J〕. Br J Pharmacol,2001;133(7): 951-8.
5Ohki Y,Heisssig B,Sato Y. Granulocyte colony-stimulating factor promotes neovascularization by releasing vascular endothelial growth factor from neutrophils〔J〕. FASEB J,2005;19(14): 2005-7.
6Lee ST,Chu K,Jung KH,etal. Cranulocyte colony-stimulating factor enhances angiogenesis after focal cerebral ischemia〔J〕. Brain Res,2005;1058(1-2): 120-8.
7劉宏偉,蓋魯粵,張端珍,等. 骨髓干細胞動員與移植治療心肌梗死的比較〔J〕. 中國病理生理雜志,2006;22(4):674-7.
8陳運賢,陸 英,鐘雪云,等. 粒細胞集落刺激因子動員骨髓干細胞治療大鼠缺血性腦梗死〔J〕. 中國病理生理雜志,2004;20(4):560-5.

