HDPR1對結直腸癌細胞遷徙和侵襲能力的影響
周忠笑 魏晰麟 姚建茹 張 健 邊 剛 李金暉
(沈陽醫學院奉天醫院普外三科,遼寧 沈陽 110024)
結直腸癌是世界上高發惡性腫瘤之一,多半起源于腺瘤,但是其發生的分子機制尚不十分清楚〔1〕。HDPR1基因以及其同系物參與胚胎生長和發育的調控〔2,3〕。然而關于HDPR1在人類疾病中所發揮的作用知之甚少。生物信息學分析顯示HDPR1mRNA的表達存在于羊膜、胎兒腦、眼睛、心臟、成人腦脊髓、胃印戒細胞癌、RER陽性結腸癌、急性淋巴細胞白血病、軟骨肉瘤等〔4〕。目前認為HDPR1基因是一個潛在的腫瘤相關基因〔5〕。然而,HDPR1在結直腸癌中的表達模式和功能機制尚未闡明清楚。本研究通過檢測HDPR1在結直腸癌中的表達情況,以及探討HDPR1的表達對結直腸癌細胞系的遷徙和侵襲的調控作用。
1 材料與方法
1.1細胞株與細胞培養 人結直腸腺癌瘤株HCT-116為本實驗室保存。用含有10% 胎牛血清、100 U/ml青霉素和100 μg/ml鏈霉素的McCoy's 5A培養液(購自SIGMA),在37℃ 含5%CO2的飽和濕度培養箱內傳代培養。
1.2siRNA轉染 使用HDPRl siRNA(Santa Cruz,USA)和陰性對照contol siRNA(Santa Cruz,USA)用特異性siRNA轉染試劑(Santa Cruz,USA) 按說明書推薦比例轉染至相應細胞,48 h后進行后續實時PCR檢測。
1.3實時PCR 應用Trizol (QIAGEN,德國)從組織或者細胞系里抽提總RNA。使用AMV反轉錄酶和隨機引物(Takara)將總RNA合成cDNA。HDPR1進行實時PCR的上游引物:5'-AAAGGGCTTCTGAGGAACGG-3'和下游: 5'- TCAGAGAAGGTATCCCGCCA-3' 為 (124 bp,1155-1278,NM_001079520.1),以及GAPDH的實時PCR上游引物:5'-GTCAAGGCTGAGAACGGGAA-3'和下游:5'-AAATGAGCCCCAGCCTTCTC-3'為(158 bp,376-533,NM_001256799.1)。實時PCR過程按照SYBR Premix Ex TaqTM Ⅱ 試劑盒(Takara)的說明書進行。
1.4Western蛋白印跡雜交 利用RIPA裂解液提取蛋白。用BCA試劑盒(Pierce)蛋白定量后取100 μg蛋白樣品經10%的SDS-PAGE電泳后,將蛋白轉移到Hybond膜(Amersham,德國)上,用5%脫脂奶粉(含0.1%Tween20的TBS即TBST配制)室溫封閉2 h。一抗HDPR1抗體(sigma,美國;1∶1 000)孵育4℃過夜,TBST洗3次,加入辣根過氧化物酶標記到羊抗兔-IgG(DAKO;1∶1000)于室溫孵育2 h。通過Amersham ECL-Plus(德國)反應后X光片曝光。
1.5細胞遷移能力的檢測 轉染后48 h,取各組細胞,用胰酶消化后,用無血清的McCoy's 5A培養基調整細胞濃度為5×105個/ml,取0.4 ml細胞懸液接種于Transwell小室(購自BD Bioscience)上層,下層加入含20%胎牛血清的培養基,于37℃,5%CO2條件下培養24 h 后,取出小室隔膜,用棉簽擦掉上面未穿過膜的細胞,風干后用100%甲醇固定,吉姆薩染料染色, 在倒置顯微鏡下觀察拍照、計數。隨機取10個視野,計數遷移細胞數并計算均值,試驗重復至少3次。
1.6細胞侵襲能力的檢測 將基質膠matrigel(購自BD Bioscience) 按1∶8 的比例用無血清McCoy's 5A稀釋后,取35 μl包被小室的上室,紫外燈照射過夜,其余步驟同遷徙實驗。
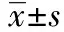
2 結 果
2.1HDPR1在人的直結腸癌中過表達 HDPR1 mRNA的水平(1.54±0.33)與相應的癌旁黏膜(1.0)比較在直結腸癌樣本中明顯升高(P<0.05)。應用Western印跡進一步證實高水平的HDPR1蛋白表達出現在直結腸癌中(P<0.05)。見圖1。

N:癌旁正常黏膜組織;C:直結腸癌組織
2.2HDPR1 siRNA沉默內源性HDPR1表達 通過在HCT116轉染HDPR1 siRNA,沉默內源性HDPR1表達。實時PCR結果顯示48 h后HDPR1 siRNA轉染組,HDPR1 mRNA水平較陰性對照明顯降低〔(0.232±0.079) vs (1.035±0.088),P<0.05〕,以空白對照為1。
2.3DHPR1 siRNA對HCT116細胞遷移、侵襲能力的影響 轉染48 h后,HDPR1 siRNA轉染組細胞的穿膜細胞數(15.765±2.0)明顯低于陰性對照組(49.5±4.0)和HCT116(空白對照)組(50.099±5.8)(P<0.05),陰性對照組與空白對照組之間差異無統計學意義(P>0.05)。轉染48 h后,HCT116(空白對照)細胞數為23.76; Mock(陰性對照)細胞數為22.098 7; HDPR1 siRNA轉染組細胞數為5.876 5;可見HDPR1 siRNA轉染組細胞的穿膜細胞數(5.88±1.0)明顯低于陰性對照組(22.09±2.68)和空白對照組(23.16±3.89)(P<0.05),陰性對照組與空白對照組之間差異無統計學意義(P>0.05)。
3 討 論
HDPR1是Dapper家族的成員,是Wnt通路重要的調控因子〔8〕。HDPR1在結直腸癌中也可能起到重要的作用。HDPR1在侵襲的乳腺癌中上調〔9〕,以及HDPR1在食管癌中高表達并且與臨床病理因素相關,免疫組化顯示胞漿中高表達的HDPR1與局部的淋巴結轉移程度成正相關。這些研究與我們的研究結果HDPR1在人的直結腸癌中高表達一致。然而,也有文獻報道〔5~7〕HDPR1在肝細胞癌和肺癌中表達下調,與本研究趨勢相反。本研究進一步發現HDPR1的高表達可以增強HCT116的遷徙和侵襲能力。與在肺癌細胞中HDPRl的表達下調可通過下調p120ctn蛋白分子的穩定性和(或)間接上調β-catenin的表達,從而促進肺癌細胞侵襲能力的結論也相反〔7〕。以上研究均提示HDPR1發揮作用可能依賴于細胞所處的環境。
綜上,HDPR1在結直腸癌中高表達,并且可以促進結直腸癌細胞系HCT116的遷徙和侵襲。HDPR1促進結直腸癌細胞侵襲轉移的分子機制還有待于更多實驗進行探索,但隨著該研究的深入,將有利于揭示結直腸癌的侵襲轉移的機制,為抗腫瘤藥物的研發提供了一定的理論基礎和實驗依據,并尋找可能的防治靶點,從而進行相關的基因治療。
4 參考文獻
1Jemal A,Siegel R,Ward E,etal. Cancer statistics,2008〔J〕. CA Cancer J Clin,2008;58(2):71-96.
2Cheyette BN,Waxman JS,Miller JR,etal. Dapper,a Dishevelled-associated antagonist of beta-catenin and JNK signaling,is required for notochord formation〔J〕. Dev Cell,2002;2(4):449-61.
3Gillhouse M,Wagner Nyholm M,Hikasa H,etal. Two Frodo/Dapper homologs are expressed in the developing brain and mesoderm of zebrafish〔J〕. Dev Dyn,2004;230(3):403-9.
4Katoh M.Identification and characterization of rat Dact1 and Dact2 genes in silico〔J〕. Int J Mol Med,2005;15(6):1045-9.
5Yau TO,Chan CY,Chan KL,etal. HDPR1,a novel inhibitor of the WNT/beta-catenin signaling,is frequently downregulated in hepatocellular carcinoma: involvement of methylation-mediated gene silencing〔J〕. Oncogene,2005;24(9):1607-14.
6Hou J,Li EM,Shen JH,etal. Cytoplasmic HDPR1 is involved in regional lymph node metastasis and tumor development via beta-catenin accumulation in esophageal squamous cell carcinoma〔J〕. J Histochem Cytochem,2011;59(7):711-8.
7Yang ZQ,Zhao Y,Liu Y,etal. Downregulation of HDPR1 is associated with poor prognosis and affects expression levels of p120-catenin and beta-catenin in nonsmall cell lung cancer〔J〕. Mol Carcinog,2010;49(5):508-19.
8Gao X,Wen J,Zhang L,etal. Dapper1 is a nucleocytoplasmic shuttling protein that negatively modulates Wnt signaling in the nucleus〔J〕. J Biol Chem. 2008;283(51):35679-88.
9Schuetz CS,Bonin M,Clare SE,etal. Progression-specific genes identified by expression profiling of matched ductal carcinomas in situ and invasive breast tumors,combining laser capture microdissection and oligonucleotide microarray analysis〔J〕. Cancer Res,2006;66(10):5278-6.

