原發性非小細胞肺癌患者外周血中Th17的檢測及其臨床意義
司立博 田 輝 亓 磊 岳韋名 李 林 李樹海 高 存 田 煜
(山東大學齊魯醫院胸外科,山東 濟南 250012)
Th17細胞(Th17)是不同于Th1、Th2細胞的CD4+輔助性T細胞(Th)的新亞群,其在免疫系統中發揮重要作用〔1〕,并通過分泌白細胞介素(IL)-17A/F、IL-6、腫瘤壞死因子(TNF)-α等炎癥相關細胞因子參與多個重要生理病理進程。近年來Th17細胞在腫瘤發生中的作用引起了廣泛的關注。孤獨核受體γt (RORγt)是Th17細胞分化調控的關鍵轉錄因子,在Th17細胞的分化發育及調控IL-17分泌的過程中起著重要作用〔2~7〕。Th17細胞的主要效應因子是IL-17,已有研究表明在多種腫瘤中如胃癌、食管癌、結腸癌、卵巢癌中均可檢測到Th17細胞、轉錄因子RORγt及IL-17的高表達〔8~10〕。在非小細胞肺癌(NSCLC)動物腫瘤模型中發現IL-17可促進腫瘤新生血管的發生,利于腫瘤生長、浸潤和轉移〔11〕。在本課題中,通過檢測NSCLC患者與健康對照組外周血Th17細胞及其轉錄因子RORγt和細胞因子IL-17的水平,從細胞和分子水平探討Th17細胞在NSCLC發生發展中的意義。
1 材料與方法
1.1臨床資料及標本 選取2010年10月至2011年10月在山東大學齊魯醫院胸外科行肺癌切除加系統性淋巴結清掃術的NSCLC患者的術前外周血。所有病例均經病理學確診,NSCLC診斷標準參照世界衛生組織(WHO)2004年的肺腫瘤組織學分類標準,其中鱗癌23例,腺癌28例;術后病理分期參照國際肺癌研究協會(IASLC)2009年的TNM分期標準,其中Ⅰ~Ⅱ期31例,Ⅲ期20例。共有51例患者納入本研究,其中男36例、女15例,年齡31~81(60±9.34)歲,所有患者均無免疫性疾病及其他腫瘤病史,術前均未行抗腫瘤治療和免疫治療。健康對照組26例,全部為健康志愿者,其中男14例、女12例,年齡25~65(51±7.82)歲。術前取外周血5 ml,肝素鈉抗凝。所有受試者均簽署知情同意書,并報倫理委員會批準。
1.2主要試劑 FITC標記的小鼠抗人CD4抗體和PE標記的小鼠抗人IL-17抗體均購自eBioscience公司。Trizol試劑:購自Invitrogen公司。IL-17的ELISA試劑盒:購自上海遠達晶美生物技術有限公司。逆轉錄試劑盒、RT-PCR 試劑盒購自日本TaKaRa公司。
1.3外周血單個核細胞(PBMCs)的分離與培養及血漿的分離 取實驗組和健康對照組肝素抗凝外周靜脈血5 ml于無菌試管中,用等量PBS稀釋后,緩慢加入含淋巴細胞分離液的50 ml離心管中(淋巴細胞分離液:血液為1∶2),2 500 r/min離心20 min,吸取中間層單個核細胞,用3 ml PBS洗滌2遍后即為PBMCs。
1.4流式細胞術檢測外周血中Th17細胞占CD4+T淋巴細胞的比例 于PBMCs細胞懸液中加入10 μl FITC標記的小鼠抗人CD4抗體,置4℃避光孵育30 min。用PBS洗滌后,再加入100 μl固定劑振蕩混勻,于室溫孵育15 min。加入100 μl破膜劑和10 μl PE標記的抗IL-17抗體,室溫孵育30 min;以PBS重懸細胞后,用流式細胞儀檢測。檢測結果采用CellQuest軟件進行分析。Th17細胞的水平以CD4+IL-17+細胞在CD4+T細胞中的百分率表示。
1.5RT-PCR檢測PBMC中IL-17及RORγt mRNA的表達 采用Trizol試劑,酚-氯仿法提PBMCs的總RNA,反轉錄過程按照試劑盒說明書操作獲得cDNA。PCR引物(β-actin為內參基因)由Primer5.0軟件設計并由濟南博尚公司合成(序列見表1)。實時定量PCR以SYBR Green為熒光染料,使用ABI 7500 PCR系統。目的基因的表達量通過2△Ct與內參基因對比(△Ct=Ct目的基因/Ct內參基因)。PCR程序設置如下 :95℃ 10 min解鏈,95℃ 15 s 62 ℃ 1 min,共計40個循環。
1.6ELISA法檢測外周血漿中IL-17的含量 采用雙抗體夾心ELISA法測定。具體操作按照IL-17的ELISA檢測試劑盒提供的說明書進行,每個樣本和標準品均設3個復孔。

表1 IL-17、RORγt及β-actin引物序列及產物長度
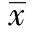
2 結 果
2.1NSCLC患者外周血中Th17細胞占CD4+T淋巴細胞的比例升高 NSCLC患者外周血Th17細胞占CD4+T淋巴細胞的比例為(2.78±0.59)%,顯著高于健康對照組外周血Th17細胞所占比例(0.59±0.15)%(P<0.01)。
2.2RT-PCR檢測PBMC中IL-17及RORγt mRNA的表達水平 與管家基因β-actin相比,IL-17的相對表達量在NSCLC患者為1.767±0.32;轉錄因子RORγt的相對表達量在NSCLC患者為2.312±0.28,與健康對照組(1.000)相比差異顯著(P<0.01)。
2.3外周血漿中IL-17含量的測定 NSCLC患者血漿中IL-17的含量為(2.14±0.23) μg/L,而健康對照組為(1.13±0.22) μg/L, 兩組比較差異顯著(P<0.001)。因此,NSCLC患者外周血血漿中Th17細胞分泌的IL-17明顯高于健康對照組。
2.4不同病理分型及TNM分期NSCLC患者之間的比較 鱗癌患者、腺癌患者外周血中Th17細胞比例、IL-17 mRNA表達水平及外周血漿中IL-17的表達水平比較,均無統計學差異(P>0.05);Ⅲ期患者外周血中Th17細胞比例、IL-17 mRNA表達水平及外周血漿中IL-17的表達水平較Ⅰ~Ⅱ期患者顯著增高,見表2。
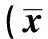
表2 不同臨床病理特征患者Th17及相關因子變化±s)
3 討 論
人體抗腫瘤機制主要是細胞免疫,同樣肺癌的發生、發展與免疫功能狀態也密切相關。T淋巴細胞是細胞免疫的效應細胞,在調節免疫應答中起著重要作用,CD4+T細胞作為T細胞的重要成分,參與機體免疫應答的各個階段,并且在免疫調節中發揮至關重要的作用。Th17 細胞作為CD4+T細胞的新亞群,在先天性免疫和獲得性免疫中均發揮重要功能,并通過分泌IL-17A/F等細胞因子參與腫瘤發病的多個重要生理或病理進程。
在多種腫瘤如胃癌〔8〕、結腸癌〔9〕、肝細胞癌〔10〕及食管癌〔11〕中均可檢測到Th17 細胞及其特異性轉錄因子RORγt及主要效應因子IL-17的高表達,提示Th17細胞可能促進了腫瘤的發生發展及轉移。Numasaki等[12]研究NSCLC小鼠模型發現IL-17可促進血管內皮細胞的遷移及內皮細胞索的形成,并可促進腫瘤細胞或腫瘤內間質細胞分泌多種促血管生成的細胞因子,如VEGF、TGF-β、PGE2、MIP-2、趨化因子等,從而促進腫瘤新生血管的發生,利于腫瘤生長、轉移和浸潤。
本文結果表明NSCLC細胞存在Th17細胞高表達現象。NSCLC患者IL-17及RORγt mRNA的表達水平顯著高于健康對照組,表明CD4+T細胞向Th17細胞分化增多。NSCLC患者外周血中IL-17含量增多,表明NSCLC患者Th17細胞分泌細胞因子IL-17增多,并可能通過其參與NSCLC的發生。這些均說明NSCLC患者體內Th17及其相關因子高表達,抑制Th17的高表達有可能成為治療NSCLC的新靶點。
目前尚無直接證據證明IL-17與NSCLC的病理類型和臨床分期相關。但研究〔13〕發現,Th17 細胞與NSCLC的病理分期存在著一定的關系,隨后進一步分析IL-17 mRNA及外周血漿中IL-17在兩組間的表達水平差異,結果顯示,IL-17 mRNA的表達水平及IL-17的含量在Ⅲ期患者顯著增高。在細胞、基因、蛋白3個水平均反映了IL-17的表達隨著NSCLC的進展而表達上調,提示Th17 細胞參與了NSCLC的增殖、浸潤和遠處轉移。
綜上所述,本研究結果表明Th17細胞及其相關因子可能參與了NSCLC的發生、發展以及浸潤、轉移,我們可以嘗試通過對Th17細胞的干預調控,為臨床治療提供理論依據和新的途徑,從而有助于為腫瘤的免疫治療尋找新策略。
4 參考文獻
1Harrington LE,Hatton RD,Mangan PR,etal. Interleukin17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages〔J〕. Nat Immunol,2005;6(11):1123-32.
2Eberl G,Marmon S,Sunshine MJ,etal. An essential function for the nuclear receptor RORgamma(t) in the generation of fetal lymphoid tissue inducer cells〔J〕. Nat Immunol,2004;5(1):64-73.
3Egawa T,Eberl G,Taniuchi I,etal. Genetic evidence supporting selection of the Valpha14i NKT cell lineage from double-positive thymocyte precursors 〔J〕. Immunity,2005;22(6):705-16.
4Teng MW,Andrews DM,McLaughlin N,etal. IL-23 suppresses innate immune response independently of IL-17A during carcinogenesis and metastasis〔J〕. Proc Natl Acad Sci USA,2010;107(18):8328-33.
5Yang K,Vega JL,Hadzipasic M,etal. Deficiency of thrombospondin-1 reduces Th17 differentiation and attenuates experimental autoimmune encephalomyelitis 〔J〕. J Autoimmun,2009;32(2):94-103.
6Ziegler SF,Buckner JH. FOXP3 and the regulation of Treg/Th17 differentiation 〔J〕. Microbes Infect,2009;11(5):594-8.
7Jyoti Das,Ren G,Zhang LY,etal. Transforming growth factor β is dispensable for the molecular orchestration of Th17 cell differentiation 〔J〕. J Exp Med,2009;206(11):2407-16.
8Zhang B,Rong G,Wei H,etal.The prevalence of Th17 cells in patients with gastric cancer 〔J〕 . Biochem Biophys Res Commun,2008;374 (3):533-7.
9Legouvello S,Bastujl-Garn S,Aloulou N,etal. High prevalence of Foxp3 and IL-17 in MMR-proficient colorectal carcinomas 〔J〕.Gut,2008;57 (6):772-9.
10Zhang J P,Yan J,Xu J,etal. Increased intra tumoral IL-17 producing cells correlate with poor survival in hepatocellular carcinoma patients 〔J〕. J Hepatol,2009;50 (5):980-9.
11亓 磊,田 輝,岳韋名,等. 食管鱗癌患者外周血中Th17 細胞的檢測及其臨床意義〔J〕.中國腫瘤生物治療雜志,2011;18(1):59-62.
12Numasaki M,Watanab M,Suzuki T,etal. IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis 〔J〕. J Immunol,2005;175(9):6177-89.
13黃菁菁,葉娉婷,孫 力,等.宮頸癌患者外周血Thl 7細胞水平變化及意義〔J〕.山東醫藥,2012;52(11):65-7.

