雞胚胎干細(xì)胞多能性相關(guān)基因cNanog和cPouV干擾載體的構(gòu)建及篩選
彭特 王丙云 李東升 陳志勝 陳勝鋒 計慧琴 陳金頂
在哺乳動物和人中,Oct4、Nanog和Sox2被認(rèn)為是調(diào)控干細(xì)胞多能性及自我更新的3個重要的轉(zhuǎn)錄因子[1-3],但它們在家禽干細(xì)胞中的作用存在爭議。2001年Soodeen等[4]研究表明,雞體內(nèi)不存在Oct4,Lavial等[5]的研究發(fā)現(xiàn)雞胚胎干細(xì)胞表達(dá)Oct4同源基因雞PouV(cPouV),并且對其多能性的調(diào)控有重要作用。本實驗室的前期研究顯示,在雞早期胚胎發(fā)育過程中,多能性相關(guān)基因cNanog、cPouV和Sox2顯著表達(dá),但隨著胚胎發(fā)育3個基因的表達(dá)量呈明顯的下降趨勢,在雞胚胎干細(xì)胞分化的過程中,cNanog、cPouV和Sox2的表達(dá)水平也顯著下降,導(dǎo)致細(xì)胞多能性的喪失,提示這3個基因在維持雞胚胎干細(xì)胞多能性中發(fā)揮重要作用[6-8]。
RNA干擾(RNA interference,RNAi)是雙鏈RNA(dsRNA)介導(dǎo)的遺傳干擾現(xiàn)象,它能夠特異有效地降解mRNA,從而引起轉(zhuǎn)錄后水平的基因沉默,導(dǎo)致相應(yīng)功能基因表型缺失[9]。1998年首次在秀麗線蟲中發(fā)現(xiàn)RNA干擾現(xiàn)象,不久后在真菌、植物、果蠅、錐蟲、渦蟲、水螅、斑馬魚等真核生物中都發(fā)現(xiàn)了RNA干擾現(xiàn)象[10,11],RNA干擾技術(shù)具有高效、快速和成本低廉的優(yōu)勢,現(xiàn)已經(jīng)成為研究基因功能、新基因篩選、基因治療和尋找藥物靶點的重要工具[12,13]。
為進(jìn)一步闡明cNanog和cPouV基因在雞胚胎干細(xì)胞多能性維持和自我更新中的作用,本試驗分別針對雞多能性相關(guān)基因cNanog和cPouV設(shè)計3對siRNA干擾片段,合成shRNA插入到干擾載體中,構(gòu)建siRNA表達(dá)載體,并對其進(jìn)行篩選,以期獲得良好的干擾載體和轉(zhuǎn)染技術(shù),為獲得cNanog和cPouV基因穩(wěn)定干擾的CES細(xì)胞株,闡明cNanog和cPouV基因在雞胚胎干細(xì)胞多能性調(diào)控中的作用奠定基礎(chǔ)。
1 材料與方法
1.1 材料
新鮮受精雞蛋(麻黃雞)購于廣東省佛山市南海種禽有限公司;pCMV-N-Flag、pSuper-Retro-Puro和pEGFP-N1質(zhì)粒由廣州醫(yī)科大學(xué)蔡銘升博士惠贈;實驗所用的限制性內(nèi)切酶、DNA Marker、逆轉(zhuǎn)錄試劑盒和RNAiso Plus均為大連TaKaRa公司產(chǎn)品;T4DNA連接酶為NEB公司產(chǎn)品;KOD酶購自東洋紡公司;質(zhì)粒小量提取試劑盒和DNA凝膠回收試劑盒為上海生工公司產(chǎn)品;DYKDDDDK-Tag Mouse mAb和Actin Mouse mAb為Abmart公司產(chǎn)品;山羊抗小鼠IgG(H+L)和超敏ECL化學(xué)發(fā)光試劑盒購自碧云天研究所;PVDF膜購自Millipore公司;寡核苷酸和引物由Invitrogen公司合成;測序由上海生工公司完成。
1.2 方法
1.2.1 cNanog和cPouV基因 siRNA 表達(dá)載體的構(gòu)建 根據(jù)siRNA的設(shè)計原則,通過Ambion公司在線siRNA靶位點設(shè)計軟件(http://www.ambion.com/techlib/misc/siRNA_tools.html)針對 cNanog(NM_001146142)和 cPouV(NM_001110178)基因分別設(shè)計3條寡聚核苷酸序列(表1)。合成的寡聚核苷酸配制成100μmol/L的濃度,與互補(bǔ)的寡聚核苷酸片段混合后用退火緩沖液(100mol/L NaCl、pH7.450mmol/L HEPES)稀釋成終濃度3pmol/L。90℃4min,70℃ 10min孵育,緩慢冷卻至室溫。退火后形成的shRNA連接到經(jīng)Bgl II和Hind III酶切的pSuper-Retro-Puro質(zhì)粒中,連接產(chǎn)物轉(zhuǎn)化DH5α感受態(tài)細(xì)胞、挑取克隆搖菌后送測序公司測序。提取測序正確的干擾載體,保存用于后續(xù)試驗,分別命名pS1-cNanog、pS2-cNanog、pS3-cNanog和 pS1-cPouV、pS2-cPouV、pS3-cPouV。

表 1 合成的用于構(gòu)建干擾載體的寡核苷酸序列
1.2.2 cNanog和cPouV全基因表達(dá)載體的構(gòu)建 用Clone Manager軟件設(shè)計擴(kuò)增cNanog和cPouV基因的特異性引物,分別在擴(kuò)增cNanog基因的引物引入BamH I和EcoR I,cPouV基因引入EcoR I和Sa lI酶切位點(表2)。采用本實驗室改進(jìn)的方法取新鮮種雞蛋的胚盤[14],按照說明書采用Trizol法提取總RNA,并用AMV逆轉(zhuǎn)錄酶和Oligo(dT)18引物合成cDNA,以合成的cDNA為模板按照下列參數(shù)進(jìn)行PCR 擴(kuò)增 :94℃ 5min;94℃ 30s,退火 30s,72℃50s,循環(huán)35次;最后72℃ 10min。PCR 產(chǎn)物回收純化后用雙酶切,回收目的片段與經(jīng)同樣酶切及回收的pCMV-N-Flag載體連接,轉(zhuǎn)化后挑選陽性菌落進(jìn)行PCR與酶切鑒定以及測序驗證,將構(gòu)建正確的重組質(zhì)粒分別命名為pCMV-Flag-cNanog和pCMVFlag-cPouV。

表2 cNanog和cPouV基因的PCR引物序列
1.2.3 pSuper-shRNA、pCMV-Flag重組表達(dá)載體和pGFP質(zhì)粒共轉(zhuǎn)染293T細(xì)胞 采用磷酸鈣法轉(zhuǎn)染293T細(xì)胞,轉(zhuǎn)染前1d選擇對數(shù)生長期的293T細(xì)胞接種于6孔板,待細(xì)胞生長至80%匯合時取4μg pSuper-shRNA、4μg pCMV-Flag 重 組 質(zhì) 粒 和 0.5μL pGFP-N1質(zhì)粒加入到100μL CaCl2溶液中,混勻,將混合液緩慢滴加入100μL 2×HBS中,劇烈混合后加入6孔板中,繼續(xù)培養(yǎng)細(xì)胞。
1.2.4 Western blot法檢測重組載體的干擾效果 3個siRNA表達(dá)載體和全基因表達(dá)載體以及pGFP質(zhì)粒共轉(zhuǎn)染293T細(xì)胞24h后,觀察熒光以確定轉(zhuǎn)染效率,然后提取細(xì)胞蛋白進(jìn)行Western印跡,以未轉(zhuǎn)染siRNA表達(dá)載體組為陰性對照,β-actin作為內(nèi)源性對照。
293T細(xì)胞用預(yù)冷的PBS洗滌兩次,6孔板按100μL/孔加細(xì)胞裂解液,在冰上震蕩20min后重懸,12000g 4℃離心5min。經(jīng)SDS-PAGE分離后,電轉(zhuǎn)移至PVDF膜上。膜封閉后分別用抗Flag(1∶3000),抗 β-actin(1∶3000)抗體 4℃孵育過夜,與辣根過氧化物酶標(biāo)記的羊抗鼠二抗(1∶1000)室溫反應(yīng)1h,用化學(xué)發(fā)光法檢測目標(biāo)基因在干擾前后的表達(dá)變化。
2 結(jié)果
2.1 siRNA 表達(dá)載體的構(gòu)建
用pSuper-Retro-Puro質(zhì)粒為基礎(chǔ)質(zhì)粒進(jìn)行siRNA表達(dá)載體的構(gòu)建,載體含有氨芐抗性基因,表達(dá)載體連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞,涂布于LB氨芐青霉素抗性平板培養(yǎng)過夜,挑取單克隆培養(yǎng)并提取質(zhì)粒,重組質(zhì)粒測序驗證與預(yù)期相符,部分測序結(jié)果見圖1。

圖1 重組質(zhì)粒pS3-cPouV的測序比對圖
2.2 cNanog和cPouV全基因表達(dá)載體構(gòu)建與鑒定
經(jīng)PCR擴(kuò)增cNanog和cPouVcDNA編碼區(qū)全長,1%瓊脂糖凝膠電泳檢測,結(jié)果(圖2)顯示擴(kuò)增出長約946bp的cNanog和905bp的cPouV目的片段;將重組質(zhì)粒pCMV-Flag-cNanog和pCMV-Flag-cPouV分別用BamH I、EcoR I和EcoR I、Sal I進(jìn)行雙酶切后,電泳圖譜顯示分別切出與插入的預(yù)期目的大小相符的DNA 條帶(圖3)。進(jìn)一步的測序結(jié)果表明,插入片段的核苷酸序列與GenBank公布的cNanog和cPouV參考序列完全相同,表明重組質(zhì)粒構(gòu)建成功。
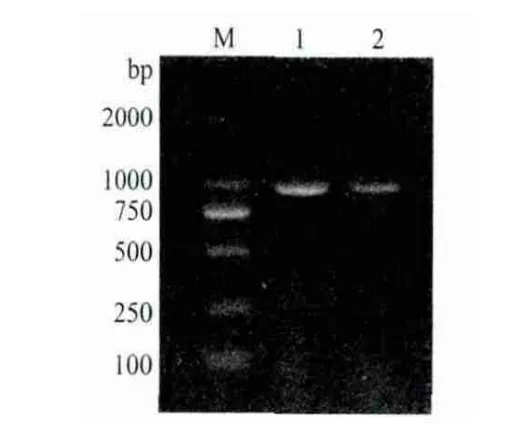
圖2 cNanog和cPouV目的片段PCR產(chǎn)物電泳圖譜
2.3 質(zhì)粒轉(zhuǎn)染293T細(xì)胞效率的估測
載體轉(zhuǎn)染24h后,熒光顯微鏡下檢測 pGFP轉(zhuǎn)染效果,可見約70%-80%的293T細(xì)胞發(fā)出綠色熒光(圖4),由于共轉(zhuǎn)染時加入的pGFP質(zhì)粒的濃度及體積一樣,從側(cè)面可反映出重組干擾載體的轉(zhuǎn)染效率情況。表明磷酸鈣介導(dǎo)的重組干擾載體轉(zhuǎn)染293T細(xì)胞效率較高且不同質(zhì)粒間無明顯差異。上述試驗獨立重復(fù)5次以上,結(jié)果均一致。
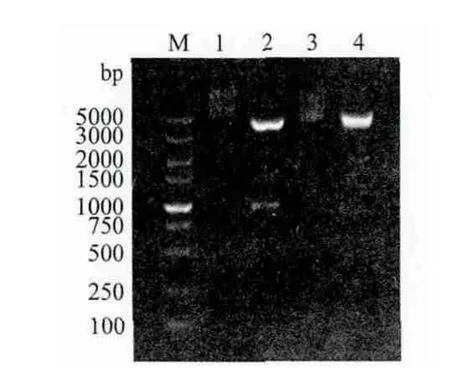
圖3 pCMV-Flag重組質(zhì)粒雙酶切產(chǎn)物電泳圖譜
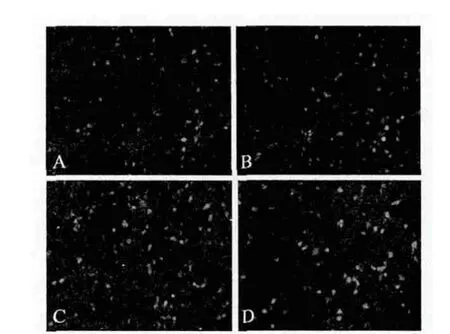
圖4 GFP與不同質(zhì)粒共轉(zhuǎn)染293T細(xì)胞表達(dá)情況(24h,100×)
2.4 cNanog和cPouV 干擾片段效率檢測
分別用cNanog和cPouV基因的3種pSupershRNA和pCMV-Flag重組表達(dá)載體共轉(zhuǎn)染293T細(xì)胞后,Western blot檢測結(jié)果(圖5)發(fā)現(xiàn),所構(gòu)建的重組干擾載體均有一定的抑制靶基因表達(dá)的作用。其中針對cNanog基因的干擾載體中pS3-cNanog的抑制效果最明顯,pS2-cNanog次之;pSuper-cPouV-shRNA中pS3-cPouV重組載體的效果最好,pS1-cPouV和pS3-cPouV也有一定的抑制作用。上述試驗獨立重復(fù)3次,結(jié)果均一致。
3 討論
雞胚胎干細(xì)胞在胚胎發(fā)育基礎(chǔ)、轉(zhuǎn)基因禽類的生產(chǎn)及家禽育種等方面具有巨大的應(yīng)用前景,但難以實現(xiàn)體外長期培養(yǎng)以及可傳代遺傳修飾,究其原因是對其全能性維持機(jī)制缺乏深入的了解。研究表明cNanog和cPouV在調(diào)控胚胎干細(xì)胞的自我更新和維持多能性上起重要作用,其在哺乳動物中的研究取得了較多的成果,但在家禽中研究報道很少。利用RNAi技術(shù)研究雞胚胎干細(xì)胞多能性相關(guān)基因的報道更是少之又少,在國內(nèi)尚未有見。本試驗成功構(gòu)建了針對多能性相關(guān)基因cNanog和cPouV的重組干擾載體,以期進(jìn)一步深入研究其在雞胚胎干細(xì)胞中的生物學(xué)功能。
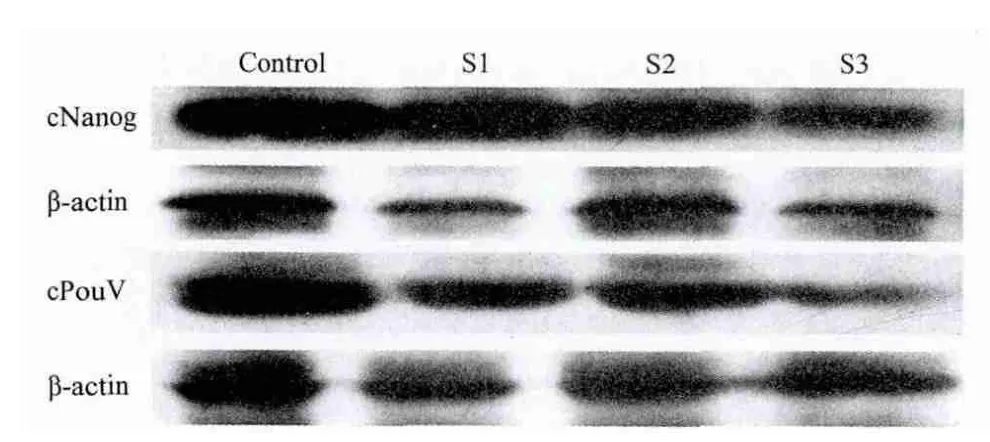
圖5 轉(zhuǎn)染pSuper-shRNA 24h后cNanog和cPouV蛋白表達(dá)水平
siRNA的獲得方法有多種,包括化學(xué)合成、體外轉(zhuǎn)錄、長片段dsRNAs經(jīng)RNaseIII類降解、siRNA表達(dá)載體或者病毒載體在細(xì)胞中表達(dá)、siRNA表達(dá)框在細(xì)胞中表達(dá)等,前3種方法的最大缺點是都需要直接操作RNA,操作不便,并且siRNA進(jìn)入細(xì)胞后容易降解,RNAi效應(yīng)維持時間短。為了克服這些不足,本研究采用了基于pSuper質(zhì)粒表達(dá)siRNA的方式進(jìn)行RNAi,不僅降低了制備siRNA的成本,簡化了操作,而且延長了siRNA作用時間,便于篩選穩(wěn)定表達(dá)細(xì)胞系用于研究基因的長期功能。pSuper質(zhì)粒含有RNA聚合酶III識別H1啟動子和一個5-6個連續(xù)的胸腺嘧啶(T)構(gòu)成的轉(zhuǎn)錄終止位點以及選擇標(biāo)記[15]。本試驗合成的寡核苷酸包含所選序列的正義和反義序列間用一段9nt的鏈(5'-TTCAAGAGA-3')連接;同時還包含5個連續(xù)的T作為RNA聚合酶III的終止信號,預(yù)測體內(nèi)轉(zhuǎn)錄后會形成3'端兩個U突出的莖部為19bp,環(huán)為9bp的短發(fā)夾結(jié)構(gòu),從而有效模擬RNA i過程中間體[16]。且pSuper質(zhì)粒帶有Puro標(biāo)簽,轉(zhuǎn)染細(xì)胞后,可使用嘌呤霉素篩選穩(wěn)定表達(dá)目的蛋白的細(xì)胞株。采用的真核表達(dá)載體pCMV-N-Flag的啟動子CMV可以高效啟動目的蛋白cNanog和cPouV在293T細(xì)胞中的表達(dá),含有1個可以編碼Flag標(biāo)簽的序列,可以表達(dá)出含有Flag標(biāo)簽的融合蛋白,便于使用抗Flag的抗體來識別目的蛋白,有利于目的蛋白檢測。質(zhì)粒轉(zhuǎn)染細(xì)胞的方法有多種,如電穿孔法、磷酸鈣法、脂質(zhì)體法和病毒介導(dǎo)法等,本試驗采取的磷酸鈣轉(zhuǎn)染法操作簡便,易于得到穩(wěn)定轉(zhuǎn)染,但對pH值要求較高且重復(fù)性差,因此每種質(zhì)粒都反復(fù)進(jìn)行了多次轉(zhuǎn)染以保持穩(wěn)定,轉(zhuǎn)染結(jié)果不僅進(jìn)一步證實了表達(dá)載體pCMV-Flag和pSuper-Retro-Puro重組質(zhì)粒可以轉(zhuǎn)染293T細(xì)胞,而且具有較高的轉(zhuǎn)染效率。
4 結(jié)論
本試驗首先構(gòu)建多能性相關(guān)基因cNanog和cPouV真核表達(dá)載體與pSuper-shRNA干擾載體,鑒定插入片段與預(yù)期相符后,共轉(zhuǎn)染293T細(xì)胞以表達(dá)目的蛋白。再采用Western blotting對構(gòu)建的重組干擾載體進(jìn)行檢測與篩選,在β-actin表達(dá)量保持相對一致時,加入重組干擾質(zhì)粒組的靶基因蛋白表達(dá)量較對照組有所下降,表明構(gòu)建的pSuper-shRNA能特異性抑制靶基因的表達(dá),且不同位點的序列抑制效果不同。
[1]Rodda DJ, Chew JL, Lim LH, et al. Transcriptional regulation of nanog by OCT4 and SOX2[J]. J Biol Chem, 2005, 280(26):24731-24737.
[2]Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J]. Cell, 2003, 113(5):631-642.
[3]Pan G, Thomson JA. Nanog and transcriptional networks in embryonic stem cell pluripotency[J]. Cell Res, 2007, 17(1):42-49.
[4]Soodeen-Karamath S, Gibbins AM. Apparent absence of oct 3/4 from the chicken genome[J]. Mol Reprod Dev, 2001, 58(2):137-148.
[5]Lavial F, Pain B. Chicken embryonic stem cells as a non-mammalian embryonic stem cell model[J]. Dev Growth Differ, 2010, 52(1):101-114.
[6]劉本杰, 陳志勝, 陳勝鋒, 等. 全能性相關(guān)基因cNanog、cPouV和Sox2在雞早期胚胎中的表達(dá)[J]. 中國組織工程研究, 2012(41):7733-7736.
[7]王丙云, 陳勝鋒, 劉本杰, 等. 全能性相關(guān)基因在雞胚胎干細(xì)胞中分化過程中的表達(dá)[C]. 南京:中國畜牧獸醫(yī)學(xué)會動物生理生化學(xué)分會, 2012.
[8]陳志勝, 劉本杰, 王丙云, 等. 全能性相關(guān)基因在早期雞胚發(fā)育過程中的表達(dá)[C]. 南京:中國畜牧獸醫(yī)學(xué)會動物生理生化學(xué)分會, 2012.
[9]Fire A, Xu S, Montgomery M K, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature, 1998, 391(6669):806-811.
[10]Bosher JM, Labouesse M. RNA interference:genetic wand and genetic watchdog[J]. Nat Cell Biol, 2000, 2(2):E31-E36.
[11]Sharp PA. RNA interference--2001[J]. Genes Dev, 2001, 15(5):485-490.
[12]Tabara H, Grishok A, Mello CC. RNAi in C. elegans:soaking in the genome sequence[J]. Science, 1998, 282(5388):430-431.
[13]Chang HS, Lin CH, Chen YC, et al.Using siRNA technique to generate transgenic animals with spatiotemporal and conditional gene knockdown[J]. Am J Pathol, 2004, 165(5):1535-1541.
[14]張曼玉, 陳志勝, 計慧琴, 等. 雞胚胎干細(xì)胞分離方法和培養(yǎng)體系的優(yōu)化[J]. 中國組織工程研究與臨床康復(fù), 2011(45):8429-8433.
[15]Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells[J].Science, 2002, 296(5567):550-553.
[16]莊淑珍, 竇忠英, 楊煒峰, 等. ES-D3細(xì)胞nanog基因干擾載體的構(gòu)建及其干涉效果[J]. 農(nóng)業(yè)生物技術(shù)學(xué)報, 2005(6):754-758.

