Bacillus cereus SG03 10L發酵罐中產胞外膽固醇氧化酶發酵條件優化
, ,, ,,
(1.安徽工程大學生物與化學工程學院,安徽蕪湖 241000;2.皖南醫學院微生物與免疫學教研室,安徽蕪湖 241000)
BacilluscereusSG0310L發酵罐中產胞外膽固醇氧化酶發酵條件優化
葛飛1,龔倩1,張慧敏1,黃寅1,石貝杰1,桂琳2,*
(1.安徽工程大學生物與化學工程學院,安徽蕪湖 241000;2.皖南醫學院微生物與免疫學教研室,安徽蕪湖 241000)
目的:優化菌株BacilluscereusSG03在10L發酵罐中產膽固醇氧化酶的工藝條件,為該菌株的進一步應用提供依據。方法:在10L發酵罐中,通過單因素實驗,分別考察了培養液起始pH、攪拌速率、溶解氧(DO)濃度對BacilluscereusSG03產胞外膽固醇氧化酶的影響。結果:較佳的發酵條件為培養液起始pH6.8、攪拌速率250r/min、溶解氧(DO)濃度80%。在此基礎上,對發酵過程進行了兩階段DO控制,發酵前20h DO控制在90%,然后調整為20%,直至發酵結束。較單一DO控制,最大胞外膽固醇氧化酶產量、生產效率分別提高了30.2%和20.0%,達到了1.38U/mL和0.03U/(mL·h)。
蠟狀芽孢桿菌,膽固醇氧化酶,發酵罐,兩段溶解氧控制
膽固醇氧化酶(COD)是一種雙功能的黃素酶,能夠催化膽固醇氧化為膽甾-4-烯-3-酮,在許多細菌中都發現具有此酶[1-2]。膽固醇氧化酶在醫學[3]、農業[4]和生物催化[5]方面有著廣泛的應用。
國內外學者對微生物來源的膽固醇氧化酶的特性、結構、應用和基因克隆等方面進行了大量研究,并取得了不少成果[6]。桑吉等采用超聲波聯合亞硝基胍的復合誘變方法處理膽固醇氧化酶產生菌(甾短桿菌),使其產酶能力提高了140%,酶活達到了1.21U/mL[7]。許曉燕等對Brevibacteriumsp. 產膽固醇氧化酶的發酵條件及其酶學性質進行了研究,在最適條件下,膽固醇氧化酶的酶活力達到24.01U/mg[8]。王瓊等對一株紅球菌屬膽固醇氧化酶高產菌株的分子生物學鑒定及酶學特性的研究[9]。Sun Y等研究表明,通過對COD活性中心保守序列區域內的氨基酸殘基進行定點突變,可有效提高突變酶的熱穩定性[10]。
本文在搖瓶實驗研究的基礎上,獲取最佳培養基配方和乳化劑后,進一步考察了培養液初始pH、攪拌速率和DO對BacilluscereusSG03在10L發酵罐中產胞外COD的影響,為該菌株進一步擴大生產COD提供了實驗數據。
1 材料與方法
1.1材料與儀器
1.1.1 菌種BacilluscereusSG03由安徽工程大學生物工程教研室篩選、保藏。
1.1.2 主要試劑 蒽酮,膽固醇,4-安基-安替比林,TritonX-100購自國藥集團化學試劑有限公司;辣根過氧化物酶購自美國Sigma公司。
1.1.3 培養基(g/L) 斜面培養基:牛肉膏 5,蛋白胨 10,NaCl 5,瓊脂 20,pH自然;
種子培養基:葡萄糖 20,牛肉膏 5,蛋白胨 10,NaCl 5,pH自然;
發酵培養基:葡萄糖 2,膽固醇2,蛋白胨 4,K2HPO40.2,MgSO4·7H2O 0.05,FeSO4·7H2O 0.01,CH3COONH42,NaCl 1,吐溫80 3,CaCl20.1,pH自然。
1.1.4 主要儀器設備 BIOTECH-10JSA 3L-10L發酵罐 上海保興生物設備工程有限公司;QHZ-123B組合式全溫度振蕩培養箱 江蘇省太倉市華美生化儀器廠;LDZX-50KBS立式壓力蒸汽滅菌器 上海申安醫療器械廠;HH-6數顯恒溫水浴鍋 金壇市杰瑞爾電器有限公司;L5型紫外可見分光光度計 上海儀電分析儀器有限公司;L550型臺式低速離心機 湖南湘儀實驗室儀器開發有限公司;TG16-W微量高速離心機 湖南湘儀實驗室儀器開發有限公司;KQ-250DE型醫用數控超聲波清洗器 昆山市超聲儀器有限公司。
1.2實驗方法
1.2.1 10L發酵罐培養條件 10L發酵罐按6.5L裝液量將發酵培養基加入發酵罐,121℃滅菌30min,冷卻至30℃,將活化好的搖瓶種子液按3%的接種量接入發酵罐,培養溫度33℃,通氣量1∶1~1∶1.3,攪拌轉速200~350r/min,起始pH自然,培養時間56h。在此基礎上,考察起始pH、攪拌速率、DO等因素對SG03菌株發酵過程的影響。
1.2.2 膽固醇氧化酶活力的測定 按照參考文獻[11]進行COD酶活測定。酶活力顯色體系:4-氨基-安替比林1.4mmol/L,苯酚7mmol/L,磷酸鉀緩沖液50mmol/L(pH=7.0),辣根過氧化物酶6U/mL,膽固醇lmmol/L,Triton X-100 l%。
酶活定義:每分鐘催化生成1mmol H2O2所需酶量為一個活力單位。標準曲線確定:取酶活力顯色體系3mL于試管中,37℃保溫3min,分別加入濃度為2.5mmol/L的H2O2溶液50、100、150、200、250μL,反應5min后測OD500值。
酶活測定:取顯色體系溶液3mL于試管中,37℃保溫3min,加入0.1mL酶液,37℃準確反應10min,沸水浴加熱3min終止反應,冷卻后測OD500。
酶活計算公式:酶活=0.1996×X×V×K/T,式中:X為反應液的吸光度A500;V為反應液總體積(mL);K為酶液稀釋倍數;T為反應時間(min)。
1.2.3 DO值控制 發酵液 DO通過溶氧電極來檢測(以一定條件下溶解氧量相對于飽和溶解氧量的百分比來表示)。
1.2.4 生物量的測定 用真空泵和抽濾瓶對一定量的發酵醪進行抽濾,用蒸餾水反復沖洗3次菌體后,收集濕菌體置于55℃電熱鼓風干燥箱中烘干至恒重后,準確稱重,得菌絲干重(生物量)。
生物量(g/L)=菌絲體重量(g)/發酵液體積(L)
1.2.5 發酵過程中相關參數的計算
菌體平均生長速率=(最大生物量-接種量)/(接種量×獲得最大生物量的培養時間);
COD生產率=凈最大COD產量/獲得最大COD產量的培養時間。
1.2.6 估算菌體比生長速率(μ)和產物比生產速率(ρ) 估算μ和ρ,參照文獻[12-13]。根據μ和ρ的定義:
式(1)
當時間間隔很小時,可以近似用式(2)估算得到μ和ρ:
式(2)
式(1)和(2)中,μ:比生長速率;ρ:產物比生產速率;X:生物量;P:COD產量。
因此,根據實驗數據可以用式(2)直接估算得到不同培養時刻的μ和ρ。
1.2.7 數據處理方法 所有實驗數據均為3次重復實驗結果的平均值。采用SPSS17.0統計軟件進行數據分析。
2 結果與討論
2.1BacilluscereusSG03在10L發酵罐中生物量、胞外COD酶活變化情況
在1.2.1的發酵條件下,SG03生物量和胞外COD酶活變化如圖1所示。
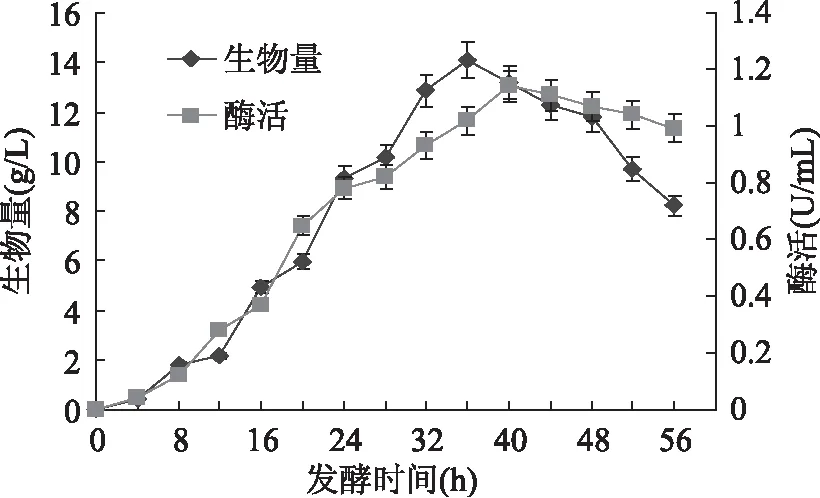
圖1 SG03 10L發酵罐中生物量和酶活變化曲線Fig.1 The curve of biomass and enzyme activity of COD in the broth of SG03 in a 10L fermentor
由圖1可以看出,生物量、胞外COD酶活均呈現先增大后減小的趨勢,生物量在發酵第36h出現最大值,為14.08g/L;COD酶活在發酵第40h出現最大值,為1.14U/mL。酶活最大值的出現比生物量最大值滯后4h。在發酵第12h后,生物量增加趨勢變大,這一時期持續到第36h左右,此后生物量開始下降,第48h后下降趨勢進一步加大。
在發酵前16h,COD酶活增加比較緩慢,16h以后產酶水平增加比較明顯,在發酵第40h時,酶活出現最大值,隨后呈降低趨勢。在發酵第56h,胞外COD酶活僅為0.99U/mL,比最高酶活降低了13.2%。
2.2培養液起始pH對SG03產胞外COD的影響
pH是微生物發酵過程中重要參數之一,它對細胞生長和代謝產物的合成有重要影響。搖瓶實驗結果表明,培養液起始pH為6.5~7.0范圍內時較有利于胞外COD的合成。為了進一步了解pH對10L發酵罐中SG03產胞外COD的影響,本文考察了在10L發酵罐中培養液起始pH分別為5.8、6.3、6.8、7.5和8.0時對胞外COD合成的影響,結果如圖2所示。
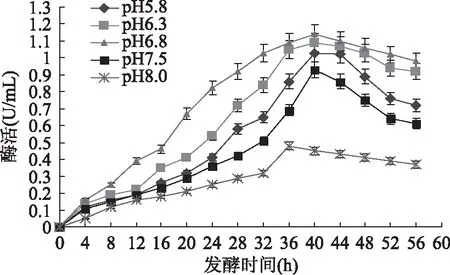
圖2 pH對產膽固醇氧化酶的影響Fig.2 The effect of pH on enzyme activity of COD in the broth
由圖2可見,除起始pH為8.0時胞外COD酶活最大值出現在發酵的第36h外,其他條件下均出現在第40h。初始pH為5.8、6.3、6.8、7.5和8.0時,發酵過程中COD最高酶活分別為1.03、1.09、1.14、0.93和0.48U/mL,說明SG03菌株于10L發酵罐中在中性偏酸的環境下更有利于發酵液中COD的積累,因此,培養液的較佳初始pH確定為6.8。
2.3攪拌速率對COD產生的影響
發酵罐培養過程中,過低的攪拌速率會使DO降低,不利于菌體的生長和代謝產物的合成;過高的攪拌速率又會造成發酵液產生大量氣泡,導致發酵液逃逸,影響菌體生長代謝,甚至引起染菌。為了確定較佳的攪拌速率,本文考察了攪拌速率分別為200、250、300和350r/min時,對胞外COD合成的影響,結果如圖3所示。
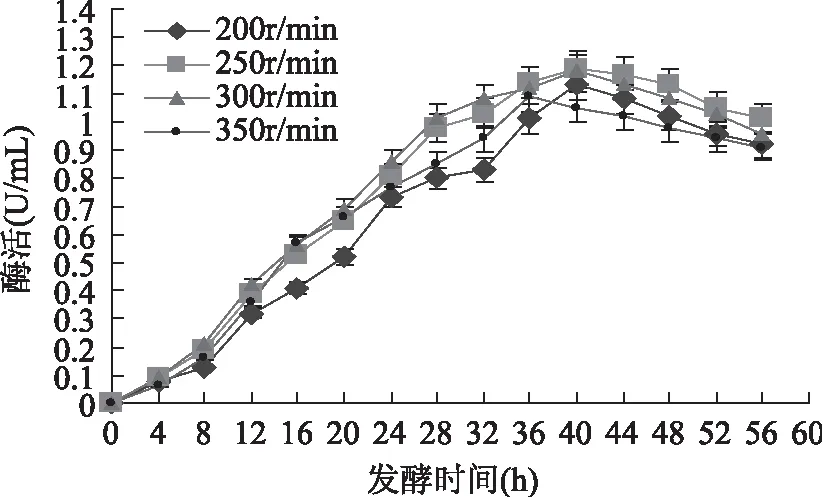
圖3 攪拌速率對產酶的影響Fig.3 The effect of stirring rate on enzyme activity of COD in the broth
由圖3可見,當攪拌速率分別為200、250、300和350r/min時,胞外COD酶活的最大值分別出現在發酵的第40、40、40和36h,且酶活分別為1.13、1.19、1.18和1.09U/mL。較高的攪拌速率下,胞外COD的最大值反而較小,原因可能是由于轉速過高產生了大量泡沫,造成發酵液逃逸,使培養液中COD誘導物膽固醇大量聚集,不能很好的分散到發酵液中,進而影響胞外COD的合成。因此,確定較佳攪拌速率為250r/min。
2.4 DO對COD產生的影響
對于好氧微生物來說,發酵液中DO濃度對微生物生長和產物形成有著重要影響。本文考察了不同DO濃度對SG03產胞外COD的影響,實驗通過改變通氣速率控制培養液的DO,實驗選取DO控制在20%、40%、60%、80%和90%五個不同水平。
不同DO濃度對SG03產胞外COD的影響如圖4所示。當DO分別控制在20%、40%、60%、80%和90%的空氣飽和度時,最高酶活分別為0.91、0.93、0.96、1.06和1.04U/mL。隨著DO濃度的增加,胞外COD酶活最大值出現的時間逐漸提前,分別為發酵的第52、52、48、40和36h。當DO為90%時,COD酶活在第36h已達最大值,比DO濃度控制在20%和40%時,胞外COD酶活最大值出現的時間整整提前了16h;但隨后酶活開始下降,原因可能是過高的DO導致菌體死亡速度加劇和酶活快速衰減。由以上DO實驗結果可以看出,在SG03發酵過程中,發酵前期較高的DO濃度較有利于胞外COD的積累,發酵后期較低的DO濃度較有利于胞外COD的積累;同時,DO對SG03產胞外COD的影響較培養液起始pH、攪拌速率等因素的影響要大,因此,為了獲得更高的COD產量,提出在發酵過程中實施兩階段DO控制策略。
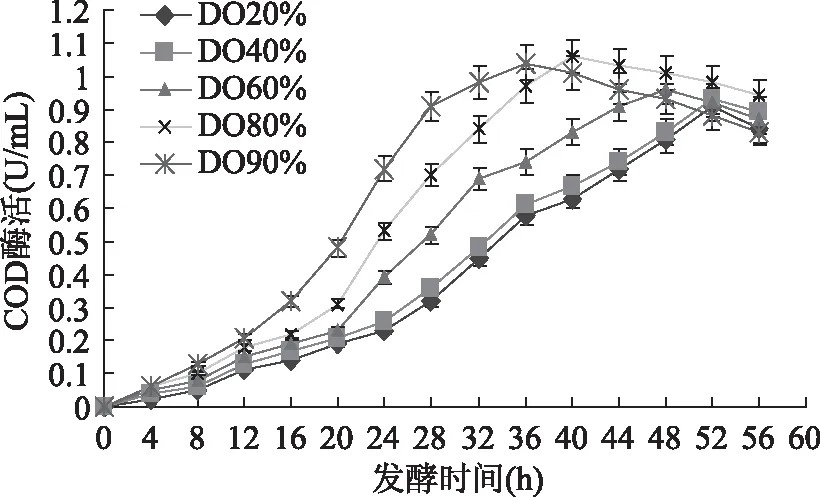
圖4 DO對產酶的影響Fig.4 The effect of DO on enzyme activity of COD in the broth
2.5兩階段DO控制對COD產生的影響
由表1可知,在單一DO控制實驗中,隨著DO從90%降到20%,菌體最大生物量和細胞平均生長速率相應下降,這表明在DO 20%時,部分細胞呼吸代謝受到了限制。但是,與DO90%相比,DO為80%時,COD產量最高。這表明在產物合成期,并非溶解氧越大越有利于COD合成。因此,我們推斷COD的產生可能與菌體生長對氧的要求不一樣。另外,我們從圖4還可以看出,雖然當DO控制在較低濃度20%和40%時,COD的最大產量均低于最高的DO80%。但在發酵的第40h后,仍然有較強的COD合成能力,COD酶活增加趨勢一直維持到發酵的第52h,即菌體在發酵后期具有較大的COD比生產速率(ρ值);此時,較高溶解氧濃度80%和90%條件下的COD比生產速率已呈明顯下降趨勢。
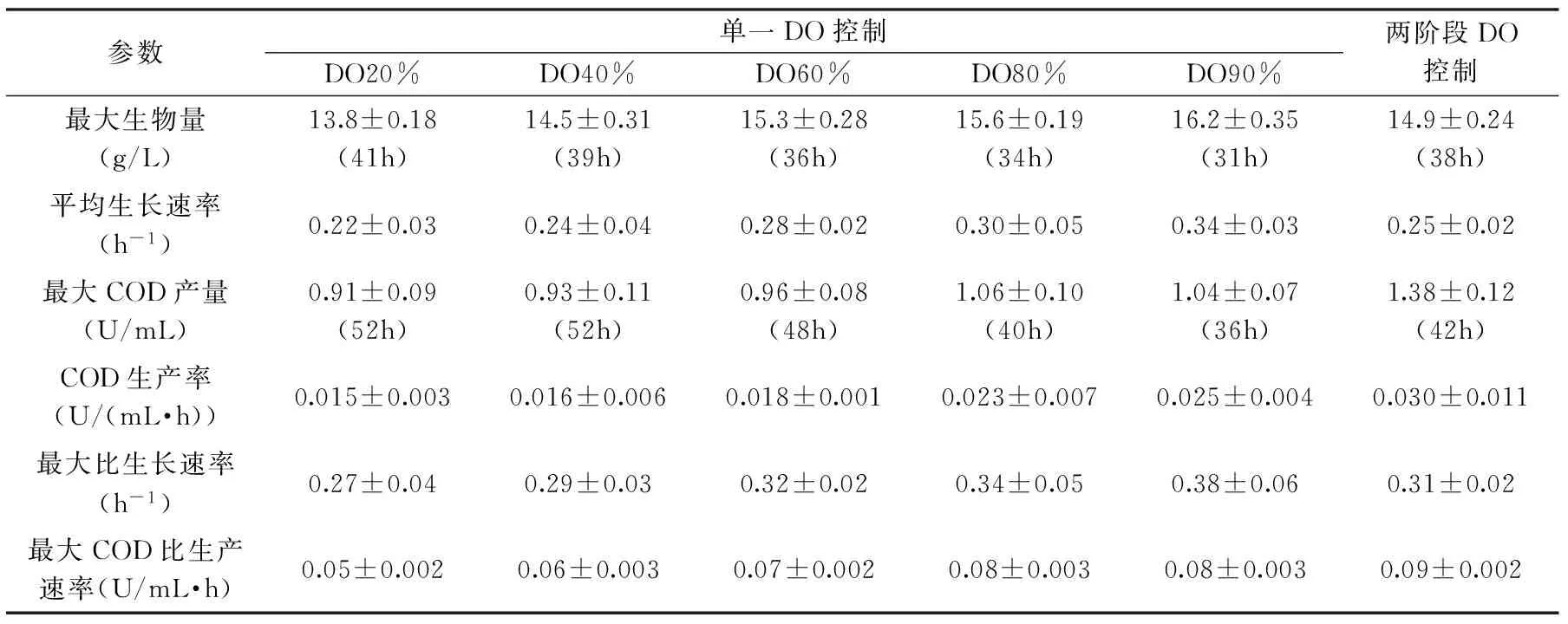
表1 DO對SG03產生COD的影響Table1 Effects of various DO control on the COD production in submerged fermentation of SG03 in 10L bioreactor
注:最大生物量和最大COD產量一欄中括號中的時間表示該數值出現的時間。
由圖4可以看出,在單一DO控制實驗中,培養前期,DO濃度控制在90%時,COD比生產速率ρ值高于其它DO濃度;培養后期,DO控制在20%時,ρ值高于其它DO濃度。因此,為了在整個發酵過程中都能獲得較高的ρ值,提出兩階段DO控制策略:發酵前期(前20h)DO控制在90%,當ρ值下降時,DO控制轉至20%,直到發酵結束。
圖5顯示了在10L發酵罐中實施兩階段DO控制策略時,SG03發酵動態變化過程。發酵前期,ρ值在培養的第20h達到一個較大值,隨后ρ值開始出現下降,此時將DO從90%變為20%。通過實施兩階段DO控制策略,胞外COD產量最大值和生產率分別達到了1.38U/mL和0.03U/(mL·h),較單階段DO控制時獲得的最高胞外COD產量和生產率分別增加了30.2%和20.0%。
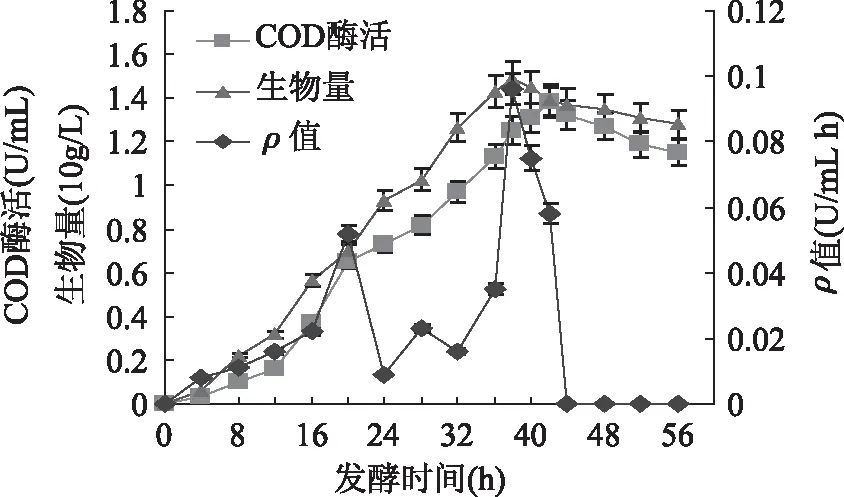
圖5 10L發酵罐中兩階段DO控制時 SG03發酵動態變化過程Fig. 5 Time profiles of cell growth,ρ and COD production in submerged fermentation of SG03 with two-stage DO control in 10L fermentor
3 結論
目前,COD在美國、日本等發達國家已經進入商品化生產,主要以發酵法進行生產。該酶及其氧化產物在臨床診斷、制藥、食品和農業等領域被廣泛應用,商業價值巨大。我們國家對COD的使用主要依賴于進口,因此加強對COD的理論和應用研究,具有重要的現實意義。
本文在10L發酵罐中,研究了不同發酵條件對BacilluscereusSG03菌株產胞外COD的影響。在發酵過程中,菌體生物量和胞外COD的總體變化趨勢一致,均呈現先增加后減小的趨勢。發酵液起始pH為6.8時,最有利于胞外COD的積累,其最大值為1.14U/mL,表明該菌株在中性偏酸的環境下更有利于胞外COD的合成。攪拌速率為250r/min時,更有利于胞外COD的生成。
本實驗中,DO對SG03菌株合成胞外COD具有重要影響,在單一DO控制實驗結果的基礎上,提出了兩階段DO控制策略,顯著提高了胞外COD產量和生產效率,最大COD產量和COD生產率分別達到了1.38U/mL和0.03U/mL·h。在其它微生物發酵研究中,也有報道DO兩階段控制措施的有效性,但具體措施有所不同。在Aspergillusflavus發酵生產Kojic acid中,Ariff等基于氧限制有利于Kojic acid生產率的提高,提出了兩階段DO控制提高Kojic acid產量的策略[14]。在Torulopsisglabratausting發酵生產丙酮酸中,Li等通過采用兩階段氧供應(改變攪拌速度),顯著提高了丙酮酸的生產率[15]。
[1]馬玉超. 微生物膽固醇氧化酶的研究進展[J]. 北京林業大學學報,2012,34(6):148-151.
[2]Vrielink A,Ghisla S. Cholesterol oxidase:biochemistry and structural features[J]. FEBS Journal,2009,276(23):6826-6843.
[3]Doukyu N. Characteristics and biotechnological applications of microbial cholesterol oxidase[J]. Applied Microbiology and Biotechnology,2009,83(5):825-837.
[4]Purcell J P,Greenplate J T,Jennings M J,etal. Cholesterol oxidase:A potent insecticidal active against boll weevil larvae[J].Biochemical and Biophysical Research Communications,1993,196(3):1406-1413.
[5]Corbin D R,Grebenok R J,Ohnmeiss T H,etal. Expression and chloroplast targeting of cholesterol oxidase in transgenic tobacco plants[J]. Plant Physiology,2001,126(3);1116-1128.
[6]張玲,楊海麟,孫燕,等. 微生物膽固醇氧化酶的研究進展[J]. 食品科學,2009,30(9):225-229.
[7]桑吉,王龍剛,李忠琴,等. 膽固醇氧化酶高產菌株的復合誘變選育[J]. 食品工業科技,2006,27(6):87-89.
[8]許曉燕,張銳,譚曉晶,等. 膽固醇氧化酶的發酵條件及酶學性質研究[J]. 食品與發酵工業,2006,32(2):41-45.
[9]王瓊,霍影,汪靜,等. 一株膽固醇氧化酶高產菌的分類鑒定及酶學特性的研究[J]. 四川師范大學學報,2013,36(6):930-935.
[10]Sun Y,Yang H L,Wang W. Improvement of the thermostability and enzymatic activity of Cholesterol oxidase by site-directed mutagenesis[J]. Biotechnology Letters,2011,33(10):2049-2055.
[11]黃寅,葛飛,陶玉貴,等. 膽固醇氧化酶高產菌株的誘變選育及產酶條件優化[J]. 安徽工程科技學院學報,2009,24(4):8-11.
[12]Pefia A,Pardo J P,Ramirez J. Early metabolic effects and mechanism of ammonium transport in yeast[J]. Archives of Biochemistry and Biophysics,1987,253(2):431-438.
[13]Mcdermott J F,Lethbridge G,Bushell M E. Estimation of the kinetic constants and elucidation of trends in growth and erythromycin production in batcn and continuous cultures of Saccharopolyspora erythraea using curve-fitting techniques[J]. Enzyme and Microbial Technology,1993,15(8):657-663.
[14]Ariff A B,Salleh MS,Ghani B,etal. A eration and yeast extract requirements for kojic acid produntion byAapergillusflavuslink[J]. Enzyme and Microbial Technology,1996,19:545-550.
[15]Li Y,Hugenholtz J,Chen J,etal. Enhancement of pyruvate production by Torulopsis glabata using a two-stage oxygen supply control strategy[J]. Appl Microb Biotenchnol,2002,60:101-106.
Fermentation conditions optimization of cholesterol oxidase in the broth byBacilluscereusSG03 in a 10L fermentor
GEFei1,GONGQian1,ZHANGHui-min1,HUANGYin1,SHIBei-jie1,GUILin2,*
(1.Department of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China;2.Department of Microbiology and Immunology,Wannan Medical College,Wuhu 241000,China)
Objective:The technique of producing cholesterol oxidase by the strain ofBacilluscereusSG03 in a 10L fermenter was optimized,in order to provide the basis for further application of the strain. Methods:The effect of pH of the culture medium,stirring rate and DO on the production of cholesterol oxidase in the broth byBacilluscereusSG03 was studied in a 10L fermentor. Results:The optimum fermentation conditions were initial pH at 6.8,stirring rate at 250r/min and DO at 80%. Based on the results,a strategy of two stage DO manipulation was proposed,controlling DO at 90% before the 20h and at 20% from the 20h to at the end during the fermentation. The maximum COD activity in the broth and production efficiency reached 1.38U/mL and 0.03U/(mL·h),respectively improved 30.2% and 20.0% higher than with one stage manipulation.
Bacilluscereus;cholesterol oxidase;fermentor;two stage DO manipulation
2014-02-10 *通訊聯系人
葛飛(1978-),男,副教授,主要從事微生物資源開發與利用研究。
安徽省高等學校優秀青年人才基金項目(2011SQRL079);安徽省高等學校省級自然科學研究重點項目(KJ2013A049)。
TS201.3
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001

