微藻油脂的研究進展
,, ,
(青島科技大學化工學院,山東青島 266042)
微藻油脂的研究進展
翟映雪,梁成偉*,張偉,于建生
(青島科技大學化工學院,山東青島 266042)
全球能源危機使可再生能源的開發和利用越來越受到人們的關注。與產油農作物相比,微藻憑借其結構簡單、生長速度快、有較高的含油率等特點成為生物能源產業最具競爭力的選擇之一。本文首先介紹了微藻的種類、藻體中的油脂,然后從影響油脂積累的因素、微藻中油脂的提取和微藻高油脂化基因工程方面進行了闡述,最后對微藻生產生物柴油產業的發展趨勢和研究方向進行了展望,為進一步降低微藻產油成本,提高微藻生物柴油經濟性提出了一條極有可能實現工業化的潛在高效生產途徑。
微藻,能源,生物柴油,綜合利用,三羧酸甘油酯
能源是人類生存與發展的生物基礎,傳統的能量有水、木材、石油、天然氣和煤炭等。但是隨著全球經濟的發展,石油、煤炭等能源的過量消耗,能源正面臨枯竭的危機,同時新的能源生產供應系統又未能建立,由此產生了在交通運輸、金融等方面的一系列問題,所以尋找新型能源形式成為國際研究的熱點[1]。許多國家將注意力轉移到可再生生物能源的開發利用上,希望能替代化石能源。生物質能源是指利用生物本身的有機物質直接轉化為能源物,其低碳、節能、環保的優勢受到全球各國的普遍關注[2-4]。生物柴油屬于生物質能源,與石化柴油相比具有較多的優點,如不含硫和芳烴、十六烷值高、可被生物降解、對環境危害小等,且其閃點高,無論是儲存、使用還是運輸都非常安全,所以成為最受歡迎的石油替代能源之一[3]。
在眾多的生物質中,微藻具有生物量大、生長周期短、易培養、含有較多的脂類物質等優點,可直接產生氫氣或利用快速熱解和直接液化技術生產油品,還有碳減排的功效。多數微藻都是自養性的,利用光合作用的效率非常高,產生的代謝物種類也很多。光合作用是唯一一種能將CO2轉化為有機成分的過程,利用太陽能,將無機物轉化為氫、高不飽和烷烴、油脂等能源物質。大規模培養微藻,其單位面積是油料作物的10~20倍,并且微藻適應能力強,可以在各種水體環境下生長,如鹽堿地、海洋等,不占據陸地有限的耕地面積[5]。表一[2,4]比較了不同生物柴油原料的油脂成分和產量。由表可以看到,高產油微藻的油脂含量高達70%,其產量在136900L/ha/year,高于其他作物。可以說,微藻是當今最有開發前途的能源之一。
近幾年,西方發達國家在微藻能源上投巨資進行研發及產業化的消息不斷傳來,美國2007年啟動了微藻能源計劃,被稱為“微型曼哈頓計劃”;2008年10月,英國碳基金公司啟動了目前世界上最大的藻類生物燃料項目,投入的2600萬英鎊將用于發展相關技術和基礎設施,該項目預計到2020年實現商業化。2011年我國微藻能源方向首個國家重點基礎研究發展計劃(“937計劃”)項目已經正式啟動。到2015年該項目結題時,有望突破微藻制油高成本瓶頸。此外,澳洲、日本、西歐、印度和南非的政府或企業也投入巨資進行微藻生物柴油的研究。這些研究的發展和技術的進步,有助于進一步降低微藻生物柴油的生產成本,使其大規模應用得以早日實現。
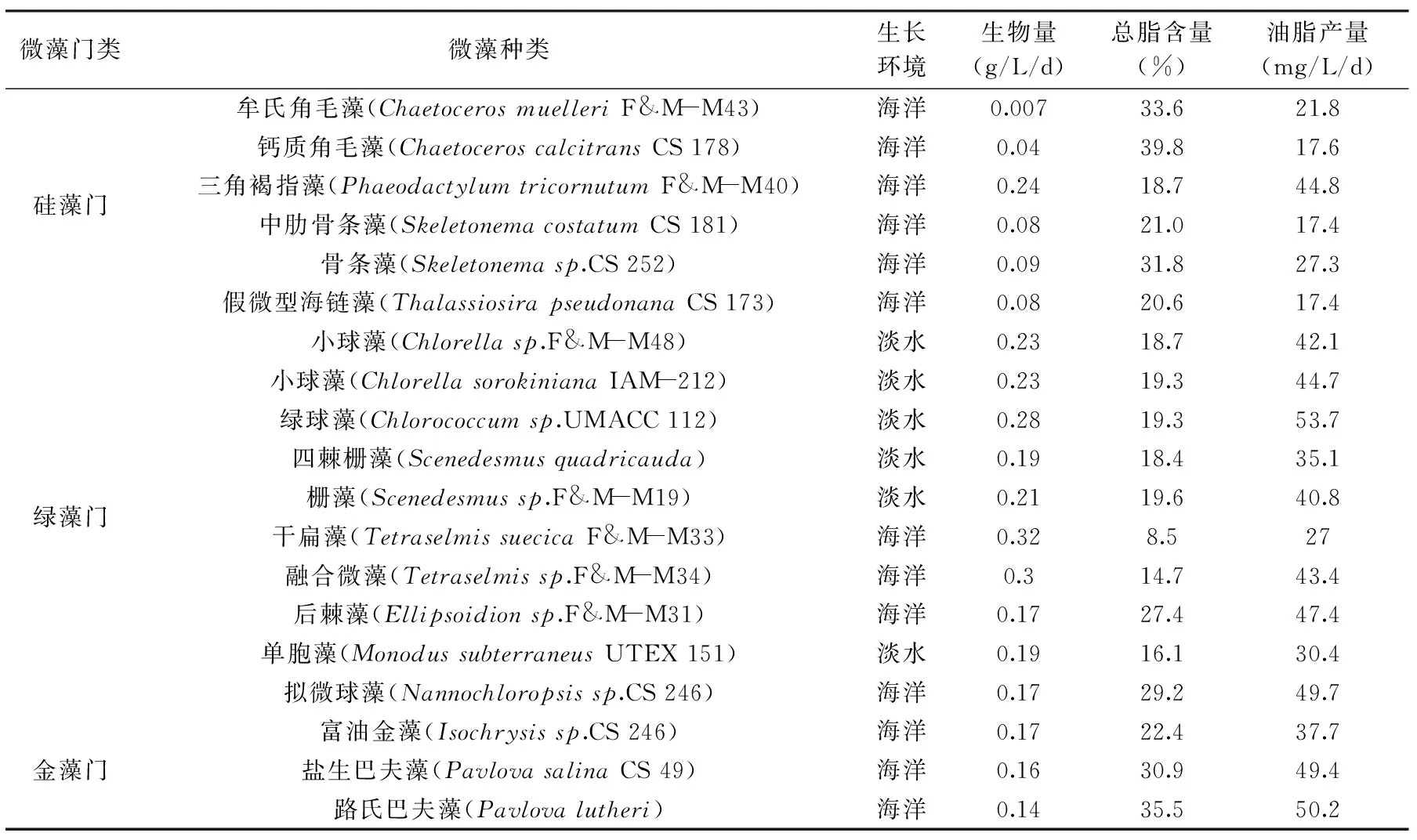
表2 微藻的生物量、總脂含量及油脂產量Table 2 Biomass productivity,lipid content and lipid productivity of microalgal strains
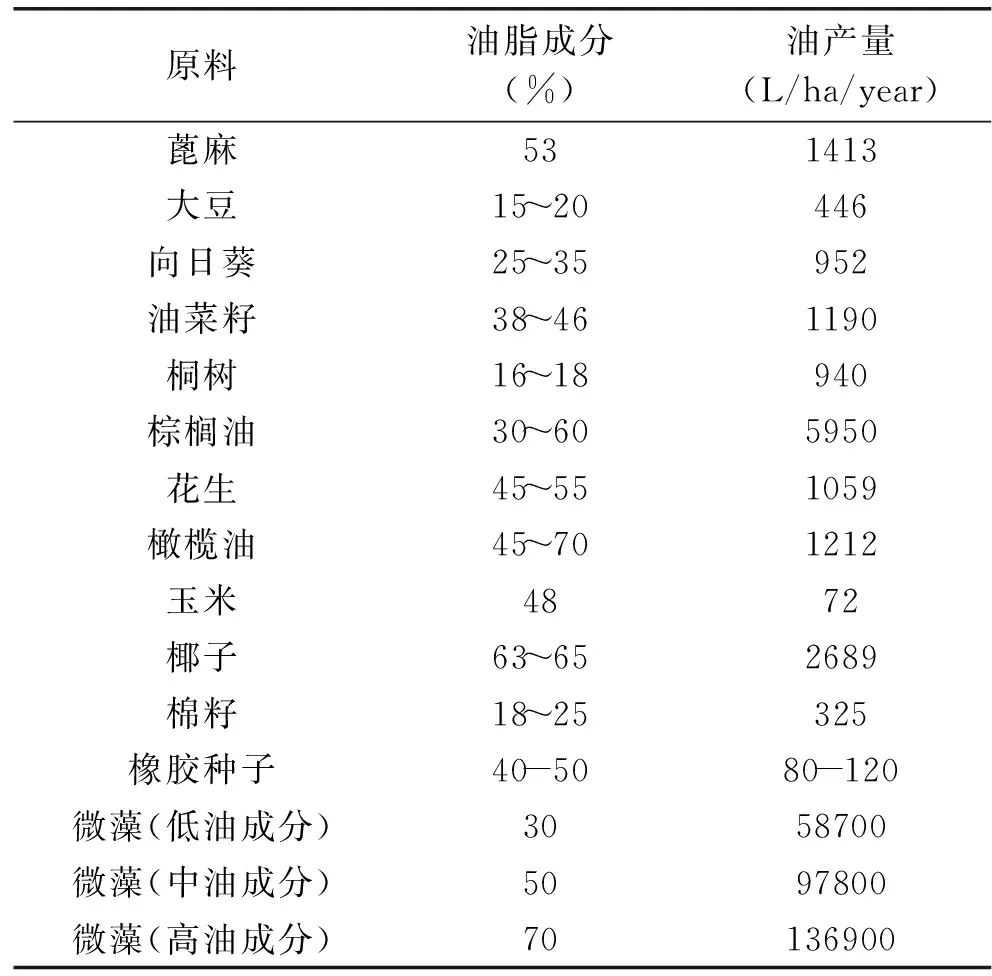
表1 不同生物柴油原料油脂成分和產量Table 1 Comparison of microalgae with other biodiesel feedstocks
1 微藻的種類
微藻種類繁多,廣泛分布于海洋、湖泊、陸地等地,是一類細胞結構簡單、生物速度快的原核或真核光合微生物[6]。根據微藻細胞所含色素種類、生活史和細胞基本結構,目前常見的微藻主要歸于八個門類,分別是:硅藻門、綠藻門、金藻門、藍藻門、甲藻門、紅藻門、隱藻門和黃藻門[7]。含油脂較多的微藻門類集中在硅藻門、綠藻門、金藻門中。Rodolfi[8]等在250mL燒瓶中培養微藻,并比較了這幾十種微藻的生物量、總脂含量和油脂產量,如表2所示。
常見的硅藻種類有三角褐藻指藻、角毛藻、小新月菱形藻小環藻等。硅藻同化產物為脂肪、金藻昆布糖和異染小粒。現有研究資料表明[2],在正常生長狀態中,各種微藻平均總脂肪含量為干重的22.7%,而在脅迫狀態下可達干重的44.6%以上。高等植物是由綠藻進化而來的,所以與其他種類的藻相比,綠藻受到了研究者們得更多關注。培養較多的大細胞綠藻有小球藻、擬微球藻、萊茵衣藻、雨生紅球藻等。綠藻門得油脂平均總脂含量為干重的25.5%,在光氧化或營養鹽迫等逆境下,細胞總脂含量可高達53.7%。金藻門的微藻主要分布在淡水中,海水中生活的種相對較少。其同化產物是金藻昆布多糖和油滴狀脂肪,特別在休眠孢子基包囊中,同化產物含量相當大一部分是油脂。培養較多的單細胞金藻有叉邊金藻和球等邊金藻等。
2 微藻中油脂
2.1微藻中的油脂類型
微藻中產生的油脂一般包括中性油脂、極性油脂,還有一些非極性脂成分,如蠟酯、固醇酯、甘油三酯,另外像生育酚、類胡蘿卜素等異戊烯衍生物也存在于微藻中。微藻中的油脂可以分為兩個類別,分別是:貯存脂(非極性脂)和結構脂(非極性脂)。貯存脂中的三酰基甘油酯(TAGs),主要由可轉化成生物柴油大部分的飽和脂肪酸和一部分的不飽和脂肪酸組成[1]。結構脂主要由多不飽和脂肪酸組成,長鏈的多不飽和脂肪酸在生物體尤其是哺乳動物體內起著重要的調節作用。極性脂和固醇類脂是細胞膜的主要組成成分,這些成分使細胞膜具有選擇性滲透的特性。同時,這些脂在調節膜的流動性、增加膜的穩定性以及降低水溶性物質的通透性等都起著重要作用。一些極性脂類,除了維持結構穩定的功能外,還是細胞信號通路的關鍵的中間體,如肌醇脂類、鞘脂類等。
非極性脂類中的TAGs很容易被分解代謝,在新陳代謝過程中它作為能源起了一個重要的作用[9]。一般來說,TAGs在有光照的條件下合成,貯存在細胞質的油滴中,然后在黑暗的條件下用于極性脂的合成[10]。微藻中的TAGs一般是飽和和多不飽和脂肪酸酯化而成,而有些油脂豐富物種中積累大量的長鏈單不飽和脂肪酸,也可酯化形成TAGs[11-12]。有學者對缺刻源綠藻(Parietochloris incisa)中TAGs積累與其儲存葉綠素脂質做出研究,結果表明微藻中的TAGs的主要功能并非只有貯存能量。當環境條件突然改變,不飽和脂肪酸的從頭合成變慢,其合成的TAGs用其特有的酰基組結構合成甘油二脂和其他極性脂類,以適應環境變化引起的質膜重組[13-14]。
2.2影響微藻生長及油脂積累的因素
微藻中脂肪酸含量不僅與微藻的種類有關,還受組成個體的基因控制,微藻在正常生長條件下,合成的脂肪酸含量較少。而微藻受到化學刺激,如營養鹽、鹽度等含量的改變,或物理等脅迫條件的刺激,如光強、溫度發生較大的改變,其中的脂肪酸成分的合成和積累會受到較大影響。
2.2.1 營養物質氮和磷 營養物質不僅影響微藻的生長和繁殖,并且對微藻中的油脂和脂肪酸成分的積累有重要作用。大部分微藻種株在氮缺失的條件下,有積累油脂的趨勢,特別是三甘油酰酐[15-16]。柵藻(Scenedesmussp.)在氮饑餓條件下油脂達到30%[17],擬微球藻和小球藻分別增加了15.31%和16.41%[18]。童牧[19]等對缺刻源綠藻的研究顯示,該藻在完全培養基中的生物量都大于同一培養時間氮饑餓,而同一條件下,總脂肪酸含量提高了1.2倍。還有研究表明,氮缺失條件不僅使雨生紅球藻(Haematococcuspluvialis)細胞中油脂含量增加,同時對類胡蘿素含量的積累也有顯著影響,可能這兩種物質在細胞的抗逆反應中起著一定的保護作用[20]。磷饑餓促使大部分微藻總脂肪酸含量增加[21],如缺刻源綠藻(Parietochlorisincisa),球等邊金藻(Isochrysisgalbana),角毛藻(Chaetocerossp.)等。但有時候磷饑餓也可促進脂肪酸含量的降低。研究表明,在融合微藻(Tetraselmissp.)中,磷缺失條件下脂肪酸C18∶4ω3,C20∶5ω3和C22∶6ω3產量下降[22]。
2.2.2 溫度 一般來說,溫度對藻類的影響是隨著溫度的降低,不飽和脂肪酸含量增加;而隨著溫度的上升,飽和脂肪酸含量上升[23]。對杜氏鹽藻(Dunaliellasalina)在低溫下油脂成分的研究較為廣泛,溫度有30℃降低到12℃,不飽和脂肪酸含量顯著降低了20%[10]。丹麥棕鞭藻(Ochromonasdanica)培養溫度由15℃上升到30℃時,該藻的生物量和總脂肪酸含量都有明顯增加[24]。 然而,有研究者將培養羊角月牙藻(Selenastrumcapricornutum)的溫度由25℃降低到10℃,C18∶1的含量有所升高而C18∶2n-6和C18∶4n-3含量下降[25]。Patterson[26]等將小球藻(Chlorellasorokiniana)在不同的溫度梯度中培養,該藻種油脂含量沒有明顯變化。
2.2.3 鹽度 Takagi[27]等對杜氏鹽藻(Dunaliella)研究表明:該藻可在高鹽的環境中生存。將鹽濃度從0.5mol/L提高到3.5mol/L,大部分的飽和和不飽和脂肪酸都有顯著增加。Chen[28]等人對硅藻的研究也表明,當該藻在高鹽濃度的環境中時,鹽濃度由10g/L上升到20g/L,不飽和脂肪酸的含量顯著增加。雪藻[29]在0.75%鹽濃度下培養7h,最高的總脂肪含量增長了2倍,其中中性脂和極性脂別在1%和1.25%的鹽濃度下分別增長了68倍和10倍。可見,鹽度對一些藻種中總脂肪酸含量的影響十分巨大的。
2.2.4 pH和金屬離子 培養基中pH的波動可改變微藻的油脂成分,例如,堿性條件可使小球藻(Chlorella chlor1)中TAG含量大量積累。基于形態學觀察,由于堿性pH可抑制微藻生長,所以使微藻中的能量轉化形成TAG[30]。金屬離子如鎘、鐵、銅和鋅等也可影響一些微藻中油脂成分。EinickerLama[31]等對纖細裸藻(Euglena gracilis)在自養、異養條件下鎘離子濃度對其生長的影響進行了研究,結果發現三種培養下,鎘離子均能促進該藻單位細胞中總脂含量的積累。在銅離子和鋅離子誘導下,除了固醇類得脂含量變化不明顯外,其余脂類都有不同程度的增加。此外,Liu[32]等用鐵離子誘導對小球藻(Chlorellavulgaris)誘導的研究表明,在該藻對數生長期加入不同濃度的鐵離子,其總脂肪酸含量可增加到56.6%。
2.2.5 光照 光是影響微藻生長及其生化成分發生改變的重要因素。不同的光密度和波長通過改變微藻中油脂新陳代謝而改變油脂比例。一般而言,低光強能誘導極性油脂的合成,而高光強則能導致中性油脂的積累。廖啟斌[33]等報道三角褐指藻和小球藻不飽和脂肪酸含量隨著照度的增加呈下降趨勢。謬錦來[34]等人對兩株綠藻Pyramidomonassp.和ChlorophyceaeL-4的研究發現,隨著光強從39lx變化到3900lx,細胞總脂肪酸含量顯著降低。這是因為在最適生長光強條件下,南極冰藻的比生長速度增加,光合產物用以生長所需,因此脂肪的含量較低。而隨著光強的降低,2種綠藻的生長速度降低,有限的光合作用產物分配給潛在的能量儲存形式,如碳水化合物、脂肪等。
2.2.6 紫外線 紫外對微藻中油脂含量影響的研究主要集中在紫外線A(UV-A)和紫外線B(UV-B)的輻射影響。Srinivas 和 Ochs[35]報道了紫外線A對擬微球藻(Nannochloropsisoculata)中油脂積累的影響。UV-A使該藻中多不飽和脂肪酸含量顯著增加。Skerratt[36]對三種南極冰藻Odontellaweissflogii,Chaetocerossimplex和HaptophytePhaeocystis的分析表明,UV-B其總脂肪酸含量,脂肪酸成分和固醇物質含量有一定的影響。扁藻(Tetraselmissp.)在UV-B輻照4h后飽和脂肪酸和單不飽和脂肪含量升高,而多不飽和脂肪酸含量下降了50%。
3 微藻油脂的測定
收集的微藻懸濁液較易腐壞,必須在收集之后迅速處理,對藻液進行脫水和干燥。縮水干燥的方法一般有太陽干燥、低壓干燥、噴霧干燥、轉鼓式干燥、流化床干燥、冷凍干燥等。
干燥后的微藻,經充分研磨使微藻細胞壁破碎后再進行油脂的提取。傳統的提取有機溶劑提取法和索氏提取法,目前使用較為廣泛的是熒光染料測定法、傅里葉換紅外光譜法和磷酸香草醛法,還有其他的一些方法如銅試劑法、蘇丹黑染色法、核磁共振法、超臨界CO2提取法、離子液提取法等。
Folch[37]等首先建立了在動物組織中用有機試劑氯仿甲醇提取油脂的方法。Bligh和Dye[38]等將其方法改進,用有機試劑氯仿∶甲醇∶蒸餾水=2∶1∶0.9提取油脂,該方法也適用于藻類總脂的含量的測定。有機試劑提取法成本較為低廉,容易操作,在實驗室中適用較為普遍,缺點是需要大量的樣品,測量結果所得的油脂總量較低,有機試劑操作有毒性危害身體健康污染環境,操作耗時費力。熒光染料是一種較為新型的測定總脂的方法,倍受研究者的關注。尼羅紅、BODIPY505/515都是一種脂溶性熒光染料,其原理是細胞內總脂含量和熒光染料的熒光強度呈顯著相關。與傳統有機試劑提取法相比,熒光染料測定法無需將細胞破碎,可以直接在細胞活體中加入染料,所需樣品量較少,快速操作,靈敏度高。超臨界CO2提取法是通過控制氣體CO2的溫度和壓力來改變其溶解度,從樣品中提出脂類物質,然后經干燥測定總脂肪酸含量。這種方法提取總脂的效率較高,且較為安全。但其價格昂貴,不適于大規模提取。
4 微藻高油脂化基因工程
除了通過改變微藻生存條件使微藻合成較多的油脂,各國科學家還致力于應用基因工程改造微藻脂肪酸調控途徑,改善微藻脂肪酸合成途徑,從而實現微藻制備生物柴油的目的。許多研究者已經從萊茵衣藻(C.reinhardtii)分子水平、基因水平、生理學水平進行了研究[39-40]。近十年,微藻基因工程的研究已經取得了較大的進展,如表達序列標簽(EST)數據庫已經建立;幾種微藻的細胞核、線粒體和葉綠體基因的轉錄組序列已經確定。1990年Roessler[41]首次從小環藻(Cyclotellacryptica)中提取出與脂肪酸合成有關的限速酶乙酰輔酶A羧化酶(ACC)。ACC具有為脂肪酸的合成提供碳源,限制脂肪酸的合成并控制油脂沉積的功能之后成功改造了硅藻Cyclotellacryptica和Naviculasaprophila的基因。目前,正在研究選擇合適的分子載體,使ACC基因在細菌、酵母和植物中充分表達,還進一步將修飾的ACC基因引入微藻中以獲得更高效表達[6]。
5 展望
微藻能源化涉及到許多環節,包括多學科技術和多行業的參與。微藻的選育涉及到遺傳學、生物學,養殖過程關系到土地和農民生產和創收,生長涉及廢水、廢氣的利用方法,采收過程中關系到采收設備的制造,生物活性物質的提取需要化學、化工、生物等技術和設備等。所以說,微藻能源化是一個系統工程,需要各方的全面參與、配合、協調與投入。
另外,要綜合利用微藻的生物活性物質,在微藻的大規模、較低成本的培養和采收基礎上,首先對微藻中利潤較大、有較高價格空間的生物活性物質進行分離提純,然后再對微藻中的生物油脂進行提取,這樣,小小的微藻就產出兩類重要的產品。Harun[41]等也提出了關于微藻制備生物能源與產生的甲烷氣體綜合利用的方案,這有利促進經濟和生物柴油產業鏈的可持續發展。
著眼未來,將微藻培養、采收、深度開發和綜合利用形成產學研相結合的產業聯盟,將廢氣、廢地、廢水有效利用,形成上、中、下游的產業鏈,降低微藻能源化的成本,提高經濟效益,這是微藻能源實施產業化的重要途徑和方向所在。
[1]Sharma K K,Schuhmann H,Schenk P M,etal. High Lipid Induction in Microalgae for Biodiesel Production[J]. Energies,2012,5(5):1532-1553.
[2]Ahmad A L,Mat Y N H,Derek C J C,etal. Microalgae as a sustainable energy source for biodiesel production:a review[J]. Renewable and Sustainable Energy Reviews,2011,15(1):584-593.
[3]陳國,趙珺,蘇鵬飛,等. 微藻產生物柴油研究進展[J]. 化工進展,2011,10(2):2186-2193.
[4]Janaun J,Ellis N. Perspectives on biodiesel as a sustainable fuel[J]. Renewable and Sustainable Energy Reviews,2010,14(4):1312-1320.
[5]Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances. 2007,25(3):294-306.
[6]張英偉,劉煒. 微藻能源的研究進展[J]. 海洋科學,2012,6(1):132-138.
[7]劉志媛. 微藻生物柴油[M]. 海口:海南出版社,2010:18-23.
[8]Rodolfi L,Zittelli GC,Bassi N,etal. Microalgae for oil:strain selection,induction of lipid synthesis and outdoor mass cultivation in a low cost photobioreactor. Biotechnology and Bioengineering,2009,102(1):100-12.
[9]Gurr M I,Harwood J L. Lipid Biochemistry:An Introduction[M]. Blackwell:Oxford,1991:p. 320.
[10]Thompson G A. Lipids and membrane function in green algae[J]. Biochimica et Biophysica Acta,1996,1302(2):17-45.
[11]Bigogno C,KhozinGoldberg I,Cohen Z. Accumulation of arachidonic acid-rich triacylglycerols in the microalga Parietochloris incisa(trebuxiophyceae,chlorophyta)[J]. Phytochemistry. 2002,60(2):135-143.
[12]Alonso D L,Belarbi E H,RodríguezRuiz J,etal. Acyl lipids of three microalgae[J]. Phytochemistry. 1998,47(8):1473-1481.
[13]Khozin G I,Cohen Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus. Phytochemistry[J]. 2006,67(7):696-701.
[14]Makewicz A,Gribi C,Eichenberger W. Lipids of Ectocarpus fasciculatus(phaeophyceae). Incorporation of[l-14C]oleate and the role of TAG and MGDG in lipid metabolism[J]. Plant Cell Physiol,1997,38(8):952-962.
[15]Yeh K L,Chang J S. Nitrogen starvation strategies and photobioreactor design for enhancing lipid content and lipid production of a newly isolated microalga Chlorella vulgaris ESP-31:Implications for biofuels[J]. Biotechnol,2011,6(1):1358-1366.
[16]Praveenkumar R,Shameera K,Mahalakshmi G,etal. Influence of nutrient deprivations on lipid accumulation in a dominant indigenous microalga Chlorella sp.bum11008:Evaluation for biodiesel production[J]. Biomass and Bioenergy,2012,37(4):60-66.
[17]Li X,Hu H Y,Gan K,etal. Effects of different nitrogen and phosphorus concentrations on the growth,nutriant uptake,and lipid accumulation of a freshwater microalga Scenedesmus sp.[J].Bioresource Technology. 2010,101(14):5494-5500.
[18]Converti A,Casazza A A,Ortiz E Y,etal. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering and Processing. 2009,48(6):1146-1151.
[19]童牧,于水燕,歐陽瓏玲,等. 氮饑餓與磷饑餓促使缺刻緣綠藻花生四烯酸含量增加的比較[J]. 水產學報,2011,35(3):763-773.
[20]Zhekisheva M,Boussiba S,KhozinGoldberg I,etal. Accumulation of oleic acid in Haematococcus pluvialis(Chlorophyceae)under nitrogen starvation or high light is correlated with that of astaxanthin esters[J]. Journal of Phycology,2002,38(2):325-331.
[21]羅夢柳,桑敏,張成武,等. 氮、磷對缺刻緣綠藻生長、總脂及花生四烯酸積累的影響.天然產物的研究與開發[J]. 2010,32(3):378-382.
[22]Reitan K I,Rainuzzo J R,Olsen Y. Effect of nutrient limitation on fatty acid and lipid content of marine microalgae[J].Journal of Phycology,1994,30(6):972-979.
[23]Renaud S M,Thinh L V,Lambrinidis G,etal. Effect of temperature on growth,chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures[J]. Aquaculture,2002,211(1):195-214.
[24]Aaronson S. Effect of incubation temperature on the macromolecular and lipid content of the phytoflagellate Ochromonas danica[J]. Journal of Phycology,1973,9(1):111-113.
[25]Dewaele A,Guyot F,McLarnonRiches C J,etal. Effects of environmental factors and metals on Selenastrum capricornutum lipids. Phytochemistry[J]. 1998,49(5):1241-1247.
[26]Patterson G. Effect of culture temperature on fatty acid composition of Chlorella sorokiniana[J]. Lipids,1970,5(7):597-600.
[27]Takagi M,Yoshida T. Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells[J]. Journal of Bioscience and Bioengineering,2006,101(3):223-226.
[28]Chen G Q,Jiang Y,Chen F. Salt-induced alterations in lipid composition of diatom nitzschia laevis(bacillariophyceae)under heterotrophic culture condition[J]. Journal of Phycology,2008,44(5):1309-1314.
[29]Na L,We D,Jiang X L,etal. Regulation of lipid metabolism in the snow alga Chlamydomonas nivalis in response to NaCl stress:An integrated analysis by cytomic and lipidomic approaches[J]. Biochemistry,2012,47(7):1163-1170.
[30]Guckert J B,Cooksey K E. Triglyceride accumulation and fatty acid profile changes in Chlorella(chlorophyta)during high ph-induced cell cycle inhibition[J]. Journal of Phycology,1990,26(1):72-79.
[31]EinickerLamas M,Mezian G A,Fernandes T B,etal. Euglena gracilis as a model for the study of Cu2+and Zn2+toxicity and accumulation in eukaryotic cells[J]. Environmental Pollution,2002,120(3):779-786.
[32]Liu Z Y,Wang G C,Zhou B C. Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresource Technology,2008,99(11):4717-4722.
[33]廖啟斌,李芊,李文權,等.光輻射對海洋微藻脂肪酸含量的效應[J].海洋技術,2002,21(1):46-48.
[34]繆錦來,王 波,闞光鋒,等. 環境因子對2種南極綠藻脂肪含量和脂肪酸組成的影響[J]. 海洋科學,2005,29(1):4-11.
[35]Srinivas R,Ochs C. Effect of UV-A irradiance on lipid accumulation in Nannochloropsis oculata[J]. Photochemistry and Photobiology. 2012,88(3):684-689.
[36]Skerratt J H,Davidson A D,Nichols P D,etal. Effect of UV-B on lipid content of three antarctic marine phytoplankton[J]. Phytochemistry,1998,49(4):999-1007.
[37]Folch J,Lees M,Sloane-Stanley G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry,1957,226(1):497-509.
[38]Bligh E G,Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology,1959,37(8):106-110.
[39]Merchant S S,Kropat J,Liu B,etal. Chlamydomonas as a reference organism for understanding algal triacylglycerol accumulation[J]. Current Opinion in Biotechnology,2011,23(3):352-363.
[40]Boyle N R,Page M D,Liu B,etal. Three acyltransferases and a nitrogen responsive regulator are implicated in nitrogen starvation-induced triacylglycerol accumulation in Chlamydomonas[J]. The Journal of Biological Chemistry,2012,287(19):15811-15825.
[41]Roessler P G. Purification and characterizatio n of acetyl-coa carboxylase from the Diatom Cyclotella cryptica[J]. Plant Physiology,1990,92(1):73-78.
[42]Harun R,Davidson M,Doyle M,etal. Technoeconomic analysis of an integrated microalgae photobioreactor,biodiesel and biogas production facility[J]. Biomass and Bioenergy,2011,35(1):741-747.
Advances on Microalgae as Sustainable Energy Source for Biodiesel Production
ZHAIYing-xue,LIANGCheng-wei*,ZHANGWei,YUJian-sheng
(Qingdao University of Science And Technology,Qingdao 266042,China)
The global energy crisis has stimulated the need to find alternative energy resources.Microalgae is a promising source of biofuel due to their simple cellular structure,higher growth rate,and higher lipid content than conventional oleaginous vegetable crops. In this article,the strains of microalgae and lipid in microalgae is introduced. Consequently,the factor of lipid accumulation in microalgae,methods of lipid extraction,genetic engineering of microalgae to increase lipid production are elucidated independently. Finally,trends and research areas in microalgae-biodiesel industry are proposed,and the integrated technology will further reduce the cost microalgal lipid production whilst making this process to be economical for the production of biodiesel.
microalgae;energy;biodiesel;comprehensive utilization;triacylglycerols
2013-08-12 *通訊聯系人
翟映雪(1988-),女,碩士研究生,研究方向:微藻生物能源。
國家自然科學基金(31000135);青島市基礎研究項目(11-2-4-3-(5)-jch)。
TS222+.1
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001

