汞在海洋浮游植物中的生物累積和毒性效應
毋 赟,王文雄
1. 中國科學院南海海洋研究所 熱帶海洋生物資源與生態重點實驗室,廣州 510301 2. 香港科技大學生命科學學部 香港九龍清水灣
汞在海洋浮游植物中的生物累積和毒性效應
毋 赟1,王文雄2, *
1. 中國科學院南海海洋研究所 熱帶海洋生物資源與生態重點實驗室,廣州 510301 2. 香港科技大學生命科學學部 香港九龍清水灣
浮游植物是海洋生態系統的主要初級生產者,同時作為食物也是許多水生生物攝取汞的主要途徑。本文綜述了近年來汞在海洋浮游植物中的最新研究進展,包括汞在浮游植物中的吸收、累積規律及其影響因素,汞對浮游植物的毒性效應(生長抑制、光合作用影響)以及生物的適應機制(汞的還原、螯合解毒、礦化固定等),最后對浮游植物中汞累積和毒性的未來研究方向進行了展望。
汞;海洋浮游植物;生物累積;毒性
上世紀以來,隨著工農業(如燃煤發電、冶金、電池工業、造紙業、塑料工業和化肥生產等)的快速發展,大量的含汞污染物經地表徑流、大氣干濕沉降、沿岸直接排放等方式進入海洋。20世紀50年代日本暴發了由于居民食用含有高濃度甲基汞的海產品導致的“水俁病”后,汞污染危害引起了全世界的震驚和廣泛關注,促使人們開展汞在水體中行為及其生態毒理學的研究。
水體中的汞主要以元素汞(Hg0)、二價汞(Hg2+)和甲基汞(MeHg)形態存在。由于元素汞的強揮發性和低生物可利用性,對這種汞形態的研究主要集中于元素地球化學循環領域。在海水中,二價無機汞的濃度遠高于甲基汞,如在河口沿岸地帶,甲基汞只占總汞的小部分(1%~10%),但因為甲基汞具有嚴重的神經毒性,經生物富集和食物鏈傳遞可直接或間接地危害到所有營養級海洋生物以及人類健康[1],故兩者都是生態毒理學研究的主要汞形態(下文無機汞特指二價無機汞)。
浮游植物是一類具有色素或色素體,通過光合作用制造有機物的自養型浮游生物。由于透入海水中的陽光隨深度迅速衰減,浮游植物分布于整個海洋上層,并受營養鹽、溫度、光照等因素影響。海洋浮游植物主要包括原核生物的細菌、藍藻和真核生物,其中,硅藻(diatom)、甲藻(dinoflagellates)和金藻(haptophytes)是海洋大陸架區域的優勢種,也是溫帶和極地的主要赤潮種[2]。作為海洋生態系統的主要初級生產者,浮游植物也是汞進入海洋食物網的主要途徑,它對汞的累積和生理毒性響應制約著整個生態系統的發展,影響著汞在海洋環境以及與之相連的大氣環境中的分布、遷移和轉化。海洋浮游植物具有極強的汞富集能力,通過生物濃縮作用,其汞濃度可達環境濃度的103~106倍[3]。因而開展汞在海洋浮游植物中的吸收、累積、分布、細胞歸趨、轉化等方面的研究,對于理解汞的生物富集和食物鏈傳遞特性、預測汞的毒性水平和生態風險有著至關重要的意義。
近年來,得益于新實驗技術的推廣(如放射性同位素示蹤技術探索金屬生物累積、差速離心法分析金屬亞細胞分布、流式細胞儀技術研究細胞生理生化狀態、汞形態分析技術預測汞的生物形態轉化),人們對于汞在海洋浮游植物中的累積和毒性效應有了更為深入的理解。本文總結近20多年來國內外有關汞在海洋浮游植物中的研究進展,提出該領域研究中存在的問題,希望可以促進該領域的研究。
1 汞在海洋浮游植物中的累積
海洋浮游植物作為水生食物網結構和功能的主要組成部分,同時也是汞沿食物鏈累積和放大過程中最重要的一環,因此在過去幾十年中汞在其中的生物累積一直是一個非常重要的研究領域。有關汞在海洋浮游植物中累積所需解決的關鍵科學問題包括:1)吸收機制;2)累積規律;3)細胞內分布。
1.1 海洋浮游植物吸收汞的基本模式
海洋浮游植物對汞的吸收途徑與其水相化學形態密切相關。天然海水由于具有充足的天然有機質(dissolved organic matter, DOM),無機汞主要以Hg-DOM形態存在,而甲基汞與DOM的結合穩定常數較低(1012.6~1013.6),仍主要以氯化物形態存在[1,4]。有關海洋浮游植物對無機汞和甲基汞的吸收已有不少研究,然而目前對其吸收機制仍無定論。早期的研究認為無機汞和甲基汞都是以具有很強脂溶性的電中性化合物形態存在,因而可能通過被動擴散方式被海洋浮游植物細胞內化。Mason[5]等估算了Thalassiosira weissflogii對于無機汞和甲基汞的細胞膜滲透性(membrane permeability),發現它們與汞化合物辛醇-水分配系數(Kow)的關系很好地符合Stein[6]得到的有機化合物被動擴散經驗公式。但是,無機汞的有機配體形態和甲基汞的氯化物形態具有非常相近的Kow,而無機汞的內化率又比甲基汞低,這樣就很難得出無機汞和甲基汞都是以被動擴散方式進入藻細胞[7-8]。近年來,一些研究者提出甲基汞可以被浮游植物主動吸收。Moye等[9]將兩種綠藻(Selenastrum Capricornutum和Cosmarium botrytis)、一種藍綠藻(Schizothrix calcicola)和一種硅藻(Thalassiosira weissflogii)分別進行光合作用抑制劑(CCCP,DCMU,DNP和百草枯)、γ射線、暗條件等處理,發現四種浮游植物的甲基汞吸收均有顯著降低,即藻類對甲基汞的吸收是一個耗能的過程,涉及主動運輸。這可能是由于甲基汞與半胱氨酸形成的復合物(MeHg-L-cysteine)與蛋氨酸(L-methionine)結構相似,進而被細胞膜上的轉動蛋白錯誤識別和運輸[10]。此外,近來的研究發現無機汞可以Hg-cysteine和β-HgS形態被汞甲基化細菌吸收,而具體吸收機制及是否在浮游植物存在仍需要進一步研究[11-12]。
1.2 海洋浮游植物的汞累積及其主要影響因素
大量的汞累積研究主要通過濾網采集野外浮游植物樣品或收集室內汞暴露后的藻細胞來測定汞的生物濃縮因子(bioconcentration factor, BCF)[13-14]。為了準確預測海洋浮游植物中汞的生物累積,需要深入了解汞累積規律及其影響因素。近十多年來,隨著檢測技術的進步以及放射性同位素標記法等的應用,浮游植物對重金屬汞累積的室內研究取得了較大進展。根據描述金屬在生物體內隨時間的累積動力學模型[15],海洋浮游植物的金屬累積可表示如下:
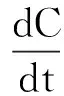
其中C為細胞內的金屬濃度;t為暴露時間; ku為水相吸收常數; Cw為水相金屬濃度; g為生長速率常數; ke為排出速率常數。
一般對于浮游植物, g>> ke[16],上式可簡化為:
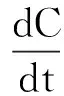
由該模型可知,海洋浮游植物的汞累積由水相吸收和生物生長稀釋(biodilution)共同決定。其中,金屬的水相吸收可通過測定較短時間內的金屬累積,通過線性回歸得到的斜率計算,生長率則通過長期暴露過程中細胞密度的自然對數與時間回歸定量。這兩個參數均受到汞本身形態、生物自身因素、環境因子等多種因素的影響。一方面,水相吸收受到上述幾種因素的影響:將硅藻細胞分別進行短期(3 h)無機汞和甲基汞暴露,發現甲基汞的吸收速率是無機汞的9.2倍[8];水相吸收也與藻細胞大小密切相關,Thalassiosira pseudonana (4~6 μm)由于具有更大的細胞比表面積,較T. weissflogii (一般15 μm)而言對甲基汞的吸收速率更大(0.2 μg·L-1: 36.6 μg·(g·h)-1vs 0.1 μg·L-1: 0.8 μg·(g·h)-1)[4,8];此外,環境因子包括溫度、光照、溶解有機物及其他主要離子(如H+、Cl-)等,可通過改變水相金屬形態、影響浮游植物生理生化過程作用于汞的水相吸收[17]。另一方面,細胞生長同樣受到上述因素的影響:產生同樣生長抑制作用(IC50)所需的無機汞濃度為甲基汞濃度的59~197倍[18];同一種汞形態對不同浮游植物生長的抑制作用差別很大(無機汞在四種海洋浮游植物中的EC50值波動可達103.8)[19];并且金屬對細胞的生長抑制受到環境因子的顯著影響,例如溫度升高增加無機汞對Scenedesmus acutus的生長抑制,而經甲基汞預暴露后的硅藻T. weissflogii對甲基汞的耐受性也顯著提高[20-21]。在業已研究的各種金屬中,無機汞具有較高的水相吸收速率和生物生長抑制能力,因此其在海洋浮游植物中的平均BCF值(105)高于其它金屬,而甲基汞又遠高于無機汞(1~2個數量級)[22-23]。值得注意的是,傳統的觀點認為金屬的吸收率與生物生長率并不存在關聯,而近來的研究指出Cd、Zn等金屬的水相吸收與藻細胞生長率顯著正相關,因此浮游植物的金屬累積取決于水相吸收和生長率的相對變化[24-25]。
1.3 海洋浮游植物中汞的亞細胞分布
浮游植物累積的汞,主要是以與細胞內的可溶性巰基化合物結合、被礦化物固定、與膜結合等形式存在于不同的亞細胞組分或結構,進而改變汞的吸收和累積,最終對整個食物鏈產生影響[26]。目前最常用的定量研究金屬亞細胞分布的方法是五步分離法,通過使用差速離心、熱處理和化學處理,分離得到五個亞細胞組分,包括富金屬礦體(metal-rich granule,MRG)、細胞碎屑(cellular debris,主要是細胞壁、膜結構)、細胞器(organelle,包括線粒體、溶酶體)、熱穩定蛋白(heat-stable protein,HSP,包括植物螯合肽等)和熱變性蛋白(heat-denatured protein,HDP,包括酶等蛋白質)[27-28]。在生態毒理學領域,研究者又根據各部分的生理生態意義,將這五部分劃分為生物非活躍金屬(金屬解毒組分,biological detoxified metal,BDM)、生物活躍相金屬(生物代謝活躍金屬或金屬敏感組分,metal sensitive fraction,MSF)、可沿食物鏈傳遞組分等(圖1)[29-30]。按照這種定義,累積的汞首先進入細胞的代謝活躍相,然后進入解毒相。

圖1 五種亞細胞組分Fig. 1 Five subcellular fractions
根據上述方法,Wu和Wang[8]結合放射性同位素示蹤技術測定了汞在海洋浮游植物中的亞細胞分布:經過72 h無機汞暴露,硅藻T. pseudonana中高達38%~56%的細胞內汞結合在細胞碎屑部分,而在綠藻Chlorella autotrophica和金藻Isochrysis galbana中,更多汞被分布在熱穩定蛋白組分(> 67%)。不同于無機汞,與熱穩定蛋白結合是甲基汞在所有三種海洋浮游植物中的最主要儲存方式(> 44%)。結果表明,汞的亞細胞分布受其自身形態和生物種類的影響,細胞碎屑是無機汞在海洋浮游植物中的重要存儲位點,而熱穩定蛋白對于無機汞和甲基汞而言都是重要的結合組分。在這項研究中,亞細胞金屬也被探索用于預測汞的生物毒性。汞的生物毒性具有物種特異性,不同浮游植物用IC50表達金屬毒性的差別為1.8倍,而無機汞和甲基汞分別用HSP/BDM和organalles/MSF/MRG中濃度表達時,汞的種間毒性差異最小(1.4倍和1.6倍),說明汞的亞細胞分布與金屬毒性密切相關,可以很好地解釋或預測汞的毒性。然而,金屬在不同亞細胞組分的分布并不是處于靜止或平衡狀態,而是不斷變化的。Ng和Wang[26]對貽貝的研究結果表明:開始暴露時Cd、Ag和Zn的吸收速率與其在熱敏感蛋白中的分布呈正相關,隨著暴露時間的延長,金屬從金屬敏感組分再分配到熱穩定蛋白組分,且金屬從這些亞細胞組分排出的速率也不相同。目前還沒有研究報道汞在海洋浮游植物中亞細胞分布的動力學變化,以及這種變化在汞的生物累積、毒性效應中所起的作用。
2 汞對海洋浮游植物的毒性效應
汞的毒理學研究已有很長的歷史。已有的研究表明汞對海洋浮游植物的生理毒性效應具有非特異性:汞對巰基(—SH)有很強的親和力,通過與酶等蛋白質中的—SH結合,可導致酶活喪失、蛋白質變性、DNA結構改變等;汞也會取代必需金屬(如葉綠素中心原子Mg)、誘導細胞內活性自由基產生(如H2O2等),導致蛋白質功能改變、膜脂過氧化、DNA損傷等[31-33]。分子生化水平的毒性表現在細胞、個體水平,即為葉綠素含量降低、光合系統損傷、代謝過程紊亂、生長發育受阻、細胞膜結構破壞甚至衰老死亡[34-35],其中生物生長與光合作用參數由于生態意義重大且方便易測,是目前最常使用的毒理學測試指標。
2.1 汞對海洋浮游植物的生長抑制效應
海洋浮游植物由于其廣泛存在性和生態重要性,被美國材料與試驗協會(American Society for Testing and Materials)作為評價污染物毒性水平的模式生物[36]。從1970s以來,大量的毒性測試以生長抑制的50%劑量(IC50)為效應終端,研究了汞對海洋浮游植物的急性毒性效應[5,18,37-38]。在之前的研究中,細胞密度的測定主要采用血球計數板或庫爾特粒度儀(Coulter counter),然而,這些方法將進行生長試驗的所有藻細胞個體行為等同于其所表現出來的種群生長行為,忽視了污染物可能對浮游植物生長抑制影響方式的不同[39-40]:導致細胞死亡或抑制細胞分裂。2012年,Wu等[41]通過引入熒光染色和流式細胞儀分析技術,將活細胞和死亡細胞區分開來,揭示了無機汞和甲基汞對生長率抑制的不同作用方式:無機汞暴露導致T. weissflogii分化為兩個亞種群,一個亞種群的細胞膜結構遭到破壞,細胞死亡,另一個亞種群的生長則未受到抑制。而甲基汞的暴露并未導致種群的分化,所有細胞具有相似的分裂速率,但與對照組相比顯著降低[41]。這種現象的一種可能解釋是不同的汞形態具有不同的作用位點:無機汞主要作用于原生質的細胞膜,而甲基汞則主要破壞細胞質組織的完整性和影響新陳代謝,這也與它們的亞細胞分布模式相一致。
2.2 汞對海洋浮游植物光合作用的影響
光合作用是地球上最重要的一種能量轉化過程,海洋浮游植物的光合作用維系著整個生態系統的正常運轉,因此也是研究最多的污染物毒性效應指標。汞對海洋浮游植物光合作用的影響主要表現在:1)干擾葉綠素的合成,破壞葉綠體膜結構。經無機汞和甲基汞處理后,硅藻T. weissflogii的葉綠素含量顯著降低[41]。汞使葉綠素含量下降原因可能有二:一是它抑制原葉綠素酸酯酶活性、影響氨基-γ-酮戊酸的合成,直接干擾葉綠素的生物合成[42-43];二是作用于葉綠體膜,破壞了葉綠體的完整結構。2)抑制光合電子傳遞鏈。目前大多數研究通過使用脈沖調制葉綠素熒光儀(pulse-amplitude-modulated fluorescence,PAM),報道了無機汞在光合電子傳遞過程中的作用位點:包括光合系統II(photosystem II,PSII)的電子供體端、電子受體端、PSII反應中心蛋白,光合系統I(photosystem I,PSI)的電子供體端、電子受體端、PSI反應中心,還有類囊體膜上的捕光復合物II[44-48]。這些研究結果說明無機汞的抑制是多位點、全電子傳遞鏈的。而有關甲基汞對光合電子傳遞作用的研究較少,有研究認為甲基汞影響PSII電子受體端、PSII反應中心D1蛋白[49-50]。PAM測定雖然具有生物學上的意義,卻耗時且并不靈敏,不能準確反映金屬對細胞的毒性效應。近年來,一種更為快捷靈敏、可視化的方法,即雙光子激發熒光壽命成像技術(two-photon excitation fluorescence lifetime imaging microscopy)被初步嘗試運用于估測污染物的光合毒性[51-52]。利用這種技術,Wu等[41]比較了無機汞和甲基汞對T. weissflogii全電子傳遞鏈的影響,發現無機汞在最低無抑制濃度(no observed effect concentration)時即可導致非光化學淬滅增加,葉綠素熒光壽命延長,證明了無機汞對光合電子傳遞的抑制作用;而甲基汞即使在細胞完全不能生長的濃度下對葉綠素的熒光壽命也并無影響,即甲基汞與無機汞的光合作用位點并不相同。這同樣可能是由于膜結構是無機汞細胞內的主要分布位置和作用位點,因而類囊體膜上的電子傳遞鏈更易被無機汞顯著影響。
2.3 海洋浮游植物對汞的生理生化耐受機制
為適應環境中不斷升高的汞濃度,生物在長期進化過程中形成了獨特的汞耐受機制。目前,對于海洋浮游植物的汞適應途徑和機制的了解主要受細菌和高等植物研究的啟發,包括濃度(減少汞累積)和形態(生物轉化、胞內隔離)的調控。前者通過減少汞吸收和增加汞排出實現,后者則是通過生物螯合、固定、隔離等方式降低汞的生物毒性。海洋浮游植物細胞對汞的生理生化耐受機制如圖2所示。
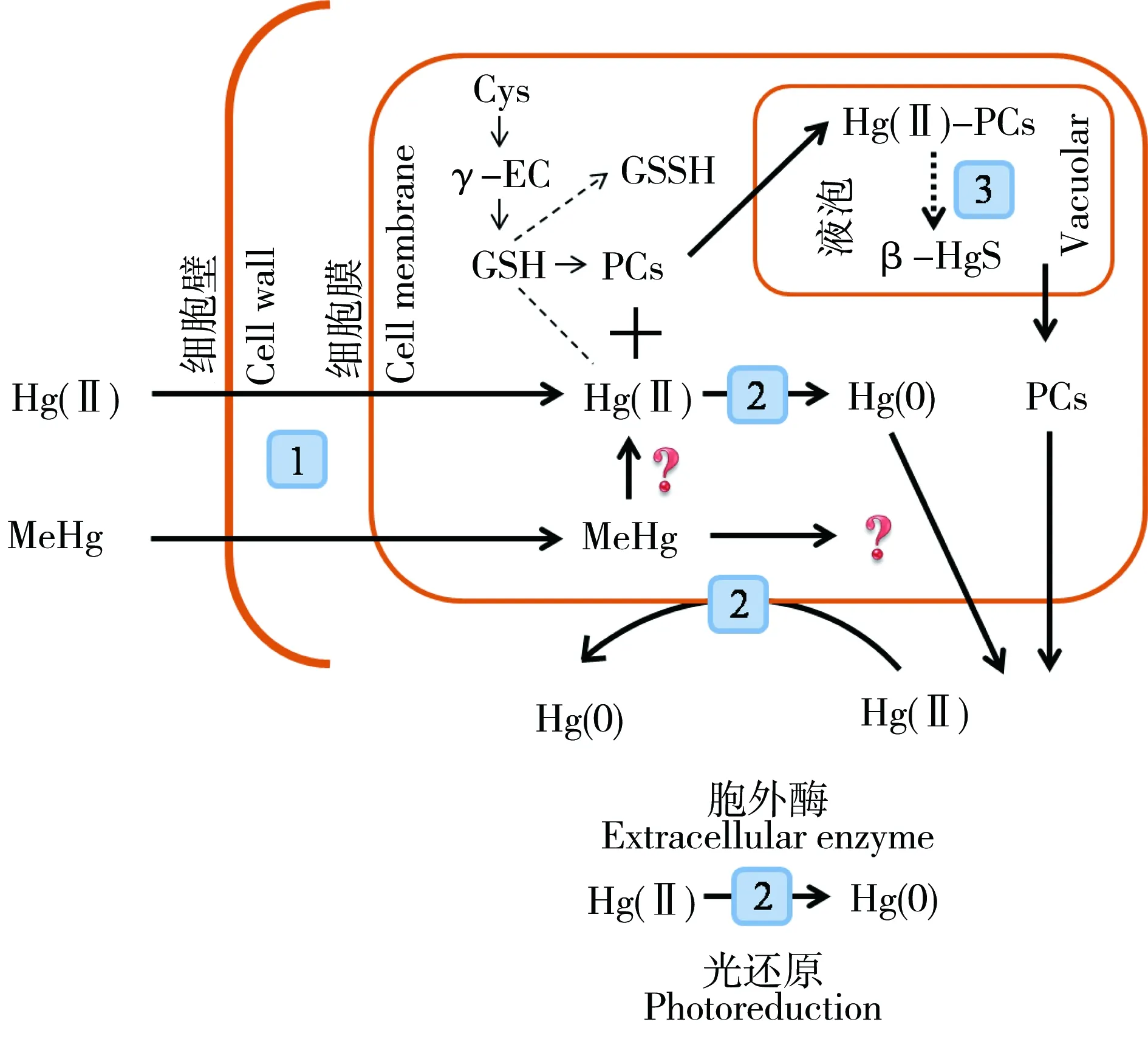
圖2 海洋浮游植物對汞的生理生化適應機制:1)汞吸收進入藻細胞;2)細胞外、細胞內、細胞膜上酶催化的二價無機汞還原;3)無機汞被巰基固定并進一步形成β-HgSFig. 2 the adaptation of marine phytoplankton to environmental mercury: 1) mercury uptake into algal cells; 2) enzymatically mediated Hg(II) reduction; 3) β-HgS formation via-SH complex
在汞的生物地球化學循環研究中,人們很早就發現了表面水的溶解性氣態汞(dissolved gaseous mercury,DGM,主要為元素汞)揮發是一種重要的汞的自然來源。Mason和Sheu[53]評估了海洋在全球汞循環中的作用,指出每年從海洋揮發進入大氣的汞與人為過程排放的汞大致相當。早期的研究認為這種DGM的產生主要是光化學反應和細菌活動共同作用的結果。1975年,Ben-Bassat和Mayer[54]首次證實了綠藻Chlorella暴露于μmol·L-1無機汞能夠產生DGM,隨后的大量現場調查和室內試驗均證實,真核藻類可以將二價無機汞還原為低毒、高揮發性的DGM,從而降低無機汞的生物可利用性[55-56]。Wu和Wang[57]在最新的一篇文章中系統地研究了不同浮游植物種類(T. weissflogii、C. autotrophica和I. galbana)的汞還原能力。通過測定暗處理十分鐘內產生的元素汞,他們發現所研究的三種海洋浮游植物都能夠將無機汞轉化為DGM,且轉化能力隨汞濃度的升高而增加,但一般小于添加無機汞濃度的5% d-1。使用間接評估法(質量平衡法)進一步證實了這一結論:72 h內產生的DGM不超過添加無機汞濃度的30%。無機汞被藻類轉化的可能機制包括胞外分泌酶、細胞表面酶過程和胞內還原過程等。對于甲基汞,一些汞耐受細菌可以利用有機汞裂解酶將甲基汞的C-Hg鍵切斷,再對生成的無機汞進行還原解毒[58],然而這種甲基汞的轉化途徑目前尚未在真核浮游植物中發現。此外,汞也可通過影響細胞膜上的磷脂改變細胞膜的通透性,進而改變汞的吸收和排出[59]。
汞進入細胞后,可誘導一類富含半胱氨酸(cysteine,Cys)的多肽—植物螯合肽(phytochelatins,PCs)的合成。PCs的主要作用是維持細胞內必需金屬平衡和緩解非必需金屬毒性[60]。此外,PCs還可作為胞外分泌物改變水相的重金屬形態,進而影響重金屬的生物可利用性[61]。PCs于1985年最先在Cd處理過的印度蘿芙木(Rauvolfia serpentina)懸浮培養細胞中被發現,其結構通式為 (γ-Glu-Cys)n-Gly (n=2~11)[62]。現在較為普遍的PCs測定方法是使用monobromobimane熒光標記-HPLC分離檢測。之前的研究早已發現,無機汞可以誘導浮游植物中PCs的合成[63]。Wu和Wang[8]結合汞的累積動力學,全面研究了浮游植物中PCs的誘導規律,特別是對比了無機汞和甲基汞的差異:無機汞的PCs誘導是一個非常靈敏的過程,將T. weissflogii暴露于1.1 μmol·L-1無機汞,30 min 后即可檢測到PC2-3及其前體化合物Cys、谷氨酰半胱氨酸(γ-EC)的顯著誘導,12 h后又發現了PC4的合成,符合PCs的合成機制(PCn以PCn-1為底物進行肽鏈延伸)。甲基汞對PCs的誘導能力遠低于無機汞,與無機汞產生相同生長抑制作用(40%)的甲基汞濃度(23 n mol·L-196 h只能夠顯著誘導GSH的合成,而另一項研究將T. weissflogii暴露于2 n mol·L-1甲基汞18 d后也只檢測到PC2的誘導響應[21]。這可能是由兩方面原因導致:一是甲基汞只能與一個PCs-SH結合,其強度低于無機汞與兩個-SH的結合;二是甲基汞只能通過去甲基化產生的無機汞間接誘導PCs的生物合成[64]。因而依照所測得的PCs濃度和汞生物累積濃度,只估計了無機汞的細胞歸趨:T. weissflogii 96 h暴露期內,PC-SH : 細胞內汞為0.1~0.3,遠低于胞外的飽和結合比2;三種海洋浮游植物的研究中也發現Hg-PCs復合物占細胞累積汞濃度< 20%,說明無機汞的生物解毒過程中還存在其他機制或者PCs復合物只是汞解毒過程中的中間形態[57]。
金屬與PCs結合形成的低分子量復合物,可在液泡膜金屬轉運蛋白的作用下,進入液泡形成高分子量巰基復合物,并與液泡內的金屬(獨立進入液泡)、硫(H2S形成)作用最終被生物礦化固定[65]。早期的研究揭示了CdS晶體的存在,但由于檢測方法的限制,有關汞的生物礦化作用并不明了,其在汞的生物解毒過程中的相對重要性也并不知曉。近幾年,Kelly等[66]改進了無機汞的傳統冷原子熒光檢測法,發現堿還原可以檢測除有機汞外的所有汞形態,而酸還原則無法檢測有機汞和β-HgS,利用這兩種測定方法的差值,他們首次定量了浮游植物中的β-HgS化合物,并認為這是實驗室培養的原核和真核藻細胞內汞存在的主要形態(20%~90%)。Carrasco-Gil等[67]又通過擴展X射線吸收精細結構譜(Extended X-ray Absorption Fine Structure,EXAFS),證實了β-HgS在從汞污染土壤中采集的Horehound組織中的大量存在(28%~55%)。在此基礎上,Wu和Wang[57]研究了無機汞在幾種海洋浮游植物中的生物轉化,同樣發現β-HgS是藻細胞內最主要的汞累積形態(20%~90%),且β-HgS占細胞內累積汞的比例與藻細胞生長率抑制呈負相關關系,由此說明合成β-HgS是浮游植物適應無機汞脅迫的重要機制。大量的β-HgS形成也與之前所述的無機汞的亞細胞分布相一致,因為β-HgS可在細胞壁上形成單晶或多晶顆粒,經五步分離法后進入細胞壁所在的細胞碎屑,故細胞碎屑是無機汞結合的主要亞細胞組分。酸堿還原法測定汞的礦化作用目前剛剛起步,由于缺乏純化步驟,可能高估β-HgS的作用(包含一些低分子量巰基化合物),有待技術的進一步提高,有條件的話可以使用較為昂貴的EXAFS法。而有關甲基汞最終能否轉化為硫化物晶體的研究目前尚屬空白。
3 總結與展望
汞是少數具有生物放大能力的金屬,但一般認為無機汞不會被生物放大,而甲基汞則存在生物放大現象[68]。對海洋浮游植物的研究從食物鏈底端生物對不同汞形態的食物鏈傳遞差異提供了一定解釋:1)甲基汞比無機汞更容易在海洋浮游植物中累積(甲基汞的水相吸收遠高于無機汞,相同濃度下對浮游植物的生長抑制能力更強);2)甲基汞比無機汞更多地分布在可沿食物鏈傳遞部分,具有較大的食物鏈放大潛能。3)汞的食物鏈傳遞受浮游植物種類、密度影響[69-70]。但是,目前對汞在海洋浮游植物中研究的系統性和全面性都有待加強,今后應從以下幾個方向深入開展:
(1)汞在海洋浮游植物中的累積規律。前人對浮游植物的汞累積在實驗室和野外都做了大量的工作,但仍然缺乏汞水相吸收和生物生長速率這兩個決定汞累積的重要動力學參數方面的研究。
(2)浮游植物致毒汞水平的研究。目前的研究認為金屬的毒性不僅決定于其生物累積量,也取決于其亞細胞分布[71-72],如何有效地結合這些理論和方法評估汞的毒性仍是一個很大的挑戰。
(3)汞在海洋浮游植物體內的轉化及對食物鏈高營養級生物的影響。汞在細菌細胞內的生物轉化研究較多,而在海洋浮游植物中的研究尚處于起步階段,且其轉化機理仍不明確。
(4)室內模擬實驗與現場觀測試驗的有機結合。目前有關浮游植物對汞累積和毒性響應的研究,多在實驗室內進行,處理時間較短、暴露濃度較高,在今后的工作中有必要加強真實環境濃度條件下汞對海洋浮游植物的長期效應研究。
另外,在海洋污染日趨嚴重的情況下,僅僅從單一汞污染研究得到的結論并不能解決我們遇到的實際問題,復合污染下汞的累積和毒性研究將成為生態毒理學領域的一個重要課題。
[1] Fitzgerald W F, Lamborg C H, Hammerschmidt C R. Marine biogeochemical cycling of mercury [J]. Chemical Reviews, 2007, 107(2): 641-662
[2] Simon N, Cras A L, Foulon E, et al. Diversity and evolution of marine phytoplankton [J]. Comptes Rendus Biologies, 2009, 332(2-3): 159-170
[3] Pickhardt P C, Fisher N S. Accumulation of inorganic and methylmercury by freshwater phytoplankton in two contrasting water bodies [J]. Environmental Science & Technology, 2007, 41(1): 125-131
[4] Zhong H, Wang W X. Controls of dissolved organic matter and chloride on mercury uptake by a marine diatom [J]. Environmental Science & Technology, 2009, 43(23): 8998-9003
[5] Mason R P, Reinfelder J R, Morel F M M. Uptake, toxicity, and trophic transfer of mercury in a coastal diatom [J]. Environmental Science & Technology, 1996, 30(6): 1835-1845
[6] Stein W. Transport and Diffusion Across Cell Membranes [M]. Elsevier, 1986: 1-68
[7] Benoit J M, Mason R P, Gilmour C C, et al. Constants for mercury binding by dissolved organic matter isolates from the Florida Everglades [J]. Geochimica et Cosmochimica Acta, 2001, 65(24): 4445-4451
[8] Wu Y, Wang W X. Thiol compounds induction kinetics in marine phytoplankton during and after mercury exposure [J]. Journal of Hazardous Materials, 2012, 217: 271-278
[9] Moye H A, Miles C J, Phlips E J, et al. Kinetics and uptake mechanisms for monomethylmercury between freshwater algae and water [J]. Environmental Science & Technology, 2002, 36(16): 3550-3555
[10] Yin Z, Jiang H, Syversen T, et al. The methylmercury-l-cysteine conjugate is a substrate for the L-type large neutral amino acid transporter [J]. Journal of Neurochemistry, 2008, 107(4): 1083-1090
[11] Schaefer J K, Morel F M M. High methylation rates of mercury bound to cysteine by Geobacter sulfurreducens [J]. Nature Geoscience, 2009, 2(2): 123-126
[12] Graham A M, Aiken G R, Gilmour C C. Dissolved organic matter enhances microbial mercury methylation under sulfidic conditions [J]. Environmental Science & Technology, 2012, 46(5): 2715-2723
[13] Di Beneditto A P M, Bittar V T, Camargo P B, et al. Mercury and nitrogen isotope in a marine species from a tropical coastal food web [J]. Archives of Environmental Contamination and Toxicology, 2012, 62(2): 264-271
[14] Mason R P, Choi A L, Fitzgerald W F, et al. Mercury biogeochemical cycling in the ocean and policy implications [J]. Environmental Research, 2012, 119: 101-117
[15] Luoma S N, Rainbow P S. Why is metal bioaccumulation so variable? biodynamics as a unifying concept [J]. Environmental Science & Technology, 2005, 39(7): 1921-1931
[16] Sunda W G, Huntsman S A. Processes regulating cellular metal accumulation and physiological effects: phytoplankton as model systems [J]. Science of the Total Environment, 1998, 219(2): 165-181
[17] Luengen A C, Fisher N S, Bergamaschi B A. Dissolved organic matter reduces algal accumulation of methylmercury [J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1712-1719
[18] Wu Y, Wang W X. Accumulation, subcellular distribution and toxicity of inorganic mercury and methylmercury in marine phytoplankton [J]. Environmental Pollution, 2011, 159(10): 3097-3105
[19] Fisher N S, Bohe M, Teyssie J L. Accumulation and toxicity of Cd, Zn, Ag, and Hg in four marine phytoplankters [J]. Marine Ecology Progress Series, 1984, 19(3): 201-213
[20] Huisman J, Ten Hoopen H J G, Fuchs A. The effect of temperature upon the toxicity of mercuric chloride to Scenedesmus acutus [J]. Environmental Pollution Series A, Ecological and Biological, 1980, 22(2): 133-148
[21] Wu Y, Wang W X. Differential acclimation of a marine diatom to inorganic mercury and methylmercury exposure [J]. Aquatic Toxicology, 2013, 138: 52-59
[22] 王文雄. 微量金屬生態毒理學和生物地球化學[M]. 科學出版社, 2011: 120-121
[23] IAEA (International Atomic Energy Agency). Sediment distribution coefficients and concentration factors for biota in the marine environment [J]. Technical Report Series, 2004, No. 422
[24] Miao A J, Wang W X. Relationships between cell-specific growth rate and uptake rate of cadmium and zinc by a coastal diatom [J]. Marine Ecology Progress Series, 2004, 275: 103-113
[25] Wang W X, Dei R C H, Hong H. Seasonal study on the Cd, Se, and Zn uptake by natural coastal phytoplankton assemblages [J]. Environmental Toxicology and Chemistry, 2005, 24(1): 161-169
[26] Ng T Y, Wang W X. Dynamics of metal subcellular distribution and its relationship with metal uptake in marine mussels [J]. Environmental Toxicology and Chemistry, 2005, 24(9): 2365-2372
[27] Wallace W G, Lee B G, Luoma S N. Subcellular compartmentalization of Cd and Zn in two bivalves. I. significance of metal-sensitive fractions (MSF) and biologically detoxified metal (BDM) [J]. Marine Ecology Progress Series, 2003, 249: 183-197
[28] Lavoie M, Bernier J, Fortin C, et al. Cell homogenization and subcellular fractionation in two phytoplanktonic algae: Implications for the assessment of metal subcellular distributions [J]. Limnology and Oceanography: Methods, 2009, 7: 277-286
[29] Lavoie M, Le Faucheur S, Fortin C, et al. Cadmium detoxification strategies in two phytoplankton species: Metal binding by newly synthesized thiolated peptides and metal sequestration in granules [J]. Aquatic Toxicology, 2009, 92(2): 65-75
[30] Rainbow P S. Trace metal concentrations in aquatic invertebrates: Why and so what [J]. Environmental Pollution, 2002, 120(3): 497-507
[31] Nahar S, Tajmir-Riahi H A. Do metal ions alter the protein secondary structure of a light-harvesting complex of thylakoid membranes? [J]. Journal of Inorganic Biochemistry, 1995, 58(3): 223-234
[32] Satoh M, Matsumoto Y. Mercury-induced oxidative stress in marine phytoplankton Tetraselmis tetrathele (Prasinophyceae) [J]. Natural Science Research, Faculty of Integrated Arts and Sciences, The University of Tokushima, 2008, 22: 57-63
[33] Patra M, Sharma A. Mercury toxicity in plants [J]. The Botanical Review, 2000, 66(3): 379-422
[34] Graevskaya E E, Antal T K, Matorin D N, et al. Evaluation of diatomea algae Thalassiosira weissflogii sensitivity to chloride mercury and methylmercury by chlorophyll fluorescence analysis [C]. Journal de Physique IV (Proceedings), EDP sciences, 2003, 107: 569-572
[35] Singh D P, Khare P, Bisen P S. Effect of Ni2+, Hg2+and Cu2+on growth, oxygen evolution and photosynthetic electron transport in Cylindrospermum IU 942 [J]. Journal of Plant Physiology, 1989, 134(4): 406-412
[36] ASTM. Standard Guide for Conducting Static Toxicity Tests with Microalgae [S]. American Society for Testing and Materials, Philadelphia, PA, 2004, ASTM standard No. E1218-04
[37] Nuzzi R. Toxicity of mercury to phytoplankton [J]. Nature, 1972: 38-40
[39] Wiacek C, Müller S, Benndorf D. A cytomic approach reveals population heterogeneity of Cupriavidus necator in response to harmful phenol concentrations [J]. Proteomics, 2006, 6(22): 5983-5994
[40] Czechowska K, van der Meer J R. A flow cytometry based oligotrophic pollutant exposure test to detect bacterial growth inhibition and cell injury [J]. Environmental Science & Technology, 2011, 45(13): 5820-5827
[41] Wu Y, Zeng Y, Qu J Y, et al. Mercury effects on Thalassiosira weissflogii: Applications of two-photon excitation chlorophyll fluorescence lifetime imaging and flow cytometry [J]. Aquatic Toxicology, 2012, 110: 133-140
[42] Lenti K, Fodor F, B?ddi B. Mercury inhibits the activity of the NADPH: Protochlorophyllide oxidoreductase (POR) [J]. Photosynthetica, 2002, 40(1): 145-151
[43] Gupta P, Jain M, Sarangthem J, et al. Inhibition of 5-aminolevulinic acid dehydratase by mercury in excised greening maize leaf segments [J]. Plant Physiology and Biochemistry, 2013, 62: 63-69
[44] Bernier M, Popovic R, Carpentier R. Mercury inhibition at the donor side of photosystem II is reversed by chloride [J]. FEBS Letters, 1993, 321(1): 19-23
[45] Prokowski Z. Effects of HgCl2on long-lived delayed luminescence in Scenedesmus quadricauda [J]. Photosynthetica, 1993, 28
[46] Murthy S D S, Mohanty N, Mohanty P. Prolonged incubation with low concentrations of mercury alters energy transfer and chlorophyll (Chl) a protein complexes in Synechococcus 6301: Changes in Chl a absorption and emission characteristics and loss of the F695 emission band [J]. Biometals, 1995, 8(3): 237-242
[47] Mi H, Klughammer C, Schreiber U. Light-induced dynamic changes of NADPH fluorescence in Synechocystis PCC 6803 and its ndhB-defective mutant M55 [J]. Plant and Cell Physiology, 2000, 41(10): 1129-1135
[49] Antal T K, Graevskaya E E, Matorin D N, et al. Assessment of the effects of methylmercury and copper ions on primary processes of photosynthesis in green microalga Chlamydomonas moewusii by analysis of the kinetic curves of variable chlorophyll fluorescence [J]. Biophysics, 2009, 54(4): 481-485
[50] Matorin D N, Osipov V A, Seifullina N K, et al. Increased toxic effect of methylmercury on Chlorella vulgaris under high light and cold stress conditions [J]. Microbiology, 2009, 78(3): 321-327
[51] Broess K, Borst J, Amerongen H. Applying two-photon excitation fluorescence lifetime imaging microscopy to study photosynthesis in plant leaves [J]. Photosynthesis Research, 2009, 100(2): 89-96
[52] Zeng Y, Wu Y, Li, D, et al. Two-photon excitation chlorophyll fluorescence lifetime imaging: A rapid and noninvasive method for in vivo assessment of cadmium toxicity in a marine diatom Thalassiosira weissflogii [J]. Planta, 2012, 236(5): 1653-1663
[53] Mason R P, Sheu G. Role of the ocean in the global mercury cycle [J]. Global Biogeochemical Cycles, 2002, 16(4): 40-41
[54] Ben-Bassat D, Mayer A M. Volatilization of mercury by algae [J]. Physiologia Plantarum, 1975, 33(2): 128-132
[55] Mason R P, Morel F M M, Hemond H F. The Role of Microorganisms in Elemental Mercury Formation in Natural Waters [M]. Mercury as a Global Pollutant. Springer Netherlands, 1995: 775-787
[56] Morelli E, Ferrara R, Bellini B, et al. Changes in the non-protein thiol pool and production of dissolved gaseous mercury in the marine diatom Thalassiosira weissflogii under mercury exposure [J]. Science of the Total Environment, 2009, 408(2): 286-293
[57] Wu Y, Wang W-X. Intracellular speciation and transformation of inorganic mercury in marine phytoplankton [J]. Aquatic Toxicology, 2014, 148: 122-129.
[58] Robinson J B, Tuovinen O H. Mechanisms of microbial resistance and detoxification of mercury and organomercury compounds: Physiological, biochemical, and genetic analyses [J]. Microbiological Reviews, 1984, 48(2): 95
[59] Vallee B L, Ulmer D D. Biochemical effects of mercury, cadmium, and lead [J]. Annual Review of Biochemistry, 1972, 41(1): 91-128
[60] Kneer R, Zenk M H. The formation of Cd-phytochelatin complexes in plant cell cultures [J]. Phytochemistry, 1997, 44(1): 69-74
[61] Lee J G, Ahner B A, Morel F M M. Export of cadmium and phytochelatin by the marine diatom Thalassiosira weissflogii [J]. Environmental science & technology, 1996, 30(6): 1814-1821
[62] Grill E, Winnacker E L, Zenk M H. Phytochelatins: The principal heavy-metal complexing peptides of higher plants [J]. Science, 1985, 230(4726): 674-676
[63] Ahner B A, Morel F M M. Phytochelatin production in marine algae. 2. induction by various metals [J]. Limnology and Oceanography, 1995, 40: 658
[64] Krupp E M, Mestrot A, Wielgus J, et al. The molecular form of mercury in biota: Identification of novel mercury peptide complexes in plants [J]. Chemical Communications, 2009(28): 4257-4259
[65] Aiking H, Govers H, Van't Riet J. Detoxification of mercury, cadmium, and lead in Klebsiella aerogenes NCTC 418 growing in continuous culture [J]. Applied and Environmental Microbiology, 1985, 50(5): 1262-1267
[66] Kelly D, Budd K, Lefebvre D D. Mercury analysis of acid- and alkaline-reduced biological samples: identification of meta-cinnabar as the major biotransformed compound in algae [J]. Applied and Environmental Microbiology, 2006, 72(1): 361-367
[67] Carrasco-Gil S, Siebner H, LeDuc D L, et al. Mercury localization and speciation in plants grown hydroponically or in a natural environment [J]. Environmental Science & Technology, 2013, 47(7): 3082-3090
[68] Wang W X. Interactions of trace metals and different marine food chains [J]. Marine Ecology Progress Series, 2002, 243: 295-309
[69] Chen C, Kamman N, Williams J, et al. Spatial and temporal variation in mercury bioaccumulation by zooplankton in Lake Champlain (North America) [J]. Environmental Pollution, 2012, 161: 343-349
[70] Faucheur S L, Campbell P G C, Fortin C, et al. Interactions between mercury and phytoplankton: Speciation, bioavailability and internal handling [J]. Environmental Toxicology and Chemistry, 2013
[71] Di Toro D M, Allen H E, Bergman H L, et al. Biotic ligand model of the acute toxicity of metals. 1. Technical basis [J]. Environmental Toxicology and Chemistry, 2001, 20(10): 2383-2396
[72] Wang M, Wang W-X. Cadmium toxicity in a marine diatom as predicted by the cellular metal sensitive fraction [J]. Environmental Science & Technology, 2008, 42(3): 940-946
◆
BioaccumulationandToxicityofMercuryinMarinePhytoplankton
Wu Yun1, Wang Wenxiong2,*
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, Chinese Academy of Sciences, Guangzhou 510301, China2. Division of Life Science, The Hong Kong University of Science and Technology, Clear Water Bay, Kowloon, Hong Kong, China
7 May 2014accepted16 June 2014
Phytoplankton is the primary producer of marine ecosystem, and are also a source of mercury accumulation in many aquatic animals. This paper reviews the accumulation, toxicity and transformation of two major mercury species (inorganic mercury and methylmercury) in marine phytoplankton. Based on the biokinetic model, mercury accumulation in phytoplankton is a combined result of mercury uptake and growth dilution, which are dependent on the algal species, metal speciation and environmental factors. Accumulated mercury is then transported into different subcellular pools where mercury may produce toxicity or be detoxified by biotransformation (including mercury reduction, chelation and mineralization). Finally, perspectives for future research in the area of mercury-phytoplankton interactions are discussed.
mercury; marine phytoplankton; bioaccumulation; toxicity
國家重點基礎研究發展計劃(No. 2013CB430004)
毋赟(1987-),女,博士,助理研究員,研究方向為生態毒理學,E-mail: lanzhihe322@gmail.com;
*通訊作者(Corresponding author),E-mail: wwang@ust.hk
10.7524/AJE.1673-5897-20140507002
2014-05-07錄用日期:2014-06-16
1673-5897(2014)5-810-09
: X171.5
: A
王文雄(1965—),講座教授,長期從事金屬生態毒理學研究。已發表SCI論文300多篇。
毋 赟, 王文雄. 汞在海洋浮游植物中的生物累積和毒性效應[J]. 生態毒理學報,2014, 9(5): 810-918
Wu Y, Wang W X. Bioaccumulation and toxicity of mercury in marine phytoplankton [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 810-918 (in Chinese)

