黃色肉芽腫性膽囊炎的MRI特征
馬光慧,嵇鳴,葉春濤,肖立,韓鄲
黃色肉芽腫性膽囊炎(xanthogranulomatous cholecystitis,XGC)是一種臨床少見、良性但呈侵襲性生長的膽囊慢性炎性疾病。Christensen和Ishak于1970年首次報道了該病,1976年,Mccoy將其正式命名[1]。XGC術前診斷困難,難以和膽囊癌鑒別,而影像學檢查是重要的術前診斷方法,但目前國內外有關黃色肉芽腫性膽囊炎的CT表現報道相對較多,而MRI方面的文獻相對較少。筆者搜集2011年1月至2013年11月期間經病理證實黃色肉芽腫性膽囊炎8例,參考相關文獻探討MRI對黃色肉芽腫性膽囊炎的診斷價值。
1 材料與方法
1.1 一般資料
回顧性分析均行MRI檢查并經手術、病理證實的8例患者中男5例,女3例,年齡27~66歲。6例患者有不同程度的右上腹反復疼痛癥狀,臨床表現類似于一般的膽囊炎,其中,4例墨菲征(+),3例伴有肩背部放射痛,畏寒、發熱,2例伴有腹脹、惡心、嘔吐、食欲不振,1例發生黃疸,2例糖類抗原CA19-9明顯升高。2例無明顯癥狀。術前6例誤診為膽囊癌。
1.2 設備及方法
采用Siemens Verio 3.0T MR掃描儀,體部相控陣線圈,檢查序列包括常規二維快速小角度激發成像T1WI序列,TR 140ms,TE 4.1 ms;采用快速自旋回波序列的T2WI,TR 4.4 ms,TE 64.0ms。應用空間預飽和技術,常規橫斷面、冠狀面掃描和脂肪抑制序列,層厚7 mm,一次屏氣獲得16~20層圖像。動態增強采用VIBE序列(TR 3.4 ms,TE 1.2 ms,矩陣179×256,層厚2 mm,掃描時間21 s),磁共振對比劑為Gd-DTPA,按0.2 ml/kg計算總量,注射速率2 ml/s,以注射藥物開始計算,延遲15~20s開始動脈期圖像采集,45~60s采集門靜脈期圖像,3~5 min采集延遲期圖像。檢查前,所有患者均已行常規胃腸道準備。
2 結果
2.1 MRI表現
平掃:膽囊增大5例,縮小3例;8例膽囊壁均增厚,增厚范圍5~30mm不等;6例表現為彌漫性增厚,2例表現為局限性增厚。增厚的膽囊壁可致囊腔明顯狹窄,但均未見閉塞;增厚的膽囊壁內見多發大小不一的長T1、長T2結節灶,邊界較清;膽囊內外壁均較光整,6例膽囊周圍邊界欠清,與鄰近肝實質分界不清;8例膽囊內見低信號的結石影,2例膽總管內見小的結石影。1例與胰頭分界不清,6例與鄰近腸管黏連。增強掃描:增強動脈期膽囊黏膜層、漿膜層明顯強化,中間肌層強化相對較弱,表現為典型的“夾心餅干征”,門脈期和延遲期肌層密度逐漸增高,最后趨向均勻;膽囊壁內結節灶各期均未見明顯強化;8例均顯示黏膜線,6例黏膜線連續,2例黏膜線部分中斷;所有病例肝實質動脈期一過性斑片狀輕度強化,肝實質信號在門脈期和延遲期趨向均勻。
2.2 術中見
8例行膽囊切除術,6例膽囊與周圍組織廣泛粘連,其中,2例膽囊與鄰近組織形成致密性炎性粘連團塊,分離困難,行肝臟、膽囊楔形切除術;4膽囊體部與鄰近結腸形成內漏;8例取出膽囊結石,2例膽總管結石。
2.3 大體病理
膽囊壁增厚,膽囊黏膜線多完整,膽囊壁內結節灶內見膠凍狀物。顯微鏡下見:膽囊壁正常結構不同程度的破壞,膽囊壁內見大小不等結節性肉芽腫性結構:中央為壞死組織伴有淋巴細胞、單核細胞及中性粒細胞浸潤,外層為大量吞噬脂質的泡沫樣組織細胞及增生的纖維母細胞,并見大量淋巴細胞、漿細胞等慢性炎癥細胞浸潤(圖1,2)。
3 討論
XGC是以膽囊壁內黃色肉芽腫為特征且少見的膽囊炎性疾病,僅占膽囊炎性疾病的0.7%~13.2%[2],歐美國家XGC總體的發病率在1.3%~1.9%,印度、日本發病率則為8.8%[3]。女性多于男性,發病年齡以50~60歲多見。XGC患者的臨床癥狀和體征無特異性,類似于一般的膽囊炎癥。急性發作時有白細胞的升高,部分XGC患者腫瘤標志物(如癌胚抗原、CA199、CA125)可升高[4]。
3.1 發病機制
XGC的發病機制目前尚不十分清楚。Takahashi等[5]首先發現了羅-阿竇(R-A)和XGC的關系,提出了XGC發病可能由膽囊的急慢性炎癥和膽汁梗阻的共同作用。目前多數學者也認為XGC與慢性膽囊炎誘發的遲發變態反應有關。大量膽汁堵塞R-A致其破裂,膽汁沿著破裂的R-A或潰瘍病灶滲入至膽囊壁及周圍組織,導致膽囊和周圍組織慢性炎癥反應,同時膽汁降解產生膽固醇和脂質誘發組織細胞增生,產生過敏反應,誘發巨噬細胞聚集吞噬膽固醇、磷脂及膽色素等,形成泡沫樣組織細胞。隨著病程進展,纖維組織大量增生,炎癥機化形成黃色斑塊樣肉芽腫,形成XGC,可造成膽囊與肝臟或鄰近臟器組織的廣泛粘連、浸潤,甚至造成膽囊壞疽或穿孔。
3.2 XGC的MRI特點
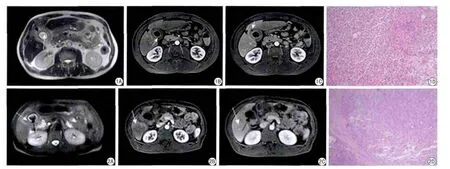
圖1 女,52歲,XGC。A:T2WI軸面,膽囊壁增厚(黑箭),膽囊結石(白箭)。B、C:動態增強動脈期,鄰近肝實質一過性強化(黑箭),黏膜線連續性強化(白箭),膽囊壁內結節不強化。門脈期鄰近的肝實質一過性強化區與正常肝實質信號接近(黑箭),膽囊壁呈夾心餅干征,壁內結節中心仍不強化(白箭)。D:病理見膽囊黏膜炎癥,膽囊壁內大量泡沫細胞(HE ×10) 圖2 男,56歲,XGC。A:T2WI軸面,膽囊壁局部增厚(白箭),膽囊結石(黑箭)。B、C:動脈期鄰近肝實質一過性強化(白箭),膽囊壁內結節不強化(黑箭),門脈期鄰近的肝實質一過性強化區與正常肝實質信號接近(白箭),黏膜線連續強化(白箭)。D:病理見膽囊壁內大量泡沫細胞(HE ×10)Fig.1 A 52 years old woman with XGC.A: T2WI, axial, gallbladder wall thickening (black arrow), Gallbladder stone (white arrow).B, C: Dynamic contrast-enhanced arterial phase, transient hepatic parenchyma enhancement (black arrow), continuous mucosal line with enhancement (white arrow),intramural nodule, no enhancement.Dynamic contrast-enhanced portal venous phase, transient liver parenchyma enhancement nearly became isointense relative to normal liver (black arrow), gallbladder wall appeared “sandwich” sign, intramural nodule, no enhancement (white arrow).D: HE staining,in fl ammation in gallbladder mucosa, a large number of foam cells in gallbladder wall (HE ×10).Fig.2 A 56 years old man with XGC.A: T2WI, axial,local thickening of the gallbladder wall (white arrow), Gallbladder stone (black arrow).B, C: Dynamic contrast-enhanced arterial phase, transient hepatic parenchyma enhancement (white arrow), intramural nodule, no enhancement (black arrow), dynamic contrast-enhanced portal venous phase, transient liver parenchyma enhancement nearly became isointense relative to normal liver (white arrow), continuous mucosal line with enhancement (black arrow).D: HE staining, a large number of foam cells in gallbladder wall (HE ×10).
XGC的最常見MRI征象為膽囊壁增厚,其中彌漫性增厚更為常見。在Goshima等[6]對18例XGC進行研究,結果顯示16例(88.9%)膽囊壁為彌漫性增厚。隨后Zhao等[7]又對49例XGC患者MRI表現進行分析,發現其中彌漫性增厚占87.8%,本組6例表現為膽囊壁彌漫性增厚,增強動脈期膽囊壁的黏膜層和漿膜層明顯強化,中間肌層強化相對較弱,表現為典型的“夾心餅干征”,門脈期肌層逐漸強化。另外2例膽囊壁為局限性增厚呈腫塊狀,與周圍膽囊壁分界不銳利。MRI可顯示增厚的膽囊壁內的黃色肉芽腫,在T1WI多呈等或稍低信號,T2WI呈稍高信號或高信號。MRI空間分辨率相對低,并不是所有XGC均可在MRI上見長T1、T2結節影,較小的結節灶則容易漏掉。黃子星等[8]對15例XGC患者行MRI檢查,僅10例在MRI觀察到結節影。Zhao等[7]對49例XGC進行MRI分析,其中結節灶在MRI中的顯示率近85.7%。本組8例MRI中均可見多枚小結節灶。而在MRI上顯示為長T1、T2結節灶也可能是膿腫和壞死組織。
連續的膽囊黏膜線存在也是XGC較常見征象。膽囊黏膜層T2WI上呈相對低信號,增強掃描見膽囊內壁連續的線狀強化影。由于XGC的病灶主要在囊壁內,覆蓋在其表面黏膜線多較完整,少部分黏膜線中斷由于黏膜潰瘍或黃色肉芽腫的破壞[6],本組6例黏膜線呈連續性,2例黏膜線部分中斷。膽囊癌(GBC)來源于上皮細胞,黏膜線容易破壞,依此可將兩者鑒別。
鄰近肝實質一過性的強化為XGC較常見的MRI征象[8]。可能是炎癥累積肝實質的炎癥反應或由于肝動脈血流量增加、流速增快。報道稱炎性病變向外累及肝臟組織浸潤深度一般不超過20~30mm[9]。本組XGC的MRI征象與報道相符。膽囊累及鄰近的橫結腸、十二指腸等易形成膽囊十二指腸瘺或膽囊結腸瘺等[10]。本組6例XGC患者膽囊與部分結腸粘連,其中4例為膽囊結腸瘺。此外,大量文獻報道XGC常合并膽囊結石,膽道系統常不擴張,本組8例XGC均合并膽囊結石,膽道系統未見明顯擴張,與文獻報道相符。
國外部分學者將MR同相位和反相位T1WI梯度回波序列應用于輔助診斷XGC[9]。在MR圖像中, XGC在同相位上的信號強度高于反相位,可能是由于泡沫細胞含有膽固醇,導致增厚的膽囊壁內脂肪含量增加,因此,在化學位移上,囊壁結節發現脂肪成分,可能提示XGC,沒有明顯的脂肪成分,也不能排除XGC。另外,有學者對XGC和GBC的DWI進行比較[11],得出GBC較XGC受限明顯的結論。這些序列的應用進一步提高了MRI診斷XGC的準確性。
XGC的臨床和影像表現與GBC有較多重疊,因此增加了兩者鑒別難度。兩者的臨床處理方法又極為不同,XGC以單純膽囊切除為主,GBC則需更大范圍的手術切除和淋巴結清掃,術前診斷可能直接影響患者的預后。
XGC病理診斷“金標準”為特征性結節性肉芽腫,GBC確診的金標準是鏡下異型細胞。掌握術前兩種疾病影像表現對兩種疾病診斷具有提示作用。其中,增強動脈期膽囊明顯強化、腹腔內及腹膜后發現腫大淋巴結、周圍組織侵犯、CA199明顯升高及膽道系統擴張則 高度提示GBC[12]。實驗室指標可能幫助診斷XGC和GBC,Zhuang等[13]最新研究得出c-myc基因和CA724可以作為XGC和GBC獨立預測因素。但常規CA199等腫瘤指標對兩者鑒別無明確意義。XGC是否是癌前病變,它一直以來都存在爭論,但在GBC和XGC大背景下,均可炎、瘤共存,因此術中常規做術中冰凍切片,避免遺漏惡性腫瘤。XGC合并腺癌的文獻已有報道。曾有學者懷疑XGC與腺癌有關,但分子遺傳學研究XGC未見p53突變[14],提示兩者非直接因果關系。
總之,XGC的臨床和影像學表現缺乏特異性,而影像征象部分與膽囊癌重疊,增加了兩者鑒別難度,厚壁膽囊、壁內結節、黏膜線連續、鄰近肝實質一過性強化及膽囊結石等是其影像特點,掌握XGC的影像學表現,有利于XGC和GBC的鑒別,對臨床有指導意義。
[References]
[1]Guzman-Valdivia G.Xanthogranulomatous cholecystitis:15years’experience.world J Surg, 2004, 28(3): 254-257.
[2]Guzman-Valdivia G.Xanthogranulomatous cholecystitisin laparoscopic surgery.J Gastrointest Surg, 2005, 9(4): 494-497.
[3]Hale MD, Roberts KJ, HodsonJ, et al.Xanthogranulomatouscholecys titis: a European and global perspective.HPB (Oxford), 2014, 16(5):448-458.
[4]Yu H, Yu TN, Cai XJ.Tumor biomarkers: help or mislead in the diagnosis of xanthogranulomatouscholecystitis? -analysis of serum CA 19-9, carcinoembryonic antigen, and CA 12-5.Chin Med J (Engl),2013, 126(16): 3044-7.
[5]Takahashi K, Oka K, Hakozaki H, et al.Ceroid-like histiocytic granulomas of the gallbladder-a previously undescribed lesion.ActaPathol Jpn, 1976, 26(1): 25-46.
[6]Goshima S, Chang S, Wang JH, et al.xanthogranulomatouscholecys titis: diagnostic performance of CT to differentiate from gallbladder cancer.Euro J Radiol, 2010, 74(3): e79-83.
[7]Zhao F, Lu PX, Yan SX, et al.CT and MR features of xanthogranulo matouscholecystitis: ananalysis of consecutive 49 cases.Eur J Radiol,2013, 89(9): 1391-1397.
[8]Huang ZX, Chen GW, Lu CL, et al.MRI imaging features of xanthogranulomatous cholecystitis.Chin Clin Med imaging, 2010,21(12): 856-859.黃子星, 陳光文, 魯昌立, 等.黃色肉芽腫性膽囊炎的MRI表現特點.中國臨床醫學影像雜志, 2010, 21(12): 856-859.
[9]Shi Q, Zhou JS, Zhang QW, et al.CT features of xanthogranulomatous cholecystitis.Chin J Radiol, 2006, 40(1): 86-88.施勤, 周建勝, 張峭巍, 等.黃色肉芽腫性膽囊炎的CT表現.中華放射學雜志, 2006, 40(1): 86-88.
[10]Han SH, Chen YL.Diagnosis and treatment of xanthogranulomatous cholecystitis a report of 39 cases.Cell Biochem Biophys, 2012, 64(2):135-131.
[11]Kang TW, Kim SH, Park HJ, et al.Differentiating xanthogranulom atouscholecystitis from wall-thickening type of gallbladder cancer:added value of diffusion-weighted MRI.Clin Radiol, 2103, 68(10):992-1001.
[12]Cui Y, Zhang H, Zhao E, et al.Differential diagnosis and treatment options for xanthogranulomatouscholecystitis.Med Princ Pract, 2013,22(1): 18-23.
[13]Zhuang PY, Zhu MJ, Wang JD, et al.Xanthogranulomatouscholecy stitis: a clinicopathological study of its association with gallbladder carcinoma.J Dig Dis, 2013, 14(1): 45-50.
[14]Guermazi A.Are there other imaging features to differentiatexantho granulomatous cholecystitis from gallbladder carcinoma? EurRadiol,2005, 15(6): 127l-1272.

