胸腺瘤、重癥肌無力合并支氣管哮喘1例
劉欣 王連云 和宇崢 石彥濤
患者,女,60歲,主因“間斷言語不清,右眼瞼下垂9 d”于2013年5月8日就診于我院。患者緣于9 d前與人交談時出現舌頭發硬,持續數秒鐘緩解,發作兩次,8 d前出現雙眼流淚,右眼瞼下垂,可間斷緩解,于外院查顱腦MRI示右側顳葉及雙側額葉深部腦白質散在缺血灶,診斷為“缺血性腦血管病”,給予輸液治療癥狀未見明顯好轉,4 d前出現吞咽困難,休息后緩解,為求進一步診治收入神經內科。既往支氣管哮喘病史30余年,高血壓病史1年,預激綜合征病史6個月。入院檢查:T 36.3℃,P 64次/min,R 17次/min,Bp 130/87 mm Hg(1 mm Hg=0.133 kPa),神清語利,查體合作。頭顱無畸形,雙側額紋對稱,眼瞼無水腫,右眼瞼下垂,鞏膜無黃染,雙側瞳孔正大等圓,對光反射靈敏,伸舌居中,鼻唇溝對稱。頸軟,無抵抗。胸廓無畸形,雙肺呼吸音清,未聞及干濕性啰音。心率64次/min,律齊,各瓣膜聽診區未聞及雜音。腹軟,無壓痛、反跳痛及肌緊張,肝脾未觸及。四肢肌力Ⅴ級,肌張力正常。腱反射正常。病理征均陰性。入院后查:重復頻率電刺激:雙面神經(眼輪匝肌記錄)低頻可見衰減現象。顱腦MRA:基底動脈小開窗畸形。胸腺CT(圖1):(1)左前縱隔內軟組織結節(大小1.77 cm×1.32 cm,CT值約29 Hu);(2)兩側胸膜輕度增厚;(3)主動脈及冠狀動脈硬化。心電圖:預激綜合征。入院診斷:(1)重癥肌無力;(2)胸腺瘤;(3)支氣管哮喘;(4)預激綜合征;(5)腦梗死;(6)高血壓2級。于2013年5月13日轉入我科擬行手術治療,完善各項術前檢查。患者于2013年5月20日自覺肌無力癥狀加重,出現吞咽困難,嚴重時飲水亦受影響。經全院會診考慮可行手術治療,術前可試驗性應用新斯的明治療。于2013年5月22日給予甲硫酸新斯的明注射液0.5 mg肌內注射,同時給予硫酸阿托品注射液0.5 mg肌內注射拮抗不良反應,患者病情平穩,未出現哮喘發作。于2013年5月24日在全麻下行胸腔鏡胸腺瘤擴大切除術,于升主動脈左方找到大小2 cm×2 cm×3 cm質硬胸腺瘤,切除后完全清理剩余胸腺組織及周圍心膈角脂肪,手術過程順利。術后給予抗炎、化痰、抑酸、補液等綜合治療,患者右眼瞼下垂及吞咽困難癥狀較前明顯好轉,未發生MG危象。病理診斷(圖2):B2型胸腺瘤;免疫組化結果顯示:CD1a(-),CD20(-),CD3(+),CD4(+),CD5(+),CD8(+),CD99(+),CK19(+),CK5/6(+),CK7(-),EMA(-),Ki-67(+70%),TdT(+)。于2013年5月26日10∶30突發陣發性室上性心動過速(218次/min),急請心內科會診,給予鹽酸胺碘酮注射液150 mg緩慢靜推后轉復成竇性心律。于2013年5月26日16∶00突發胸悶、氣促,聽診雙肺可聞及哮鳴音,考慮支氣管哮喘發作,給予多索茶堿0.2 g入液靜脈滴注后好轉,并持續應用沙美特羅/氟替卡松粉吸入劑(50/100μg)1吸,1次/d。于2013年6月2日,術后第9天,患者右眼瞼下垂及吞咽困難癥狀較術后前幾日加重,遂起始給予溴吡斯的明30 mg,2次/d,口服,并逐漸加量至90 mg,2次/d,患者右眼瞼下垂癥狀明顯改善,吞咽困難較前減輕,于2013年6月10日好轉出院。出院后第7天隨訪,患者右眼瞼下垂癥狀消失,進硬食存在吞咽困難,溴吡斯的明劑量調整為60 mg,每6小時1次,(因90 mg,2次/d胃腸道反應嚴重),持續應用沙美特羅/氟替卡松粉吸入劑(50/100μg)1吸,1次/d,未見哮喘發作。
討論 支氣管哮喘是由多種細胞包括氣道的炎性細胞和結構細胞(如嗜酸粒細胞、肥大細胞、T淋巴細胞、中性粒細胞、平滑肌細胞、氣道上皮細胞等)和細胞組分參與的氣道慢性炎癥性疾病[1,2]。重癥肌無力(myasthenia gravis,MG)是指乙酰膽堿受體(AChR)抗體介導、細胞免疫依賴、補體參與、主要累及神經肌肉接頭突觸后膜AChR的獲得性自身免疫性疾病[3]。體內異常抗體的產生已經被認為是多種疾病的重要發病機制,哮喘和MG也不例外。有研究發現,MG患者的胸腺生發中心可出現CD23(IgE受體)的超表達,而IgE則在變應性哮喘的誘發過程中起重要作用[4]。
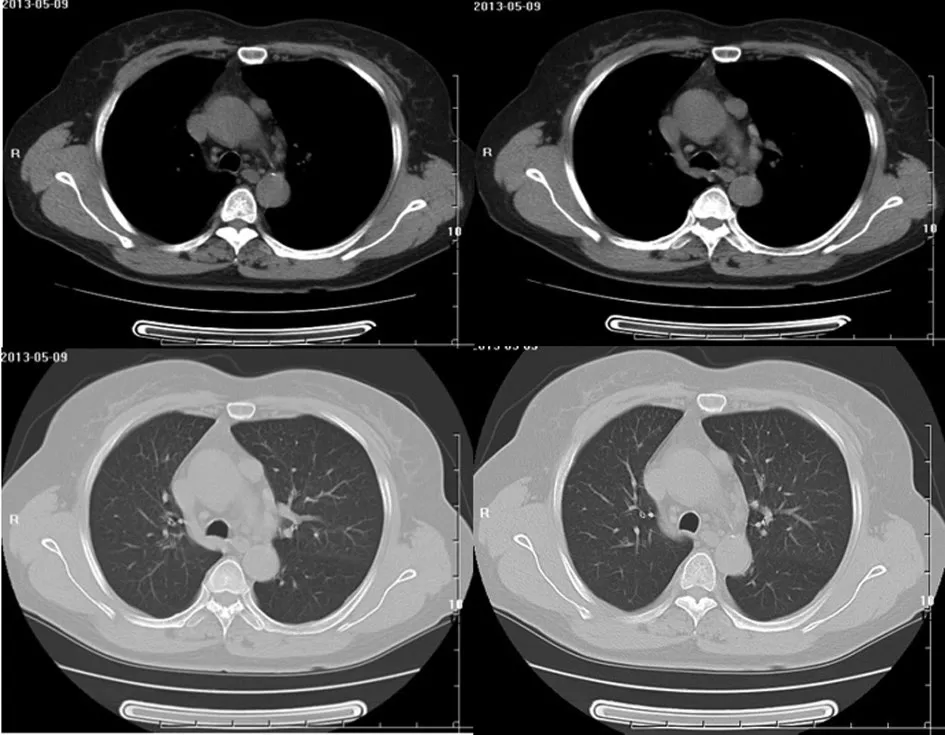
圖1 胸腺CT可見左前縱隔內軟組織結節
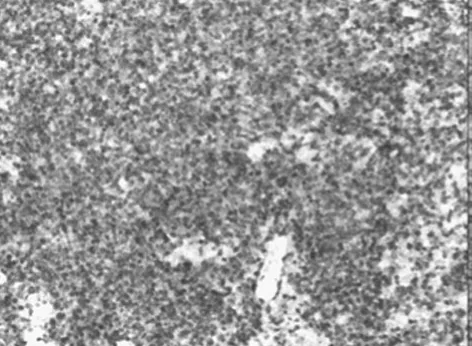
圖2 HE染色
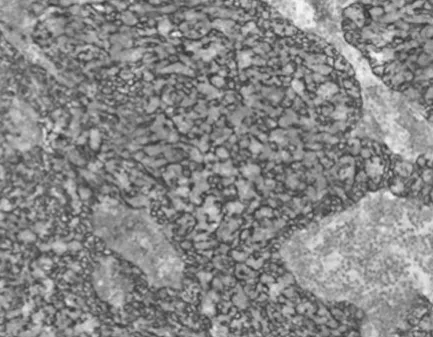
圖3 免疫組化結果
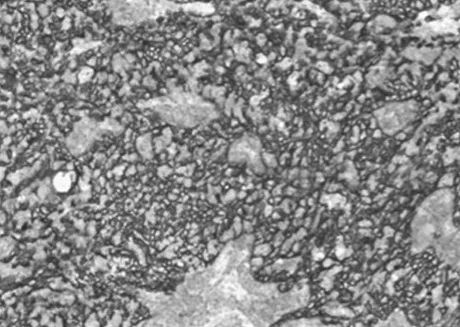
圖4 免疫組化結果

圖5 免疫組化結果
MG與支氣管哮喘的共同特點為同屬自身免疫性疾病,2個及其以上的免疫性疾病同時出現并不少見,而哮喘合并MG從1960年至2011年則只有9例報道[5-13],同時合并胸腺瘤者筆者則未見報道。
MG在各個年齡階段均可發病,平均年發病率約為7.40/百萬人(男性7.66/百萬人,女性7.14/百萬人)。約15%左右的MG患者同時伴有胸腺瘤,約60%左右MG患者同時伴有胸腺增生,20% ~25%胸腺瘤患者可出現MG癥狀[3]。
MG主要治療方法為抗膽堿酯酶藥物與免疫抑制劑治療,應用抗膽堿酯酶藥物可能會誘發哮喘,哮喘發作可加重肌無力癥狀,而停用抗膽堿酯酶藥物,重癥肌無力情況會加重。因此,這兩種疾病同時存在時,呼吸肌處于機械弱勢,稍有不慎則會導致嚴重的呼吸困難。
本患者MG癥狀明顯,哮喘則處于穩定期,治療以MG為主,適時手術,兼顧哮喘。有研究顯示,大部分患者通過根治性切除可治愈胸腺瘤,但仍有部分患者術后出現肌無力癥狀,術后治療尤其是藥物治療的繼續跟進是非常必要的[12]。因此,本患者術前試驗性給予抗膽堿脂酶藥物治療為術后口服溴吡斯的明奠定了基礎。劉志廣等[10]報道顯示以支氣管哮喘癥狀為主時,早期使用糖皮質激素十分重要,糖皮質激素是控制哮喘發作的最有效的一線治療藥物,通過抑制體液免疫反應從而抑制乙酰膽堿受體抗體合成,使突觸后膜乙酰膽堿受體數量增加,減輕哮喘發作,但激素可一過性加重肌無力癥狀,需密切觀察。Echaniz-Laguna等[13]研究顯示如果哮喘診斷成立,應給予支氣管擴張劑,并及時調整溴吡斯的明的用量。
MG患者中,確診的胸腺瘤患者應行胸腺摘除手術,可不考慮MG的嚴重程度,早期手術治療可以降低腫瘤擴散的風險[14,15],根治性切除至關重要。目前,胸腔鏡技術在臨床得到廣泛應用和開展,其具有手術時間短,創傷小,術后患者恢復快,MG危象發病率低的特點[16,17],對于圍手術期使用激素的患者,切口愈合不良的幾率減小,胸腔鏡胸腺擴大切除術治療MG逐漸被國內外學者所采用。Meyer等[18]比較正中開胸和胸腔鏡下胸腺擴大切除的療效,結果表明兩者的CSR率無統計學差異。本患者采用胸腔鏡胸腺瘤擴大切除術,創傷小,未發生MG危象和重癥哮喘,恢復較快,但仍需要進一步隨訪觀察療效。
1 中華醫學會呼吸病學分會哮喘學組.支氣管哮喘防治指南(支氣管哮喘的定義、診斷、治療和管理方案).2008.
2 劉颯,王立民,五紅陽,等.阿奇霉素對支氣管哮喘療效及細胞因子水平的影響.河北醫藥,2013,35:2032-2033.
3 中華醫學會神經病學分會神經免疫學組,中國免疫學會神經免疫學分會.中國重癥肌無力診斷和治療專家共識.中國神經免疫學和神經病學雜志,2011,18:5:368-372.
4 Murai H,Hara H,Hatae T,et al.Expression of CD23 in the germinal center of thymus from myasthenia gravis patients.JNeuroimmunol,1997,76:61-69.
5 Weiner P,Ganem R,Weiner M.Unusual treatment for myasthenia gravis associated with asthma.Harefuah,1993,124:474-477.
6 Akiba Y,Takeuchi T,Nakanishi K,et al.Bronchial asthma complicated by myasthenia gravis.Nihon Kyobu Shikkan Gakkai Zassi,1996,34:449-453.
7 Muller-Felber W,Ansevin CF,Ricker K,et al.Immunossupressive treatment of rippling muscles in patients with myasthenia gravis.Neuromuscul Disord,1999,9:604-607.
8 Murai H,Osoegawa M,Ochi H,et al.High frequency of allergic conjunctivitis in myasthenia gravis without thymoma.JNeurol Sci,2004,225:27-31.
9 Souza-Machado A,Ponte E,Cruz A.Severe asthma associated with Myasthenia gravis and upper airway obstruction.JInvestig Allergol Clin Immunol,2007,17:267-270.
10 劉志廣,康慧聰,劉金鳳,等.重癥肌無力合并支氣管哮喘1例報告.神經損傷與功能重建,2011,6:5:380-381.
11 Nishantha KM,Madegedara D.Myastheniagravis:a rare cause of orthopnoea due to bilateral diaphragmatic paralysis.Indian J Chest Dis AlliedSci,2011,53:189-190.
12 Fredrik R.Thymoma in myasthenia gravis:from diagnosis to treatment.SAGE-Hindawi Access to Research Autoimmune Diseases.doi:10.4061/2011/474512.
13 Echaniz-Laguna A,Pistea C,Philippi N,et al.Asthma as a cause of persistent dyspnea in treated myasthenia gravis patients.Eur Neurol,2012,68:300-303.
14 Skeie GO,Apostolski S,Evoli A,et al.Guidelines for treatment of autoimmune neuromuscular transmission disorders.Eur J Neurol,2010,17:893-902.
15 Jani AA,Lisak RP.Myasthenia gravis.Curr Treat Options Neurol,2010,12:231-243.
16 Meacci E,Cesario A,Margaritora S,et al.Thymectomy in myasthenia gravis via original video-assisted infra-mammary cosmetic incision and median sternotomy:long-term results in 180 patients.Eur JCardiothorac Surg,2009,35:1063-1069.
17 Park IK,Choi SS,Lee JG,et al.Complete stable remission after extended transsternal thymectomy in myasthenia gravis.Eur J Cardiothorac Surg,2006,30:525-528.
18 Meyer DM,Herbert MA,Sobhani NC,et al.Comparative clinical outcomes of thymectomy for myasthenia gravis performed by extended transsternal and minimally invasive approaches.Ann Thorac Surg,2009,87:385-390.

