廢舊PET的化學回收方法研究進展*
陳佳宇,廖正福,劉覺靖,黃思勰
(廣東工業大學材料與能源學院,廣東廣州510006)
隨著PET聚酯產銷量的迅速增加,排入自然界的廢PET聚酯越來越多。盡管PET對環境不產生直接污染,但因其具有極強的化學惰性,很難被微生物或空氣所降解,并且會占據大量的空間,非法填埋或焚燒處理都對環境造成巨大的壓力,直接或間接地對環境造成巨大影響,故而廢PET的回收利用已成為環境保護的重要課題之一。PET聚酯結構致密、易結晶、熔點高,但分子鏈中含有酯鍵,這為化學降解回收提供了可能。當前,PET的回收方法可分為物理回收法和化學回收法[1]。目前,國外回收PET的方法主要是采用化學回收法,即將PET解聚成對苯二甲酸(TPA)、對苯二甲酸二甲酯(DMT)和乙二醇(EG),再將這些產物加以利用[2],國內回收PET的方法則主要采用機械加工進行物理回收再利用[3]。兩者相比,化學回收法更具有資源循環經濟性,具有更好的前景。近些年,化學回收法也已在國內迅速發展起來,技術也逐漸趨于成熟,部分工藝已經工業化。本文對各種化學回收方法的新進展進行了綜述,并重點介紹了醇解法,旨在為PET的工業回收利用提供新參考。
1 水解法
水解法是指在不同的pH水介質中將廢PET解聚為TPA和EG的方法。由于直接用TPA和EG合成PET聚酯的工藝日趨成熟,PET水解回收法日益受到重視[4]。按水解酸堿環境不同可以劃分為酸性水解、中性水解和堿性水解,主要解聚反應如下:
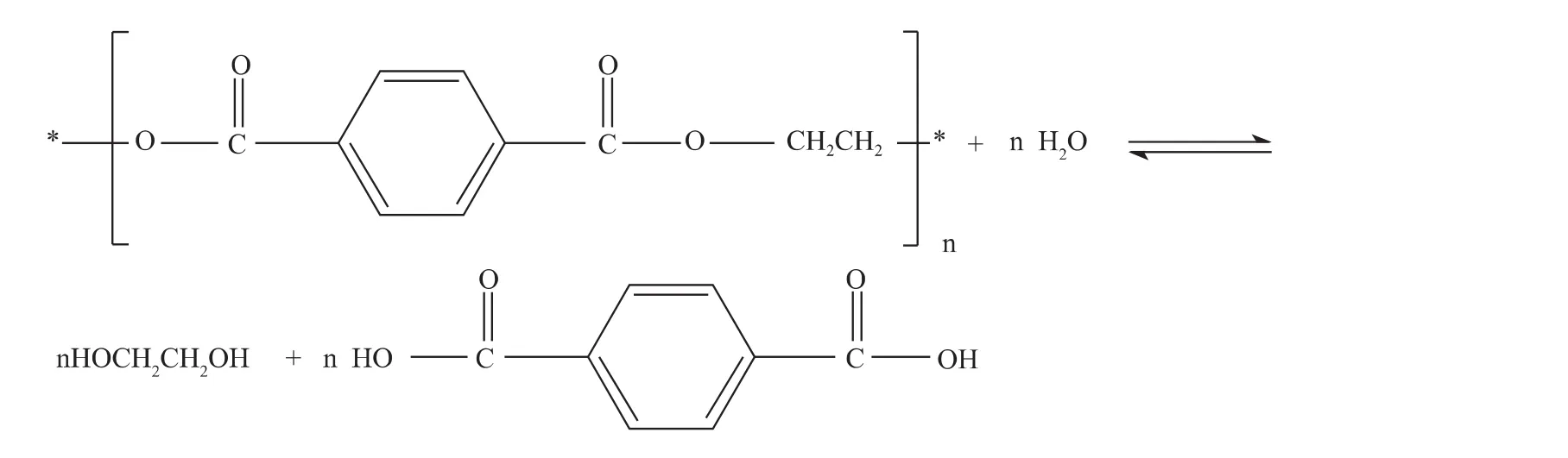
1.1 酸性體系水解
酸性體系水解一般采用濃硫酸、濃硝酸或濃磷酸作催化劑。Pusztaszeri于1982年發表了用酸催化水解進行PET循環利用的專利[5]。基本工藝為:將wt80%的硫酸溶液和廢舊PET瓶片加入到配有攪拌器和回流冷凝管的反應裝置中,加熱至60℃ ~90℃,反應時間為3h~5h,將產物過濾,濾漿為TPA和未完全降解的PET混合物,濾出液為硫酸溶液和EG。將KOH溶液加入濾漿中制得TPA的二鉀鹽,再次過濾可將TPA與PET分離出來,將TPA的二鉀鹽用強酸中和即可得到純凈的TPA。GizileneM.de Carvalho[6]等發現,隨著反應的進行,PET 的結晶度有所增加。PET在硫酸溶液中的反應原理如下:

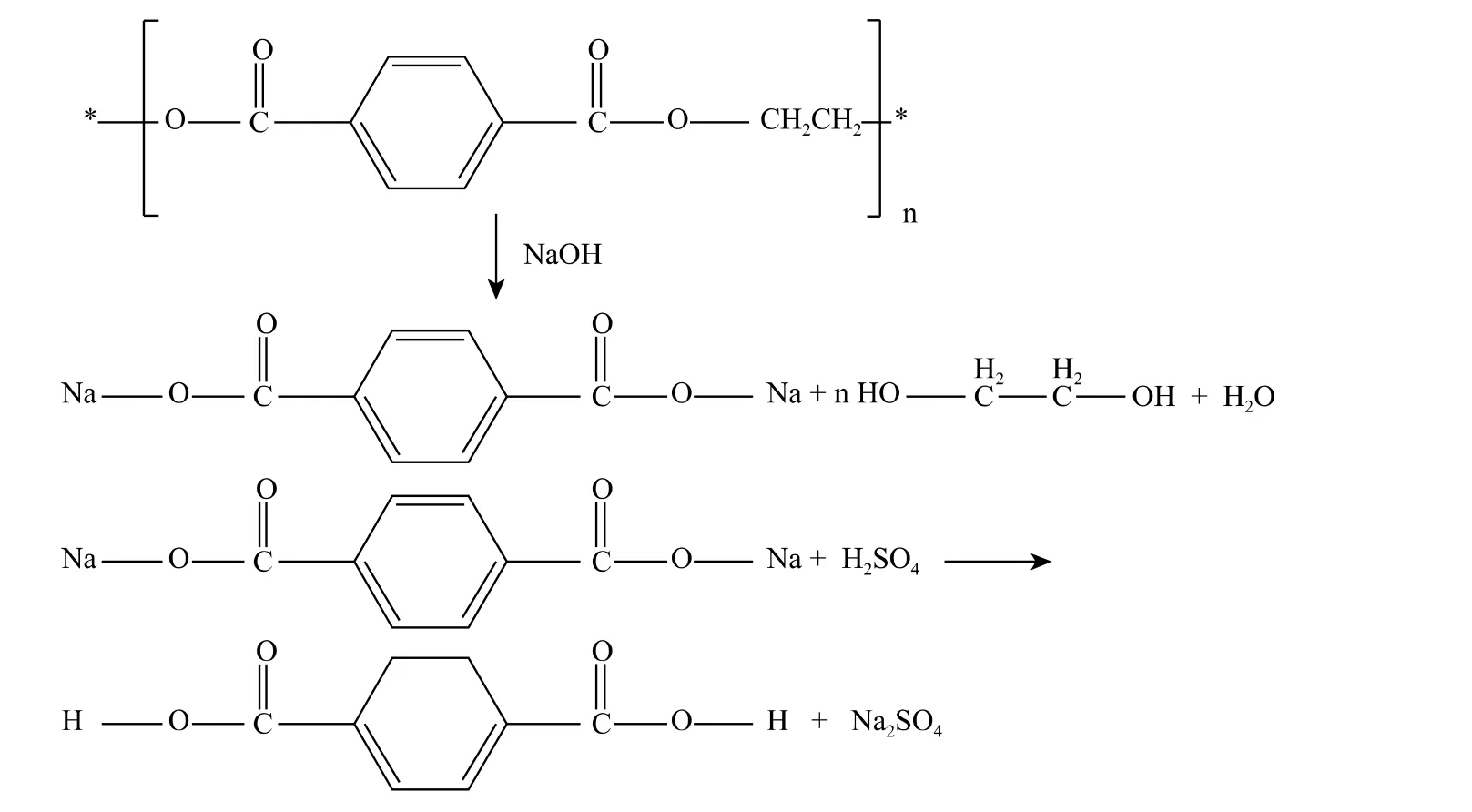
1.2 堿性體系水解
堿性體系水解一般采用wt4%~20%的NaOH或KOH的水溶液,反應溫度為200℃ ~250℃,壓力為1.4MPa~2.0MPa,反應時間為3h~5h。產物為對TPA的二鉀鹽和EG,通過加熱蒸發可回收EG,用強酸中和即可得到純凈的TPA。Kosmidisv等[7]在PET飲料瓶的堿解反應中加入相轉移催化劑季銨鹽,TPA的產率明顯提高。堿性水解的降解產物純度較高,成本低,能夠降解高度污染過的廢PET,如磁性錄音帶、相片膠卷等,比甲醇醇解過程更加簡單。但反應結束后的廢堿液須適當處理,避免對環境造成污染。堿性水解機理如下:
1.3 中性體系水解
中性體系水解反應通常在245℃ ~300℃、1MPa~4MPa的反應釜中進行,大量的熱水和水蒸氣將PET降解成TPA和EG[8]。由于熔融狀態下的PET水解速度比固態時要快得多,所以反應溫度通常在245℃以上。在275℃水解1h,篩選后的廢舊PET可被完全降解且TPA的產率高達95%。Campanelli等[9]提出了轉化反應全過程的分析方法,并通過初始反應速率數據估算了PET水解反應的速率常數。Liu[10]等報道了微波輻射作用下PET在純水中的降解。在壓強為2000KPa、溫度為220℃的條件下,PET和水質量比為1∶10,反應時間為90min ~120min,PET 完全降解為TPA、EG和少量的DEG。同時他們指出,該反應在一定范圍內符合規則斷鏈反應機理。
該方法對比酸性體系和堿性體系有一定的優勢,因為產物沒有大量的無機鹽類,廢液的處理較為容易,且不會腐蝕設備。但是由于其反應條件需要高溫高壓,所以對設備的要求更高。反應中往往需要加入過量的水,使得產物中EG的濃度偏低,給分離帶來困難。此外,TPA與廢棄PET中的雜質混合在一起,使得TPA的純度不如酸解和堿解反應得到的高。
1.4 非水溶液中的堿解
除了水溶液堿性水解,非水溶液中的堿解的報道也較多。醚(二氧六環、THF等)和醇(甲醇、乙醇)的混合溶劑能夠使PET的降解反應加快。Hu[11]等發現,甲醇和二氧六環的混合溶劑,在60℃的條件下完全堿解固體PET(>96%)只需40min,若不添加二氧六環,則反應時間延長至7h。這可能是由于醚能夠增強羥基的離子強度和浸透能力。甲基纖維素溶劑(CH3-O-CH2-CH2-OH)因其既含有醚鍵又含有羥基,其作為溶劑可更高效地強化堿解,其中醚能使PET產生溶脹,醇有助于堿破壞PET的化學結構。
2 醇解
2.1 甲醇醇解
PET可在高溫、高壓條件下于甲醇中解聚,產物為DMT和EG。反應通常在180℃ ~280℃、2MPa~4MPa,加入醋酸鹽類作為催化劑,可提高反應速度。反應結束后將混合液冷卻、離心、結晶沉淀,則得到產物DMT,再通過對殘留物的精餾可得到EG。解聚反應結束后須讓催化劑失活,否則DMT與EG發生酯交換反應而導致產率下降。該甲醇醇解工藝目前已為PET生產商Hoechst和Eastman所采用。反應機理如下:
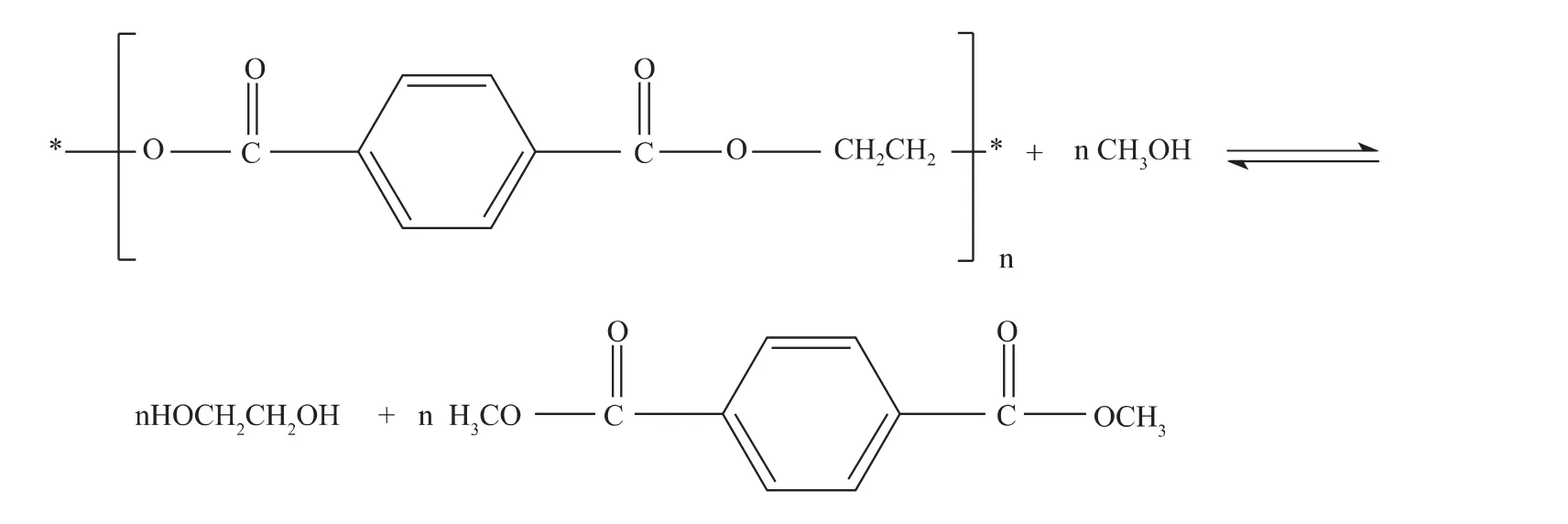
常用的催化劑,如醋酸鋅、醋酸錳、磷酸錳、磷酸鈣、三異丙氧基鋁、堿金屬及其氧化物和氫氧化物、硅酸鈉以及氧化鉛等,能有效地提高酯交換反應的效率。Kurokawa等[12]以三異丙氧基鋁(AIP)為催化劑,在200℃條件下,用甲醇作為醇解劑,降解PET得到的DMT單體和EG產率較高,并指出AIP能有效地將PET降解產生的低聚物進一步轉化為單體產物。
超臨界態下甲醇具有獨特的物理性能,比如良好的溶解能力、流動性能和傳遞性能,因此超臨界甲醇醇解法受到了多數學者們的關注。Motonobu Goto[13]等采用超臨界甲醇在573K,20MPa 的條件下解聚PET 2min~120min,降解得到DMT、EG及低聚物,并用反應動力學理論分析了其降解行為。甲醇醇解法的優點是:可實現連續化并且得到的DMT純度高,EG和甲醇都可以回收和重復利用。但產品的分離和提純成本高,少量的水能使催化劑失活,并且形成共沸混合物。新的PET生產工藝普遍采用TPA而不是DMT作為聚合原料,而DMT水解成TPA又將增加成本。
2.2 二元醇醇解
二元醇醇解法是另一種非常重要的醇解處理方法。二元醇醇解劑主要包括乙二醇(EG)、丙二醇(PG)、二甘醇(DEG)、1,4 - 丁二醇(BDO)和三甘醇(TEG)等。其中,乙二醇的應用較為成熟,其醇解法的基本原理是將PET瓶片與EG按一定比例混合,加入醋酸鹽類作為催化劑,其反應溫度為180℃ ~220℃,反應時間為1h~4h。如果完全醇解,產物為BHET及其低聚物,再通過分離提純即可獲得PET聚酯單體BHET,如果部分醇解,醇解產物為一些鏈較長的低聚物,可作為中間體原料生產其他產品。主要解聚反應式如下:
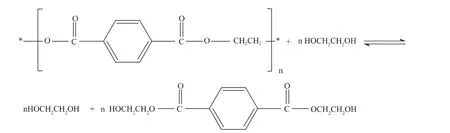
Chen 等[14]指出,在 190℃ ~240℃、0.1MPa ~0.6MPa條件下,PET在EG中的降解反應速率和EG濃度的平方成正比。席國喜等[15]研究了廢PET的醇解條件對產物的羥值及平均分子量的影響,研究發現在196℃ ~198℃時,EG和 PET質量比為2∶1,醋酸鋅用量為 PET質量的1%,反應時間為3h~3.5h,PET降解徹底,產物平均分子量在305以下,主要成分是 BHET及其低聚物[16]。Francis Pardal等[17]研究了反應溫度和催化劑等條件對DEG醇解廢PET的動力學的影響,結果表明反應溫度、催化劑對PET解聚過程有較大的影響。反應溫度為210℃ ~220℃時,DEG在PET內擴散均勻,易發生固相解聚反應;加熱對PET在DEG中溶解有影響,將PET和DEG分別加熱至220℃再混合比二者混合后再加熱至220℃,PET溶解所需的時間更短。
乙二醇醇解法可以解聚各種來源的廢PET,該方法反應條件溫和,安全性高,可以實現連續化生產,但由于其產物是一系列聚合度不同的低聚物鏈段,分離提純較為困難,對其應用有一定影響。
3 胺/氨解
胺解法主要是氨中的氮原子進攻酰氧鍵上的碳原子,使酰氧雙鍵斷裂,產物為酰胺和醇。胺解溫度比較低,一般在20℃ ~100℃,PET可以與不同的胺的水溶液反應,生成對應的對苯二甲酸二酰胺和EG,但由于氨解反應一般較慢,而且有較多副反應發生,目前尚未工業化生產。在纖維改性方面,部分胺解能夠有效改善纖維的性能。用三乙醇胺降解PET,其產物中含有羥基和胺基,有望成為合成聚氨酯,特別是硬聚氨酯泡沫的原料。有研究表明,在酸性催化劑作用下,過量的乙醇胺和廢舊PET聚酯能發生降解反應,并可獲得產率高達91%的二(2 - 羥乙基)對苯二甲酰胺[18]。
4 其他化學回收法
4.1 熱裂解
熱裂解可分為熱氧化、熱水解和高溫分解三類。一般認為PET分子鏈中的酯鍵在高溫下(400℃ ~730℃)斷裂,發生斷裂的酯鍵是隨機的[19],產物主要為 CO2、CO、乙醛等小分子氣體和殘留物,殘留物的主要成分為芳香族化合物,以苯及其衍生物為主,經過除雜等處理后可作為清潔燃油。Saha等[20]研究了 PET的高溫分解動力學,建立了PET在N2氣氛中分解的動力學模型,應用熱重分析技術(TGA)計算出反應的活化能。Birladeanu等[21]應用動力學技術研究PET分解的過程,觀察了表面活化能與加熱速率、分解率及試樣分子量之間的關系。
4.2 固態縮聚
將廢棄PET預處理后,加熱固態縮聚,可以制得更高分子量的PET,從而實現循環利用的目的。Karayannidis[22]等報道了該法的研究,他們將廢舊PET聚酯溶于混合溶劑中,再用甲醇預處理,提高PET聚酯的表面張力,加熱固態縮聚,可以得到更高分子量的PET聚酯。該研究發現,將PET聚酯溶于鄰氯苯酚和硝基苯中沉淀,在230℃縮聚8h后,PET聚酯的數均分子量可達60000。
5 結語
作為PET的生產和使用大國,與美國、日本等發達國家相比,我國的PET回收水平仍較為落后,產品附加值較低。因此,無論從環境、能源,還是資源等方面考慮都迫使進行PET循環利用。化學方法回收PET,將PET解聚轉化為中間原料(BHET)或單體(TPA、DMT、EG等),可重新聚合成PET或合成聚氨酯、不飽和樹脂等[23],實現了資源的循環利用,是處理PET廢棄物最為有效而科學的途徑之一。
[1]孔祥建,張之鶴.廢聚對苯二甲酸乙二醇酯的醇解研究[J]. 塑料工業,2012,40(4):86-90.
[2]Atta A M,Abdel-Rauf M E,Maysour N E,et al.Surfactants from recycled poly(ethylene terephthalate)waste as water based oil spill dispersants[J].Journal of Polymer Research,2006,13(1):39-52.
[3]李永貴,曹遠慮,葛明橋,等.利用廢棄聚酯制品生產紡織纖維[J].紡織學報,2006,27(8):101-103.
[4]楊俊輝.廢棄PET的化學降解與回收研究[J].包裝工程,2008,29(4):27 -30.
[5]Pusztaszeri S.US,4355175.1982.
[6]de Carvalho G M,Muniz E C,Rubira A F.Hydrolysis of post-consume poly(ethylene terephthalate)with sulfuric acid and product characterization by WAXD,13C NMR and DSC[J].Polymer degradation and stability,2006,91(6):1326-1332.
[7]Kosmidisv A,Achiliasd S,Karayannidisg P.Poly-(ethylene terephthalate)Recycling and Recovery of Pure Terephthalic Acid,Kinetics of a Phase Transfer Catalyzed Alkaline Hydrolysis[J].Macro-molecular Materials and Engineering,2001,286:640-647.
[8]Masuda T,Miwa Y,Tamagawa A,et al.Degradation of waste poly(ethylene terephthalate)in a steam atmosphere to recover terephthalic acid and to minimize carbonaceous residue[J].Polymer degradation and stability,1997,58(3):315 -320.
[9]Campanelli J R,Kamal M R,Cooper D G.A kinetic study of the hydrolytic degradation of polyethylene terephthalate at high temperatures[J].Journal of applied polymer science,1993,48(3):443-451.
[10]Liu L,Zhang D,An L,et al.Hydrolytic depolymerization of poly(ethylene terephthalate)under microwave irradiation[J].Journal of applied polymer science,2005,95(3):719 -723.
[11]Hu L C,Oku A,Yamada E,et al.Alkali-decomposition of poly(ethylene terephthalate)in mixed media of nonaqueous alcohol and ether.Study on recycling of poly(ethylene terephthalate)[J].Polymer journal,1997,29(9):708 -712.
[12]Kurokawa H,Ohshima M,Sugiyama K,et al.Methanolysis of polyethylene terephthalate(PET)in the presence of aluminium tiisopropoxide catalyst to form dimethyl terephthalate and ethylene glycol[J].Polymer degradation and stability,2003,79(3):529 -533.
[13]Goto M,Koyamoto H,Kodama A,et al.Degradation kinetics of polyethylene terephthalate in supercritical methanol[J].AIChE journal,2002,48(1):136-144.
[14]Chen J Y,Ou C F,Hu Y C,et al.Depolymerization of poly(ethylene terephthalate)resin under pressure[J].Journal of applied polymer science,1991,42(6):1501 -1507.
[15]席國喜,邢新艷,孫晨.廢聚酯醇解條件的研究[J]. 環境科學研究,2004,17(5):38-40.
[16]López-Fonseca R,Duque-Ingunza I,De Rivas B,et al.Chemical recycling of post-consumer PET wastes by glycolysis in the presence of metal salts[J].Polymer Degradation and Stability,2010,95(6):1022 -1028.
[17]Pardal F,Tersac G.Kinetics of poly(ethylene terephthalate)glycolysis by diethylene glycol.Part II:Effect of temperature,catalyst and polymer morphology[J].Polymer Degradation and Stability,2007,92(4):611 -616.
[18]Shukla S R,Harad A M.Aminolysis of polyethylene terephthalate waste[J].Polymer degradation and stability,2006,91(8):1850 -1854.
[19]Botelho G,Queirós A,Liberal S,et al.Studies on thermal and thermo-oxidative degradation of poly(ethylene terephthalate)and poly(butylene terephthalate)[J].Polymer degradation and stability,2001,74(1):39 -48.
[20]Saha B,Ghoshal A K.Thermal degradation kinetics of poly(ethylene terephthalate)from waste soft drinks bottles[J].Chemical Engineering Journal,2005,111(1):39 -43.
[21]Birladeanu C,Vasile C,Schneider I A.Kinetics of thermal and thermo-oxidative degradation of poly(ethylene terephthalate)[J].Macromolecular Chemistry and Physics,1976,177(1):121-129.
[22]Karayannidis G P,Kokkalas D E,Bikiaris D N.Solid-state polycondensation of poly(ethylene terephthalate)recycled from postconsumer softdrink bottles.I[J].Journal of applied polymer science,1993,50(12):2135 -2142.
[23]鄧玉明,毛勇,查琳琳.PET廢棄物水解及醇解化學回收技術研究[J].塑料制造,2011,(7):49-53.

