海洋石油降解菌的篩選鑒定及其功能基因研究*
吳福順,王 龍,黃澤瑜,史曉翀,張曉華
(中國海洋大學海洋生命學院 ,山東 青島266003)
海洋約占地球表面積的3/4,為人類提供了豐富的生產、生活和空間資源。然而,隨著人類對海洋資源的不合理開發利用,海洋污染日益嚴重,對人類的危害也愈發明顯。作為當今及未來幾十年內世界的主要能源,石油及其制品是主要的海洋污染源之一[1]。石油成分復雜,含量最多的是飽和鏈烷烴,在石油中的含量為50%~60%[2]。由于飽和烷烴極性官能基團的缺乏和C-H鍵的高穩定性,導致其具有低親水性和低化學活性,進入海洋后,會在海面形成穩定油膜,從而對海洋環境和海洋生態系統造成持久的、嚴重的危害[3-5]。
生物修復由于無污染、花費低和操作簡單,是目前治理海洋石油污染的最有前景的方法之一,其中高效石油降解菌在生物修復中發揮著舉足輕重的作用[5]。據報道,一共有79個屬的細菌可以把石油烴作為唯一的碳源和能源,海洋石油降解菌主要包括食烷菌屬(Alcanivorax)、解環菌屬(Cycloclasticus)、嗜油菌屬(Oleiphilus)、油螺旋菌屬(Oleispira)、深海彎菌屬(Thalassolituus)、海桿菌屬(Marinobacter)、芽孢桿菌屬(Bacillus)等[6-8]。編碼石油烴降解酶的基因是目前石油降解領域的研究熱點之一。細菌中的石油烴降解酶類能夠將石油中的惰性烴類催化降解成為小分子物質,并以此作為生長所需的碳源和能源。烷烴羥化酶AlkB[9-10]、細胞色素 P450[11-13],以及最近發現的黃素結合蛋白AlmA[14-16],都能夠催化烷烴降解的起始反應,參與烷烴氧化最關鍵的一環,對石油污染的生物修復至關重要。
2011年渤海灣蓬萊19-3油田溢油事故,共造成超過840km2的海域水質達劣四類(劣于國家海水水質標準中4類海水水質),對渤海生態系統造成了極大危害。本研究以此為契機,利用石油原油為唯一碳源,從實驗室海洋微生物菌種庫中篩選鑒定具有石油降解活性的細菌,對篩選得到的菌株的石油烴降解酶基因進行研究,為海洋石油污染的生物降解、工業上生物催化劑的開發利用,提供菌株和基因資源。
1 材料與方法
1.1 實驗材料和儀器
石油原油:勝利油田原油,由中國海洋大學化學化工學院包木太教授惠贈。
實驗菌株:中國海洋大學海洋微生物菌種保藏中心(Marine Culture Collection,Ocean University of China,MCCO)菌株。其中,DSM14913和DSM6294購自德國生物資源中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen),ZJ028分離自中國黃海 冷 水 團 區 域,ZXM008、ZXM018、ZXM112 和ZXM183分離自中國青島匯泉灣滸苔爆發期近岸表層海水,WH069、WH072和 WH303分離自中國青島海水,COW02和COW10分離自中國萊陽患病奶牛,Fyb20和H61分離自中國青島文昌魚繁殖海域海水,SW100分離自南太平洋環流區表層海水。
2216E培養基:蛋白胨5g,酵母膏1g,FePO40.01g,陳海水1L,調pH=7.6,121℃高壓蒸汽滅菌20min(下同)。
高鹽LB培養基:NaCl 30g,酵母膏5g,蛋白胨10g,去離子水1L,調pH=7.0,配固體培養基加瓊脂粉15g/L。
MMC 培養基:NaCl 24g,MgSO4·7H2O 7g,NH4NO31g,KCl 0.7g,KH2PO42g,Na2HPO43g,去離子水1L,調pH=7.4,高壓蒸汽滅菌后補加微量元素混合液5mL/L。
MMC微量元素混合液:CaCl22mg,FeCl3·6H2O 50mg,CuSO40.5mg,MnCl2·4H2O 0.5mg,ZnSO4·7H2O 10mg,去離子水1L。0.22μm濾膜過濾除菌。
無機鹽原油培養基:50mL MMC培養基中加入250mg的原油。
主要儀 器:2720Termal Cycler PCR 儀 (Applied Biosystems);臺式高速冷凍離心機(美國科峻儀器公司);紫外分光光度計(北京普析通用儀器有限責任公司)。
1.2 實驗方法
1.2.1 海洋石油降解菌株的粗篩 菌株石油降解性能的測定采用紫外分光光度法[17]。將實驗室菌種庫中菌株活化后分別接種至高鹽LB液體培養基中,28℃、200r/min過夜培養。將過夜富集培養的種子液于4℃、5 000r/min條件下離心10min,收集沉淀的菌體。用無菌MMC培養基按上述操作洗滌菌體2次后制成菌懸液,按2%(V/V)接種量接種于50mL無機鹽原油培養基中,于28℃、200r/min培養2周后,參照徐馮楠等萃取步驟[27],將培養液用石油醚(60~90℃沸程)萃取至50mL比色管中,定容,并搖勻。以石油醚為參比測定OD225。然后根據標準曲線算出吸光度對應的殘油濃度。
石油降解率η的計算公式:
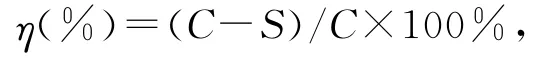
式中:C為空白對照萃取液的殘油濃度;S為樣品萃取液的殘油濃度。
1.2.2 高效石油降解菌的鑒定和系統發育樹的構建
從篩選出的高效石油降解菌株中提取DNA,用通用引物B8F和B1510R(見表1),按相應反應體系和程序[22]進行16SrRNA基因的PCR擴增,PCR產物送往深圳華大基因科技有限公司測序,獲得的序列在EzTaxon-e Database核酸數據庫中進行比對鑒定;選擇相似性較高的代表性序列,用 MEGA 5.05軟件構建Neighborjoining系統進化樹,并用自舉法(Bootstrap method)1 000次重復測試進化樹的可靠性。
1.2.3 石油烴降解酶基因的檢測和分析 克隆石油烴降解酶基因(alkB、P450和almA)所用的簡并引物見表1。其中烷烴羥化酶基因alkB用2對引物alkBwf/r(目的片段長約550bp)和monf/r(目的片段長約420 bp),細胞色素P450單氧酶P450基因用2對引物P450F/R(目的片段長約800bp)和 CYP153-F1/R2(目的片段長約820bp),黃素結合單氧酶almA基因用一對引物 AlmAdf/r(目的片段長約1 100bp),然后按照相應反應體系和程 序進行 PCR 擴增[16,19-21]。克隆測序具體步驟參照嚴書林[22],測序結果在NCBI上進行序列比對,并用MEGA5.05做系統發育樹。
1.2.4 耐鹽芽孢桿菌 WH072石油烴降解酶基因全長的克隆與分析 根據石油降解菌石油降解率初篩結果,選取未被報道的高效石油降解菌株耐鹽芽孢桿菌(Bacillus halodurans)WH072利用高效熱不對稱性交錯PCR(hiTAIL-PCR)[23]進行功能基因全長的克隆,引物見表1。將各功能基因翻譯的氨基酸序列在NCBI上進行BLAST比對,然后用ClustalW比對其氨基酸序列和與之相似度高的蛋白序列。
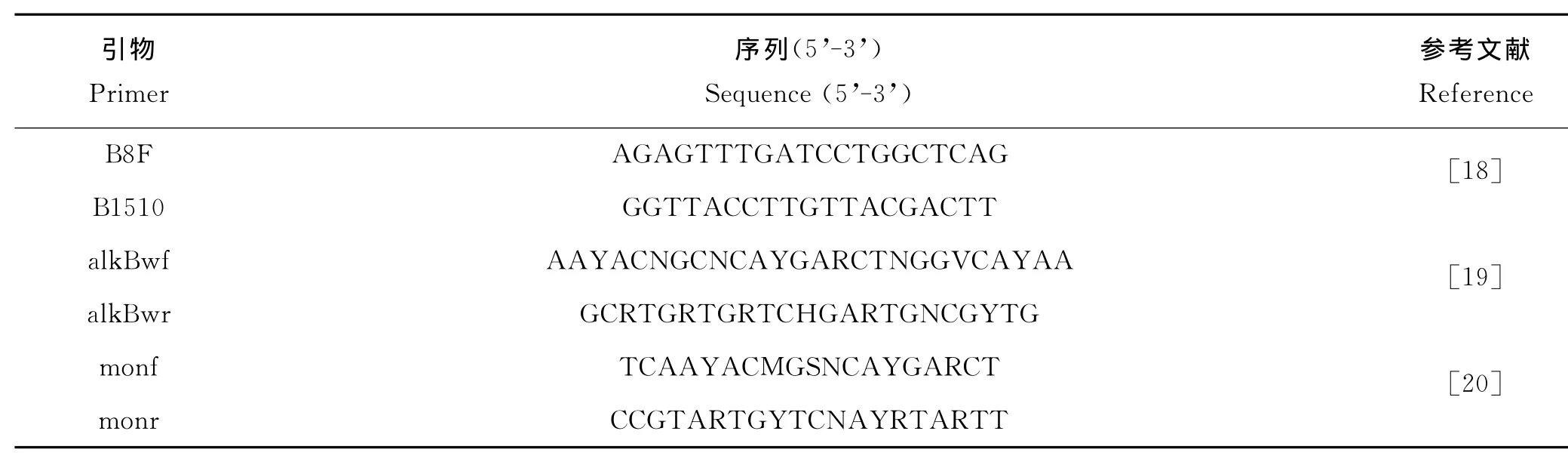
表1 實驗所用引物Table 1 The primers used in experiments

續表1
2 實驗結果
2.1 海洋石油降解菌株的粗篩
以原油為碳源,采用紫外分光光度法測定實驗室菌種庫菌株的石油降解率,以篩選出高效石油降解菌。各菌株的石油降解率結果見圖1。從圖1可以看出,WH072、WH069、WH303、ZXM008、ZXM183這5個菌株的石油降解效果較好,尤其是WH072和WH069,其降解率分別為(36.4±1.0)%和(20.0±0.2)%。
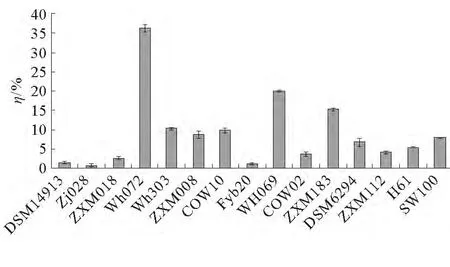
圖1 各菌株的石油降解率Fig.1 Oil degradation rate of bacteria
2.2 高效石油降解菌的鑒定和系統發育樹的構建
將測序獲得的16SrRNA基因序列在EzTaxon public數據庫中進行同源性比對,相似度比較結果見表2。結果顯示,這5株菌與數據庫中標準菌株的相似度都高于97%。WH072基本可確定為耐鹽芽孢桿菌,且目前該種未有石油降解功能的報道。

表2 石油降解菌的種屬鑒定Table 2 Identification of oil degradation bacteria
石油降解菌株的系統發育進化樹見圖2。這5株菌大體上可以分為2簇,第一簇包括 WH069、ZXM183和ZXM008,屬于γ-變形菌綱(γ-Proteobacteria);WH303和 WH072組成第二簇,屬于厚壁菌門(Firmicutes)。已有較多的報道發現芽孢桿菌屬、海桿菌屬及假單胞菌屬的菌株參與石油烴的降解過程[8]。此外,曾在多個石油污染環境中發現Bacillus屬的菌株[29-31],說明將該屬細菌是一類分布較為廣泛的石油降解菌。
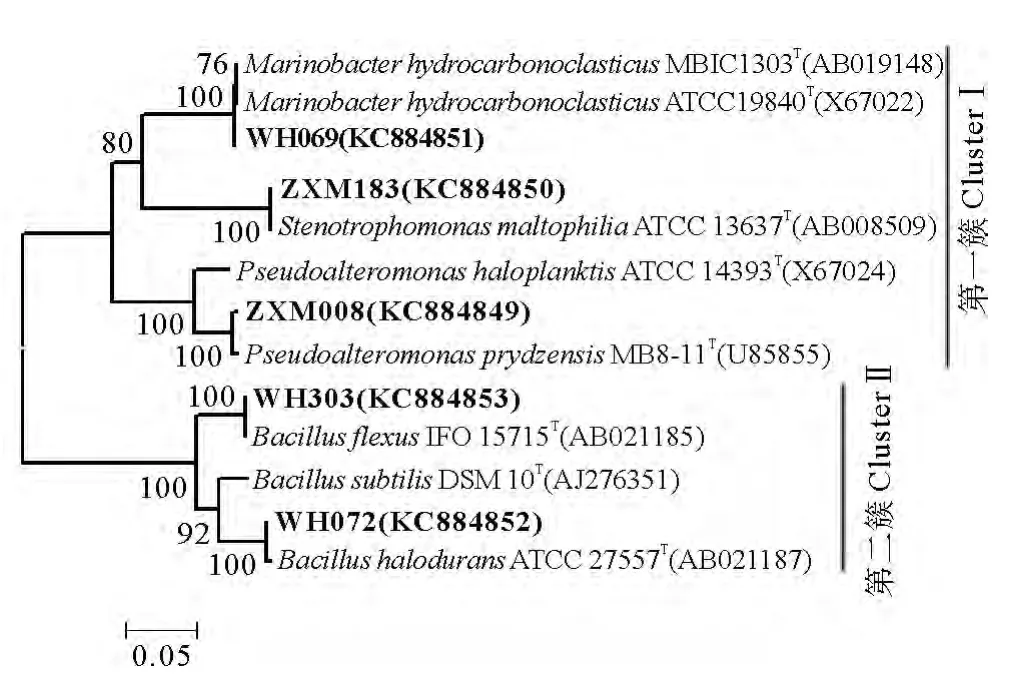
圖2 石油降解菌株的16SrRNA系統發育樹Fig.2 Phylogenetic tree based on 16SrRNA gene sequence of the oil degradation bacteria
2.3 石油烴降解酶基因的檢測和分析
2.3.1 石油降解菌烴降解酶基因的PCR檢測 采用簡并引物alkBf/r和 monf/r、P450F/R 和 CYP-F1/R2、AlmAdf/r(見表1)分別對石油降解菌的alkB、P450和almA基因進行PCR擴增并進行凝膠電泳。結果顯示,對于前2種基因,WH072用引物monf/r獲得了長約420bp的預期目的產物,用引物CYP-F1/R2獲得了長約820bp的目的產物;WH069用引物alkBf/r獲得了長約550bp的目的產物,用引物P450F/R獲得了長約800bp的目的產物。利用引物AlmAdf/r從WH072和WH069中都擴增到了長約1 100bp的目的產物。另外3株菌WH303、ZXM183和ZXM008PCR擴增后都沒有發現這3種基因的目的條帶。將所獲得的目的條帶切膠回收,克隆測序。
2.3.2 石油烴降解酶基因alkB、P450和almA的系統發育分析 將石油烴降解酶基因alkB、P450和almA的保守序列翻譯成氨基酸序列,然后將其在GenBank數據庫中進行BLAST比對,選取GenBank中有代表性的AlkB、P450和AlmA蛋白全長序列進行比對,用MEGA 5.05軟件中NJ法構建系統發育樹研究所獲得的功能基因之間的進化關系,設置自展值(Bootstrap)為1 000次來評估進化樹的可信度[19]。結果見圖3~5。
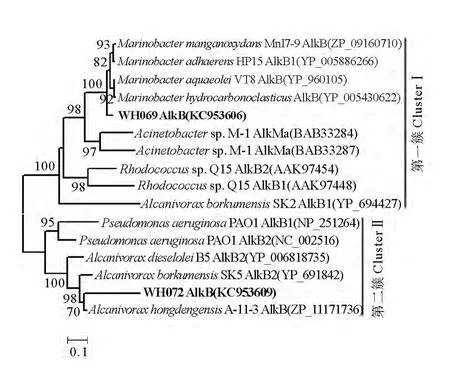
圖3 石油降解菌株烷烴羥化酶AlkB部分氨基酸序列的系統發育樹Fig.3 Phylogenetic tree of the partial amino acid sequences of the(putative)alkane hydroxylases(AlkBs)
由圖3可知,AlkB序列大致可以分為2支。其中WH069和 M.aquaeolei VT8AlkB(YP_960105)(相似度為94%)、M.hydrocarbonoclasticus AlkB (YP_005430622)(相似度為95%)聚為一簇,它們之間的alkB基因同源性很高,因此基因功能應該比較一致,底物范圍接近。對于WH072來說,其AlkB與A.hongdengensis A-11-3AlkB (ZP_11171736)最為接近,兩者的相似度僅為89%,與其他菌的AlkB親緣關系較遠,所以推測其alkB基因是一個相對較新的烷烴羥化酶基因,其表達產物的結構、功能和降解底物范圍有待深入研究。

圖4 石油降解菌株細胞色素P450的系統發育樹Fig.4 Phylogenetic tree of the partial amino acid sequences of the(putative)cytochrome P450
從圖4可以看出,這2株菌的P450序列可以聚為2簇。M.hydrocarbonoclasticus的細胞色素P450是單氧酶的典型成員,WH069的P450蛋白與其有很高的同源性(高達100%)。WH072與B.licheniformis P450 (ACP39677)、Alcanivorax sp.S14-2P450(ACP39680)的相似度分別為100%和99%,說明不同種屬石油降解菌的P450有很高的相似性。

圖5 石油降解菌株黃素結合蛋白AlmA的系統發育樹Fig.5 Phylogenetic tree of the partial amino acid sequences of the(putative)flavin-binding protein AlmAs
圖5 顯示,WH069的黃素結合蛋白AlmA蛋白與M. hydrocarbonoclasticus ATCC 49840AlmA(CCG97212、YP_005431635)、M.aquaeolei VT8AlmA(YP_961086)可聚為一簇,序列相似度分別高達100%、99%。WH072的AlmA蛋白和A.borkumensis SK2 AlmA (YP_692002)(92%)、A.jadensis AlmA(ACO56905)(100%)也聚成了一個相對獨立的分支,其與食烷菌屬的AlmA序列相似度很高,功能可據此推測。
2.4 耐鹽芽孢桿菌WH072石油烴降解酶基因全長的克隆與分析
為獲得未被報道的高效石油降解菌株耐鹽芽孢桿菌WH072的石油烴降解酶基因的全長序列,用hi-TAIL方法進行基因片段兩端序列的擴增,然后進行比對拼接,從而得到了其基因的全長序列。WH072石油烴降解酶基因全長序列比對結果見表3。

表3 WH072石油烴降解酶基因全長序列分析Table 3 Analysis of full-length genes encoding hydrocarbon-degrading enzymes of WH072
經過BLASTP比對,WH072的AlkB蛋白與紅燈食烷菌(A.hongdengensis)A-11-3的AlkB1和AlkB2的相似度分別為77%和76%,與泊庫島食烷菌(A.borkumensis)SK2AlkB的相似度為74%;P450蛋白與紅燈食烷菌(A.hongdengensis)A-11-3P450和Alcanivoraxsp.DG881P450的相似度均為95%,與柴油食烷菌(A.dieselolei)P450有92%的相似度;AlmA蛋白與亞德食烷菌(A.jadensis)的AlmA有99%的相似度,但該菌的AlmA只是部分蛋白片段,不是完整蛋白,與泊庫島食烷菌(A.borkumensis)SK2 AlmA和紅燈食烷菌(A.hongdengensis)A-11-3AlmA分別具有90%和86%的相似度。
3 討論
目前已報道能夠降解海洋石油污染物的微生物包括細菌、真菌和藻類,分屬于200多個屬,其中79個屬的細菌可以把石油烴作為唯一的碳源和能源[6-8]。
為海洋石油污染的生物修復提供菌株和基因材料,本研究從實驗室菌種庫中的15株細菌中篩選出5株對石油原油降解效果較好的菌株,其中石油降解率最高的菌株為耐鹽芽孢桿菌WH072,且該菌的石油降解特性為首次報道。芽孢桿菌屬是石油污染區域的優勢菌群之一,本研究中具有一定石油降解特性的WH303也屬于芽孢桿菌屬。Said等和Chikere等均從海洋沉積物中分離到了可以降解石油烴的芽孢桿菌[29-30]。王海峰等分離到的一株枯草芽孢桿菌(B.subtilis)對石油的降解率達到34.3%[31],而本研究中WH072對于原油的降解率達到36.4%,該菌株在石油污染生物修復領域具有較好的開發前景。
海桿菌屬也是分離最多的石油降解菌屬之一,具有較高的出現頻率和多樣性。除烴海桿菌在1992年首次從地中海煉油廠附近的海水中被分離描述,其后又有14種海桿菌被從不同的環境中分離鑒定[32-33]。WH069與除烴海桿菌(M.hydrocarbonoclasticus MBIC1303T)的相似度是98.0%。該菌株對于石油的降解率為20.0%,因此該菌株對于石油污染防治也具有重要應用價值。
烷烴羥化酶AlkB家族和細胞色素P450家族在石油烴降解酶基因中是被研究的最為廣泛和深入的,兩者主要負責短中鏈烷烴的降解,AlmA為最近才報道的專門降解長鏈烷烴的黃素結合蛋白,其研究剛剛起步。很多參與石油降解過程的高效石油降解菌都具有多種石油烴降解酶基因,如高效烷烴降解菌泊庫島食烷菌(A.borkumensis)SK2含有2個alkB基因和1個P450基因[34]。這種多個烷烴羥化酶基因存在于同一菌株中的現象可能有助于提高菌株的降解效率[35]。鑒于這5株菌具有較高的石油降解率,對這5株菌進行石油烴降解酶基因alkB、P450和almA的檢測。本研究在WH069和WH072中都獲得了alkB、P450和almA基因片段,說明這2種菌對長、中、短鏈的烷烴均有降解能力,底物范圍較廣。這與紫外分光光度法所測得的這兩株菌的石油降解率都很高(>20%)相吻合,可能是這兩株菌具有較強石油降解能力的原因。綜合3種石油烴降解酶基因的系統發育分析及其氨基酸序列分析結果,WH072所含有的alkB基因與其他菌株的相似性相對較低,其結構和功能可能與現有菌株有差異。
值得注意的是,與革蘭氏陽性菌之間alkB基因差異較小的情況不同,革蘭氏陰性菌的alkB序列變化多樣。16SrRNA基因系統發育樹的分析能夠比較準確的反映分離的不同石油降解菌在分類學上的地位,但是基于alkB基因的氨基酸序列所構建的系統發育樹,不同菌株所處的系統發育位置發生了明顯改變。這是因為微生物的16SrRNA基因在不同菌種之間相對保守,而alkB基因往往定位于染色體可轉移元件和/或質粒上,能夠在不同菌株間發生轉移。即使基因整合在菌株的染色體上,由于其受到環境因素的影響而不斷發生變異,從而產生該基因的多樣性[24]。即使在同一水域,表層海水和深層海水中同一菌種不同菌株之間的alkB基因也存在很大差異[19]。對于石油烴降解微生物群落,現在研究比較廣泛的是烷烴羥化酶家族基因,而alkB基因是該家族中編碼關鍵酶的基因之一,對菌種所在環境的生態學功能分析具有極其重要的意義。
對比16SrRNA基因系統發育樹可以發現,P450基因與細菌菌種有一定的相關性,WH069和WH072均與自身所在屬的菌種有高度同源性的P450基因。相比較而言,alkB和almA在種間的分布規律性較低,文獻表明alkB和P450基因在食烷菌屬(Alcanivorax)的細菌中廣泛存在[19]。almA基因的研究剛起步,有關報道較少,是當前研究的熱點[16]。耐鹽芽孢桿菌WH072的3種石油烴降解酶基因全長氨基酸序列比對結果表明其與食烷菌屬的石油降解相關功能蛋白具有最高的相似度,推測其功能基因可能來自于食烷菌屬。但是耐鹽芽孢桿菌WH072 alkB基因編碼的蛋白與最相近的食烷菌屬相關蛋白相似度不高(77%),這可能是由基因可轉移元件在菌株間水平轉移過程中發生了結構的改變導致的[24]。在獲得的菌株中,耐鹽芽孢桿菌WH072是本研究新發現的具有石油降解特性的菌種,其石油降解率很高,且功能基因也很新穎,具有極大的研究價值。
石油降解菌廣泛存在于海洋中,它們中很多生存在營養極為缺乏的“海洋沙漠”中,各種與石油降解相關的功能基因保證其能夠適應極端環境,使它們能夠利用石油烴類物質作為營養成分。然而,本文中克隆的基因只是其功能基因的很小一部分,蘊含著巨大遺傳密碼的寶庫正等待著開發。
[1] Speight J G.Fossil Energy[M].New York:Springer-Verlag,2013:61-97.
[2] Hall C A S,Ramírez-Pascualli C A.The First Half of the Age of Oil[M].New York:Springer-Verlag,2013:19-27.
[3] Schühle J H K.Anaerobic biodegradation of hydrocarbons including methane[J].The Prokaryotes:Prokaryotic Physiology and Biochemistry,2013,17:605-634.
[4] 方曦,楊文.海洋石油污染研究現狀及防治 [J].環境科學與管理,2007,32(9):78-80.
[5] 劉金雷,夏文香,趙亮,等.海洋石油污染及其生物修復 [J].海洋湖沼通報,2006,3:48-53.
[6] Head I M,Jones D M,Roling W F M.Marine microorganisms make a meal of oil[J].Nature Reviews Microbiology,2006,4(3):173-182.
[7] Adebusoye S A,Ilori M O,Amund O O,et al.Microbial degradation of petroleum hydrocarbons in a polluted tropical stream [J].World Journal of Microbiology and Biotechnology,2007,23(8):1149-1159.
[8] Yakimov M M,Timmis K N,Golyshin P N.Obligate oil-degrading marine bacteria[J].Current Opinion in Biotechnology,2007,18(3):257-266.
[9] van Beilen J B,Panke S,Lucchini S,et al.Analysis of Pseudomonas putida alkane degradation gene clusters and flanking insertion sequences:evolution and regulation of the alk-genes[J].Microbiology,2001,147:1621-1630.
[10] Smits T H M,Witholt B,van Beilen J B.Functional characterization of genes involved in alkane oxidation by Pseudomonas aeruginosa [J].Antonie Van Leeuwenhoek,2003,84:193-200.
[11] Grogan G,Roberts G A,Parsons S,et al.P450(camr),a cytochrome P450catalysing the stereospecific 6-endo-hydroxylation of(1R)-(+)-camphor[J].Applied Microbiology and Biotechnology,2002,59:449-454.
[12] Matson R S,Hare R S,Fulco A J.Characteristics of a cytochrome P450-dependent fatty acid omega-2hydroxylase fromBacillus megaterium [J].Biochimica et Biophysica Acta,1977,487:487-494.
[13] van Beilen J B,Funhoff E G,van Loon A,et al.Cytochrome P450alkane hydroxylases of the CYP153family are common in alkane-degrading eubacteria lacking integral membrane alkane hydroxylases [J].Applied and Environmental Microbiology,2006,72:59-65.
[14] Throne-Holst M,Wentzel A,Ellingsen T,et al.Identification of novel genes involved in long-chain n-alkane degradation by Acinetobacter sp.strain DSM 17874 [J].Applied and Environmental Microbiology,2007,73:3327-3332.
[15] Wentzel A,Ellingsen T E,Kotlar H K,et al.Bacterial metabolism of long-chain n-alkanes[J].Applied Microbiology and Biotechnology,2007,76:1209-1221.
[16] Wang W P,Shao Z Z.Diversity of flavin-binding monooxygenase genes(almA)in marine bacteria capable of degradation long-chain alkanes[J].FEMS Microbiology Ecology,2012,80(3):523-533.
[17] 大慶石油管理局油田建設設計研究院.SY/T 0530-93中華人民共和國石油天然氣行業標準:油田污水中含油量測定方法——分光光度法[S].北京:華興科標圖書有限公司,1994.
[18] Wang Y,Yu M,Austin B.Oleispiralentasp.nov.,a novel marine bacterium isolated from Yellow sea coastal seawater in Qingdao,China[J].Antonie van Leeuwenhoek,2012,101(4):787-794.
[19] Wang L P,Wang W P,Lai Q L,Shao Z Z.Gene diversity of CYP153Aand AlkB alkane hydroxylases in oil-degrading bacteria isolated from the Atlantic Ocean[J].Environmental Microbiology,2010,12(5):1230-1242.
[20] Wang W,Wang L,Shao Z.Diversity and abundance of oil-degrading bacteria and alkane hydroxylase(alkB)genes in the subtropical seawater of Xiamen Island[J].Microbial Ecology,2010,60(2):429-439.
[21] Wang X B,Chi C Q,Nie Y.Degradation of petroleum hydrocarbons(C6-C40)and crude oil by a novel Dietziastrain[J].Bioresource Technology,2011,102(17):7755-7761.
[22] 嚴書林.3株新菌的分類鑒定及新型耐熱膠瓊酶基因的克隆表達[D].青島:中國海洋大學,2011.
[23] Liu Y G,Chen Y.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].Bio-Techniques,2007,43:649-656.
[24] 于寒穎,楊慧.石油烴降解酶及其基因的結構,功能和表達調控[J].應用與環境生物學報,2012,18(6):1066-1074.
[25] Atlas R M.石油微生物學 [M]//Huang D F,Tan S,Yang W K,等譯.北京:石油工業出版社,1991.
[26] van Beilen J B,Li Z,Duetz W A,et al.Diversity of alkane hydroxylase systems in the environment[J].Oil & Gas Science and Technology-Revue De L Institut Francais Du Petrole,2003,58(4):427-440.
[27] 徐馮楠,馮貴穎,馬雯,等.高效石油降解菌的篩選及其降解性能研究 [J].生物技術通報,2010,7:221-226.
[28] Ramos J L,Marqués S.Transcriptional control of the Pseudomonas Tol plasmid catabolic operons is achieved through an interplay of host factors and plasmid-encoded regulators[J].Annual Review of Microbiology,1997,51:341-373.
[29] Ben Said O,Goni-Urriza M S,El Bour M,et al.Characterization of aerobic polycyclic aromatic hydrocarbon-degrading bacteria from Bizerte lagoon sediments,Tunisia[J].Journal of Applied Microbiology,2008,104(4):987-997.
[30] Chikere C B,Okpokwasili G C,Ichiakor O.Characterization of hydrocarbon utilizing bacteria in tropical marine sediments[J].African Journal of Biotechnology,2009,8(11):2541-2544.
[31] 王海峰,包木太,韓紅,等.一株枯草芽孢桿菌分離鑒定及其降解稠油特性 [J].深圳大學學報:理工版,2009,26(3):221-227.
[32] Gauthier M J,Lafay B,Christen R,et al.Marinobacter hydrocarbonoclasticus gen.nov.,sp.nov.,a new,extremely halotolerant,hydrocarbon-degrading marine bacterium [J].International Journal of Systematic Bacteriology,1992,42(4):568-576.
[33] Green D H,Bowman J P,Smith E A,et al.Marinobacter algicola sp.nov.,isolated from laboratory cultures of paralytic shellfish toxin-producing dinoflagellates[J].International Journal of Systematic and Evolutionary Microbiology,2006,56(3):523-527.
[34] Schneiker S,dos Santos V A P M,Bartels D,et al.Genome sequence of the ubiquitous hydrocarbon-degrading marine bacterium Alcanivorax borkumensis [J].Nature Biotechnology,2006,24(8):997-1004.
[35] 孫敏,沈先榮,侯登勇,等.高效柴油降解菌Acinetobacter sp.W3分離鑒定及降解酶基因擴增分析 [J].生物技術通報,2012,6:159-165.

