正交試驗法優選沙蓯蓉提取工藝
楊振亞,盧丹逸,馬志國
(暨南大學藥學院,廣東廣州 510632)
沙蓯蓉為列當科植物沙蓯蓉Cistanche sinensis G.Beck 的干燥帶鱗葉的肉質莖[1],具有溫陽益精、潤腸通便功效,用于腎虛陽衰癥、腸燥便秘,主要分布于陜西、甘肅、寧夏、青海、內蒙古等地[2]。文獻報道,沙蓯蓉化學成分主要為苯乙醇苷類、環烯醚萜苷類以及多糖類化合物,苯乙醇苷類化合物是其中最重要的一類活性成分[1,3]。本課題組前期實驗結果表明,毛蕊花糖苷、金石蠶苷、2'-乙酰基金石蠶苷為沙蓯蓉中主要的苯乙醇苷類成分[4],其中,毛蕊花糖苷、金石蠶苷具有抗氧化活性[5-9]及神經保護作用[10-13]。目前,有關沙蓯蓉中苯乙醇苷的提取工藝研究尚未見報道。因此,本研究以沙蓯蓉為原材料,以3個苯乙醇苷的提取率為指標,通過正交試驗確定其最佳提取工藝,為進一步開發和利用此藥材提供研究資料。
1 儀器與試藥
1.1 藥材 沙蓯蓉藥材購自廣州清平藥材市場,經中國中醫科學院中醫藥發展研究中心圖雅教授鑒定為Cistanche sinensis G.Beck的干燥肉質莖。
1.2 試藥 甲醇 (上海晶純實業有限公司)為色譜純,實驗用水為純凈水 (華潤怡寶食品飲料有限公司),其他試劑均為分析純。毛蕊花糖苷、金石蠶苷和2'-乙酰基金石蠶苷為實驗室自制 (利用1H-NMR、13C-NMR、MS等波譜技術鑒定了化學結構),HPLC檢出純度均大于98%。
1.3 儀器 Agilent 1200型高效液相色譜儀,DAD檢測器,四元低壓梯度泵,在線真空脫氣機,自動進樣器,柱溫箱。KQ-250E型超聲波清洗器 (昆山市超聲儀器有限公司);DFY-200搖擺式高級中藥粉碎機 (溫嶺市中德中藥機械有限公司)。
2 方法與結果
2.1 指標成分的測定[4]
2.1.1 色譜條件 采用Agilent TC-C18色譜柱 (250 mm×4.6 mm,5 μm),柱溫30℃;流動相為甲醇 (A)-0.1%甲酸 (B),梯度洗脫 (0 min,35%A;30 min,50%A),體積流量1.0 mL/min,檢測波長330 nm。
2.1.2 對照品溶液的制備 取對照品毛蕊花糖苷、金石蠶苷和2'-乙酰基金石蠶苷適量,精密稱定,加50%甲醇制成每1 mL含毛蕊花糖苷、金石蠶苷、2'-乙酰基金石蠶苷分別為1.07、5.17、4.98 mg的混合溶液,即得。
2.1.3 供試品溶液的制備 取正交試驗各提取液,過微孔濾膜 (0.45 μm),取續濾液,進樣20 μL,按照上述色譜條件,測定,即得。
2.2 正交試驗 在預試驗的基礎上,選擇乙醇體積分數(A)、溶劑用量 (B)、提取時間 (C)、提取次數 (D)四個因素進行考察,各因素均確定為三個水平,然后根據所制定的因素水平選用L9(34)正交表來安排試驗,見表1。
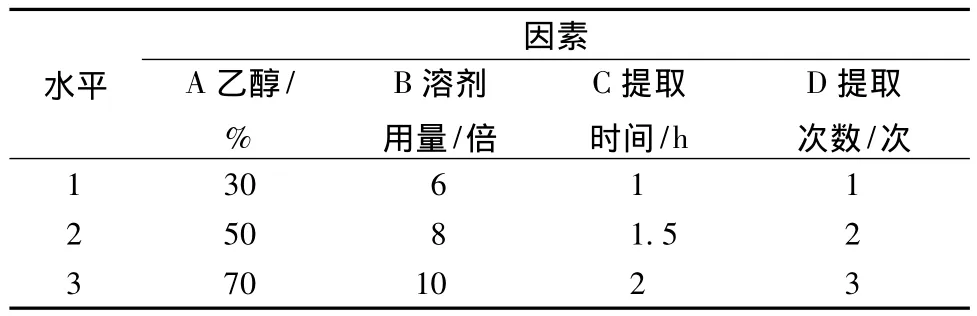
表1 提取工藝因素水平
準確稱取沙蓯蓉飲片9份,每份100 g,根據正交設計的試驗條件,以各提取液中毛蕊花糖苷、金石蠶苷、2'-乙酰基金石蠶苷3個指標成分得量為評價指標,進行工藝優選。以9個試驗中各指標成分得量最大者計為10分,其余8個按比例折算,三個指標得分之和計為總分,對結果進行分析,得到表2、表3。
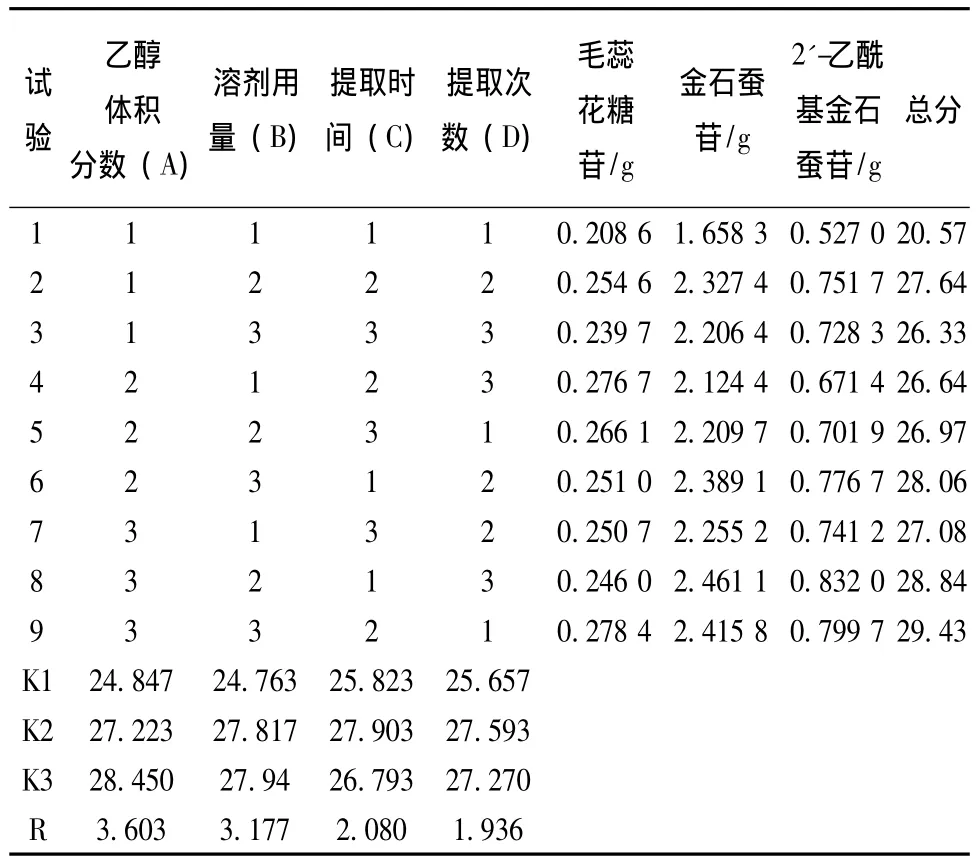
表2 正交試驗結果
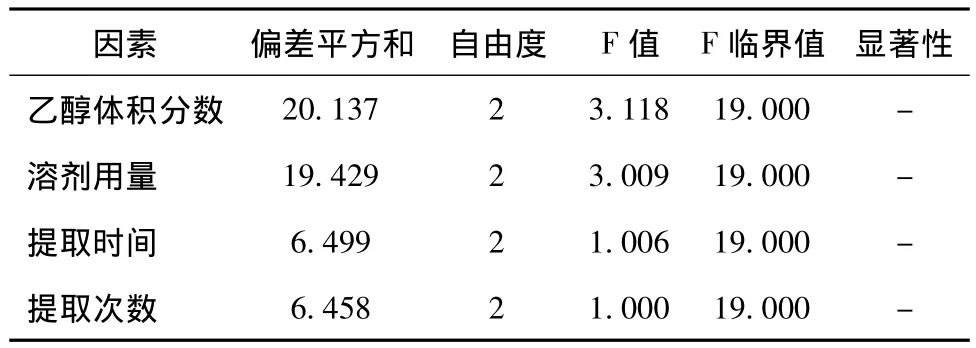
表3 方差分析
方差結果顯示,乙醇體積分數、乙醇用量、提取時間、提取次數四個因素均無顯著性差異,所以采用直觀分析。根據極差值,影響因素順序為A>B>C>D。乙醇體積分數 (A)為主要因素,且A3>A2>A1,故選其最優水平A3;溶劑用量 (B)為次要因素,從極差分析B2與B3相當,二者均明顯優于B1,從節省角度考慮應選B2;提取時間 (C)極差較小,從節省時間角度考慮應選C1,但考慮到大生產時投料量大,提取效果差,提取時間應適當延長,且C2>C3>C1,故選擇提取時間C2;提取次數D極差較小,從極差分析D2與D3相當,二者均明顯優于D1,從節省角度考慮應選D2;因此最佳提取工藝為A3B2C2D2,即分別用8倍量70%乙醇回流提取2次,每次1.5 h。
2.3 驗證試驗 準確稱取2份不同批次的沙蓯蓉飲片,每份200 g,按優選的提取工藝進行提取,測定提取液中指標成分的量。另外,采用文獻 [4]方法測定藥材中3個指標成分的量,計算各指標成分的提取率,結果見表4。
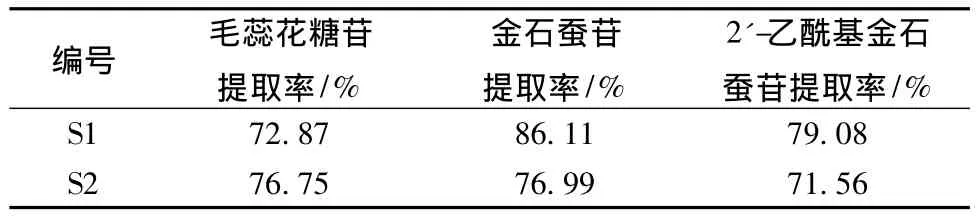
表4 驗證試驗
由表4可知,3個指標成分提取率均大于71.56%,表明優選的提取工藝提取率較高,工藝穩定。
3 討論
3.1 沙蓯蓉中化學成分復雜,為了全面地評價提取工藝的優劣,應選擇活性成分作為指標對工藝進行評價。沙蓯蓉中苯乙醇苷類化合物是其最重要的一類活性成分,而毛蕊花糖苷、金石蠶苷、2'-乙酰基金石蠶苷又是其中的主要成分,因此選擇毛蕊花糖苷、金石蠶苷、2'-乙酰基金石蠶苷作為指標成分對工藝進行評價。
3.2 本實驗通過正交試驗法對沙蓯蓉苯乙醇苷的提取工藝條件進行了優化,確定了最佳提取工藝為用8倍量70%乙醇回流提取2次,每次1.5 h。該工藝條件簡單可行,提取率較高,為進一步開發利用沙蓯蓉提供了科學依據。
[1]Tu P F,Shi H M,Song Z H,et al.Chemical constituents of Cistanche sinensis[J].J Asian Nat Prod Res,2007,9(1):79-84.
[2]沈保安.中國常用中草藥[M].合肥:安徽科技出版社,2005:326.
[3]Jiang Y,Li S P,Wang Y T,et al.Differentiation of Herba Cistanches by fingerprint with high-performance liquid chromatography-diode array detection-mass spectrometry[J].J Chromatogr A,2009,1216(11):2156-2162.
[4]馬志國,甘穩城.RP-HPLC同時測定沙蓯蓉中3種苯乙醇苷的含量[J].藥物分析雜志,2012,24(7):1385-1387.
[5]Xiong Q,Hase K,Tezuka Y,et al.Acteoside inhibits apoptosis in D-galactosamine and lipopolysaccharide-induced liver injury[J].Life Sci,1999,65(4):421-430.
[6]Chiou W F,Lin L C,Chen C F.Acteoside protects endothelial cells against free radical-induced oxidative stress[J].J Pharm Pharmacol,2004,56(6):743-748.
[7]Lee K J,Woo E R,Choi C Y,et al.Protective effect of acteoside on carbon tetrachloride-induced hepatotoxicity[J].Life Sci,2004,74(8):1051-1064.
[8]Tai B H,Jung B Y,Cuong N M,et al.Total Peroxynitrite scavenging capacity of phenylethanoid and flavonoid glycosides from the flowers of Buddleja officinalis[J].Biol Pharm Bull,2009,32(12):1952-1956.
[9]He Z D,Lau K M,Xu H X,et al.Antioxidant activity of phenylethanoid glycosides from Brandisia hancei[J].J Ethnopharmacol,2000,71(3):483-486.
[10]Koo K A,Kim S H,Oh T H,et al.Acteoside and its aglycones protect primary cultures of rat cortical cells from glutamate-induced excitotoxicity[J].Life Sci,2006,79(7):709-716.
[11]Pu X,Song Z,Li Y,et al.Acteoside from Cistanche salsa inhibits apoptosis by 1-methyl-4-phenylpyridinium ion in cerebellar granule neurons[J].Planta Med,2003,69(1):65-66.
[12]高 燕,蒲小平.類葉升麻苷抗魚藤酮致SH-SY5Y細胞損傷機制的研究[J].中國藥理學通報,2007,23(2):161-165.
[13]Koo K A,Sung S H,Park O H,et al.In vitro neuroprotective activities of phenylethanoid glycosides from Callicarpa dichotoma[J].Planta Med,2005,71(8):778-780.

