雙氯芬酸鈉-β-環糊精聚合物緩釋微球的制備與釋藥考察
王曉明,秦凌浩,鄭麗嫻,鄭青,譚載友
(廣東藥學院藥科學院,廣州 510006)
環糊精聚合物(cyclodextrin polymer,CDP)是基于環糊精的聚合物,這種聚合物既能保持環糊精包結、緩釋、催化和識別的能力,又兼具高聚物的特性,如良好的機械強度、較好的穩定性、環境敏感性、滲透擴散性和化學可調性等[1]。研究表明,CDP可以實現藥物的緩釋控釋,且其增加水難溶性藥物的溶解度、溶解速率和提高藥物生物利用度的效果明顯優于環糊精單體[2]。隨著高分子科學的發展,環糊精聚合物已成為當今的熱點研究方向之一。雙氯芬酸鈉(diclofenac sodium,DFS)為第2代非甾體解熱鎮痛抗炎藥,具有使用劑量小、療效高、起效快、不良反應少的特點[3]。但由于其在水中的溶解度很低,對胃黏膜的刺激性大,半衰期短而需頻繁給藥等缺點影響其廣泛使用[4]。因此,本研究以 β-環糊精聚合物(β-CDP)為載體材料,制備雙氯芬酸鈉-β-CDP緩釋微球,優化其制備工藝,并考察其釋藥特征,旨在降低其對胃黏膜刺激、減少給藥次數,為以后進一步制成適宜的劑型提供前期工作基礎。
1 儀器與試藥
1.1 儀器 UV-1810紫外-可見分光光度計(上海分析儀器廠),Q600 SDT型熱分析儀(美國 TAINC公司),CS501型超級恒溫器(重慶實驗設備廠),JJ-1型增力電動攪拌器(江蘇省金壇市宏華儀器廠),DZF-6020型真空干燥箱(上海迅博實業有限公司),IX51光學顯微鏡(OLYMPUS BX-50),S-520 Scanning Electron Microscope(日本HITACHI),氣浴恒溫振蕩器(江蘇省金壇市宏華儀器廠),KQ-100型超聲波清洗器(昆山市超聲儀器有限公司)。
1.2 試藥 雙氯芬酸鈉對照品(中國食品藥品檢定研究院,批號:10334-0001),雙氯芬酸鈉原料藥(河南東泰制藥有限公司,批號:110812,標示量98%),β-CD[生化試劑,中國醫藥(集團)上海化學試劑公司,批號:20100812],環氧氯丙烷(epichlorohydrin,EPI,分析純,天津福晨化學試劑廠,批號:20110302),無煙煤油(天津億茂化工集團,批號:20120608),司盤80(化學純,天津市大茂化學試劑廠,批號:20110801),聚山梨酯20(化學純,天津市福晨化學試劑廠,批號:20110317)等。
2 方法與結果
2.1 β-CDP空白微球的制備 根據文獻[5],精密稱取β-CD12 g,加入適量40%氫氧化鈉溶液,加熱溶解。在30℃、恒速攪拌下,緩慢滴加 EPI 12.5mL,反應1.5 h。在高速攪拌下,加入含有混合乳化劑(司盤80∶聚山梨酯20=3∶1,即司盤80為1.2 g、聚山梨酯20為0.4 g)的煤油 80 g,10 min后降低攪拌速度至800 r·min-1,升溫至50℃,繼續攪拌反應6 h。反應結束后,靜置30 min,傾去上層油相,將產品抽濾,并依次用稀鹽酸、乙醇、純化水、丙酮充分洗滌后抽干,以除去各種雜質。置于通風櫥內于室溫下晾干,然后用真空干燥箱于60℃下干燥至恒重,即得β-CDP空白微球。
2.2 β-CDP載藥微球(DFS-β-CDP)的制備 取 DFS適量,溶解于無水乙醇20mL中,然后加入經干燥的β-CDP空白微球(MS)1 g,于一定溫度下浸泡若干小時。載藥結束后,冷卻至室溫,用純化水沖洗微球表面,抽干,于60℃下真空干燥至恒重,即得載藥微球。本研究通過正交設計對藥物溶液濃度、載藥溫度、微球與藥物質量比、載藥時間4個因素進行考察,每個因素取3個水平(表1)。選擇L9(34)的正交實驗表進行實驗,以載藥率(C,%)(S1)和包封率(En,%)(S2)的綜合評分指標(S)為評價指標,根據 S=0.3(S1/S1最大)+0.7(S2/S2最大)計算,對結果進行分析。實驗結果和方差分析見表2和表3。表2的極差分析結果表明:4個因素對微球綜合評分指標的影響順序是:A>B>C>D,即DFS濃度>載藥溫度>微球與藥物質量比>載藥時間。從表3的方差分析可以看出,DFS濃度對實驗結果具有顯著性影響(P<0.05)。綜合考慮載藥率與包封率,又要降低工藝成本,最終確定制備DFS-β-CDP微球的最佳工藝條件為A3B2C1D1,即DFS濃度為30%,載藥溫度45℃,微球與藥物質量比為1∶1,載藥時間24 h。
2.3 制備工藝的驗證 通過對上述最佳處方工藝進行驗證實驗,制備6批DFS-β-CDP微球,確定在該條件下制得的微球載藥率為(12.384±0.214)%、包封率為(45.372±2.121)%(n=6),說明所確定的最優工藝條件穩定,重復性好。
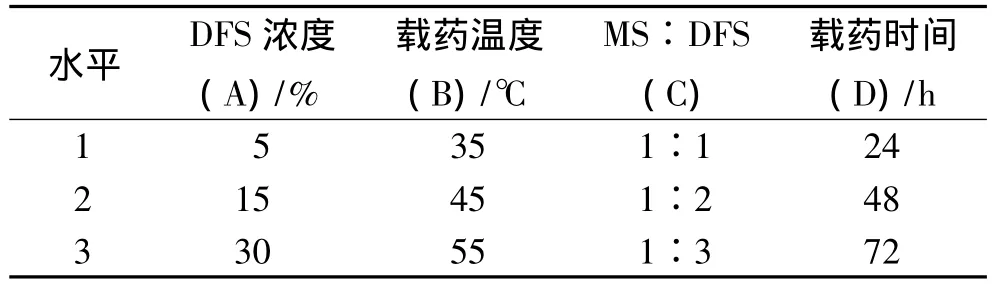
表1 L9(34)因素水平表Tab.1 Factors and levels of the orthogonal test
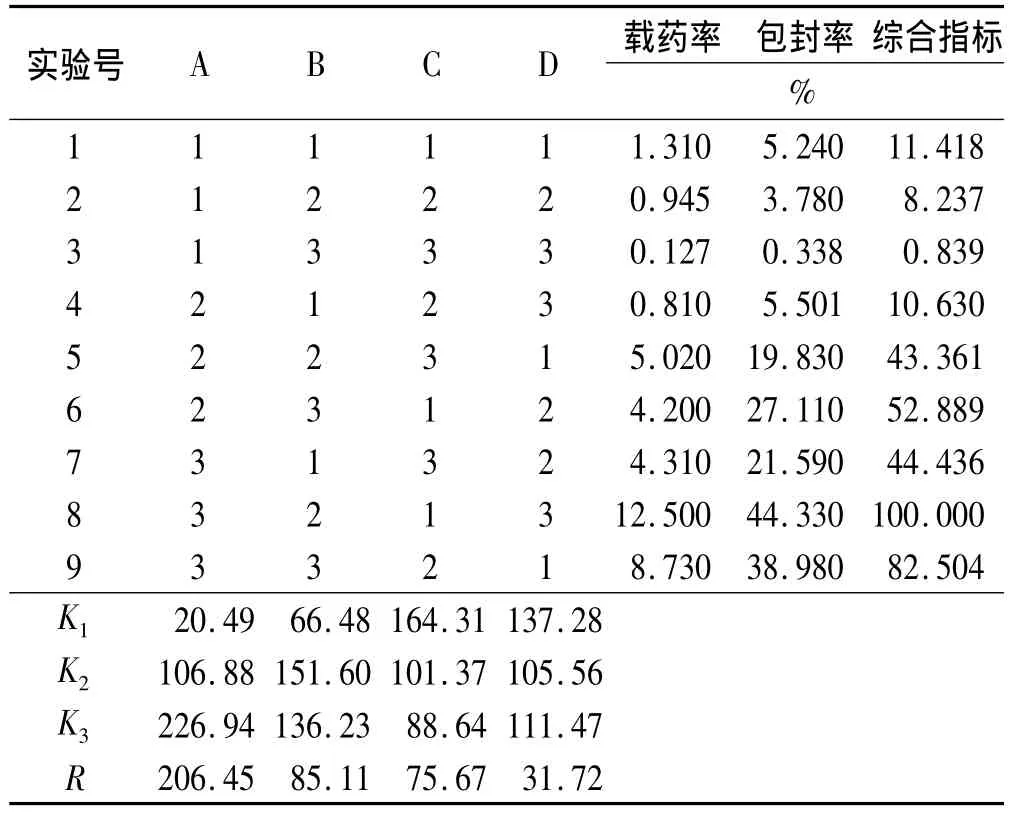
表2 正交設計與實驗結果Tab.2 Design and results of the orthogonal test
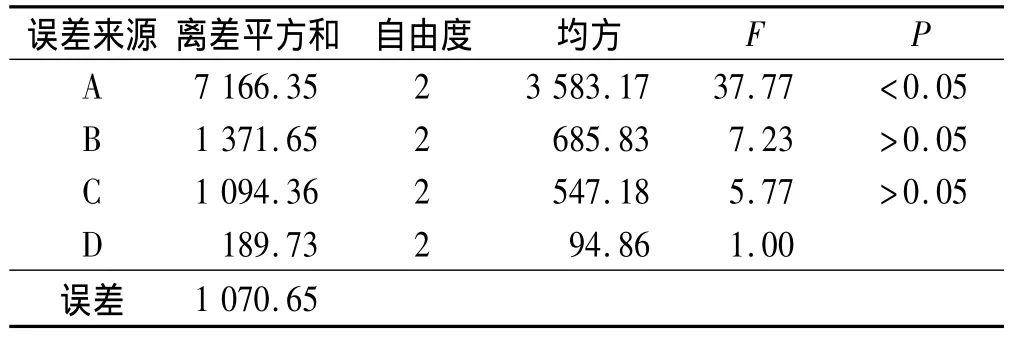
表3 綜合指標方差分析Tab.3 Variance analysis of comprehensive index
2.4 DFS-β-CDP微球載藥率及包封率的測定 采用紫外-可見分光光度法測定微球的載藥率及包封率。具體操作如下:精密稱取DFS-β-CDP微球50 mg,研細,置于100mL量瓶中,加入2mmol·L-1氫氧化鈉適量,超聲30 min,加2mmol·L-1氫氧化鈉溶液定容,搖勻。經孔徑0.45μm微孔濾膜過濾后用分光光度計于276nm處測定吸光度(A)。根據已測得的標準曲線方程(精密稱取DFS對照品 25 mg,置于100mL量瓶,加入2mmol·L-1氫氧化鈉溶解并定容。分別吸取1,2,3,4,5mL于50mL量瓶,加2mmol·L-1氫氧化鈉溶液定容,搖勻。用分光光度計于276nm處測定吸光度(A)。以A值對質量濃度(ρ)進行線性回歸,得回歸方程A=0.0327ρ +0.0546,r=0.9997(n=6)。求得 DFS 的含量,并按照以下公式計算載藥率及包封率。載藥率(%)=微球中實際藥量/微球總量×100%;包封率(%)=微球中實際藥量/投藥量×100%。
2.5 DFS-β-CDP 微球的結構表征
2.5.1 微球粒徑大小及表面形態 采用光學顯微鏡觀察微球的粒徑分布,平均粒徑為(99.47±3.50)μm,跨距為(1.00±0.21)μm(n=6)。使用掃描電子顯微鏡觀察微球的表面形態和分散性。結果表明,制得的DFS-β-CDP微球表面光滑而圓整,形態見圖1。
2.5.2 熱分析 微球中藥物和聚合物的形態以及相互作用對微球載體的性能有很大影響。藥物與聚合物的親和性不同,體現在二者之間存在的相互作用。本研究用美國TAINC公司的Q600 SDT型熱分析儀測定了下列樣品的熱重分析(thermogravimetry analysis,TGA)和差熱分析(differential scanning calorimetry,DSC):DFS、β-CDP 微球、DFS-β-CDP 微球,考察雙氯芬酸鈉制成微球后的熱穩定性。具體步驟:將樣品研成細粉,稱取5~10 mg置于樣品池中。以相同的空白坩堝為內置空白,實驗在氮氣(N2)氣氛中(流速為20mL·min-1)進行,升溫范圍20~500℃,控制升溫速率為5℃·min-1。分別測定3種樣品的TGA-DSC曲線,結果見圖2。由圖2可知,對于DFS,在276.44℃處的熔融峰表明藥物的晶體形態。β-CDP微球開始分解溫度為275℃,當溫度高于455℃后,總失重達80.66%,之后基本不再隨溫度變化,失重可能是由聚合物中環氧氯丙烷的揮發所致;而DFS-β-CDP微球具有一個全新的熱分析圖譜,開始分解的溫度為250℃,當溫度高于485℃后,總失重達80%,之后基本不再隨溫度變化;且整個圖中不存在雙氯芬酸鈉的熔融峰,這表明藥物以無定形的狀態分散在聚合物載體中。由此說明,雙氯芬酸鈉制成微球后,其與β-CDP之間存在著較強的相互作用,并具有良好的熱穩定性[5]。

圖1 DFS-β-CDP微球的掃描電鏡照片Fig.1 Scanning electron microscopy picture of DFS-β-CDP MS
2.6 體外釋放度考察
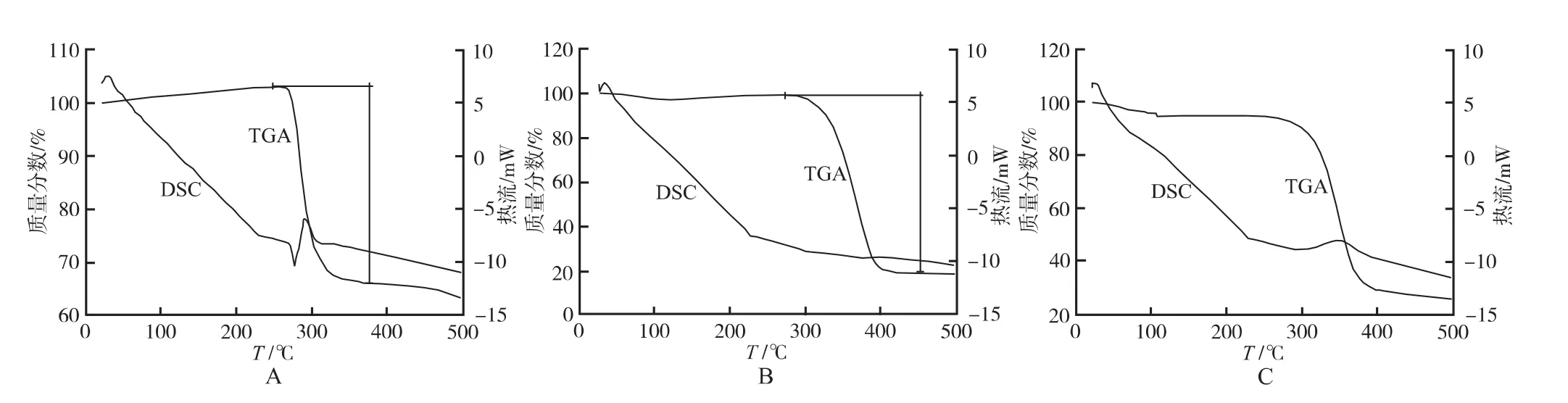
圖2 DFS(A)、β-CDP微球(B)和DFS-β-CDP微球(C)的熱重分析和差熱分析Fig.2 Gravitational thermal analysis and thermal differential analysis of DFS(A),β-CDP microsphere(B)and DFS-β-CDP microsphere(C)
2.6.1 測定波長的確定 ①對照品溶液的制備:取DFS對照品適量,置于100mL量瓶中,以少量乙醇溶解后用pH6.8磷酸緩沖液稀釋至刻度,搖勻備用。②輔料溶液的制備:取空白微球適量,加入少量乙醇,超聲30 min后經孔徑0.45μm微孔濾膜過濾,取續濾液置于100mL量瓶中并用 pH6.8磷酸緩沖溶液(phosphate buffered saline,PBS)稀釋至刻度。照《中華人民共和國藥典》2010版二部附錄ⅣA分光光度法,在200~400nm波長內掃描,結果見圖3。由圖3可知,DFS在276.5nm處有最大吸收,而空白微球在此處幾乎無吸收,可見其對藥物的測定無干擾,故選擇276.5nm作為檢測波長。
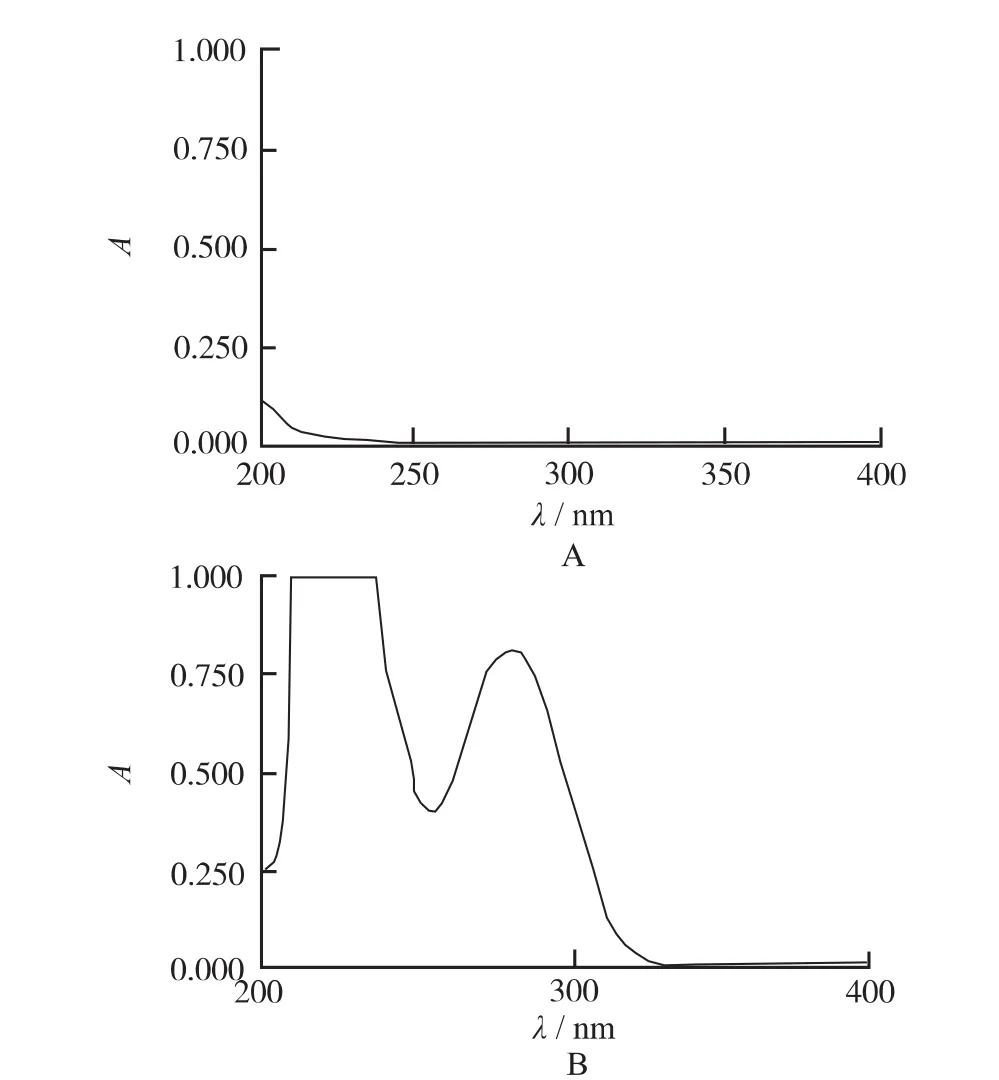
圖3 β-CDP微球(A)和DFS(B)的紫外掃描圖譜Fig.3 UV scanning spectrum of β-CDP microsphere(A)and DFS(B)
2.6.2 標準曲線的制備 精密稱取對照品適量,用pH6.8PBS配制成一系列不同濃度的對照品溶液。在276.5nm波長處測定吸光度(A),以A值對質量濃度(ρ)進行線性回歸,得回歸方程:A=0.032ρ +0.0102,r=0.9999,(n=6)。結果表明,DFS在5 ~25 mg·L-1的濃度范圍內,吸光度與質量濃度線性關系良好。
2.6.3 精密度考察 分別配制低、中、高3種濃度的對照品溶液,測定A值,按照回歸方程計算實測濃度,考察方法的日內變異和3 d的日間變異,日內RSD值分別為 0.78%,0.57%,0.43%,日間 RSD 值分別為0.66%,0.27%,0.21%(n=6)。結果表明方法的精密度良好。
2.6.4 穩定性考察 取對照品溶液及供試品溶液,分別于0,1,2,4,8 h 進行 A 值測定,考察樣品的穩定性。結果在8 h內對照品溶液與供試品溶液A值的RSD值分別為0.40%,1.23%(n=6)。結果表明樣品溶液在8 h內測定穩定性良好。
2.6.5 回收率測定 精密稱取干燥至恒重的DFS 20,25,30 mg,置于100mL 量瓶中,加 pH6.8PBS 適量使完全溶解,再分別加入粉碎后的空白微球 60,75,90 mg,超聲30 min后經孔徑0.45μm微孔濾膜過濾,取續濾液稀釋至適當濃度后,于276.5nm波長處測定A值,代入標準曲線方程計算樣品的回收率。結果表明方法的平均回收率為98.74%,RSD=0.52%(n=6)。
2.6.6 釋放度的測定 精密稱取載藥微球適量,置于透析袋中,加入釋放介質2mL,扎緊透析袋,懸浮于具塞玻璃瓶中。透析袋外加入pH6.8 PBS 98mL。置于氣浴恒溫振蕩器中,溫度保持(37±1)℃振蕩,定時取出釋放介質5mL,同時補充同體積介質。釋放液經孔徑0.45μm微孔濾膜過濾,在276.5nm 波長處測定 A值,計算藥物累積釋放百分率。
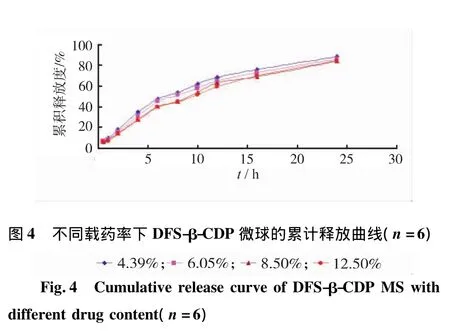
2.6.6.1 不同載藥量對微球體外釋放的影響 圖4為不同含藥量下DFS-β-CD微球的釋放曲線。由圖4可見,隨著藥物含量的增加,釋放速率略有降低。
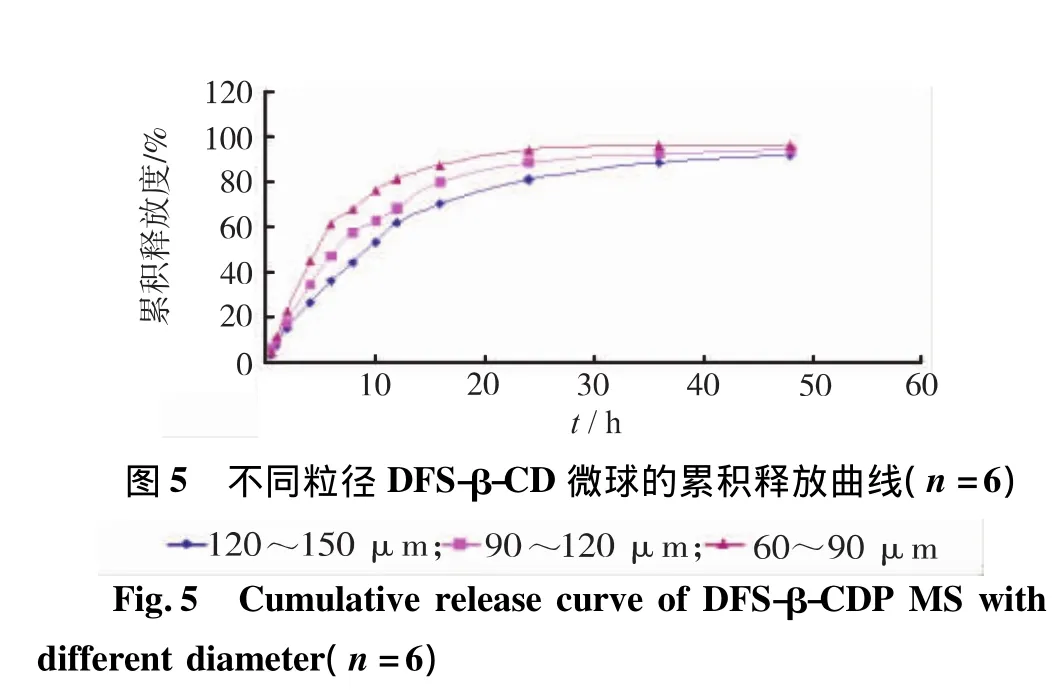
2.6.6.2 不同粒徑對微球體外釋放的影響 圖5為不同粒徑的DFS-β-CD微球在pH6.8PBS中的釋放曲線。從圖5中可以看到,釋放曲線隨著粒徑的增大而降低。較小粒徑的微球由于擴散路徑較短,且擴散時的比表面積較大,因此藥物的釋放速率較高。由此可見,改變粒徑大小可以作為控制藥物釋放速率的有效手段。
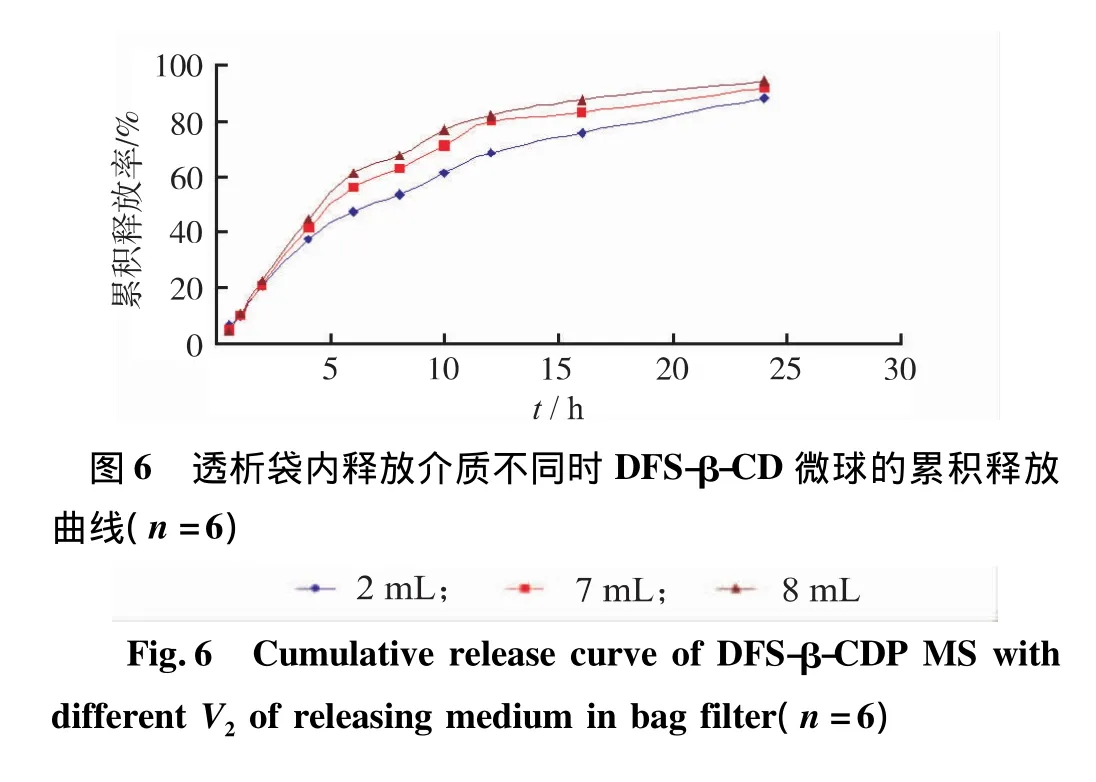
2.6.6.3 透析袋內介質的體積對微球體外釋放的影響 為考察透析袋內釋放介質對微球釋藥速度的影響,本研究使透析袋內釋放介質的體積V2分別為:2mL、7mL和8mL,而透析袋外釋放介質的體積V1為(100-V2)mL,釋藥結果見圖6。由圖6可知,透析袋內釋放介質的體積對DFS-β-CDP微球的釋藥速度有一定的影響。開始階段,3種情況相差不大;隨后,隨著透析袋內釋放介質體積的增大,釋放速率略有增大,這主要是因為隨著透析袋內溶液體積的增加,微球溶脹后袋內溶液的黏度降低,使得藥物的溶解速率增大。同時說明,藥物從袋內向袋外擴散的速率與袋內藥物溶液的濃度無關。
2.6.6.4 不同pH值對微球體外釋放的影響 為考察不同pH值釋放介質對微球釋藥速度的影響,本研究使透析袋內釋放介質的體積V2為2mL,透析袋外釋放介質的體積V1為98mL。DFS-β-CDP微球在不同pH的PBS中的釋放曲線見圖7。結果表明,溶液的pH對藥物的釋放速率影響很大,釋放速率隨著pH的增大而加快,這是由于雙氯芬酸鈉的溶解度隨pH的增大而增大的緣故。
2.6.7 藥物釋放的模型擬合 反復測定最佳工藝條件下制得的DFS-β-CDP微球在pH6.8 PBS中的釋放曲線,結果見圖8。如圖所示,最佳工藝條件下制得的DFS-β-CDP微球無明顯的突釋現象,到24 h藥物才基本釋放完全。以零級、一級動力學方程、Higuchi方程進行擬合,結果表明藥物釋放行為符合一級動力學方程 ln( 1 -Q)= -0.0716 -0.0822t(r=0.9927)。這說明,DFS經聚合物微球的包載后具有明顯的緩釋效果,原因在于它能與β-CDP微球的網狀孔隙及β-CD的空腔充分地嵌合,主客體之間的結合力較強。此外,圖9為微球釋藥前后的掃描電鏡圖片。由圖可見,釋藥后微球表面粗糙、疏松多孔,可見,這些孔道的存在是藥物擴散的主要通道。釋放后的微球形狀仍然保持完整的球形,因此可以判斷,當以pH6.8 PBS為釋放介質時,β-CDP微球未發生溶蝕、降解等。
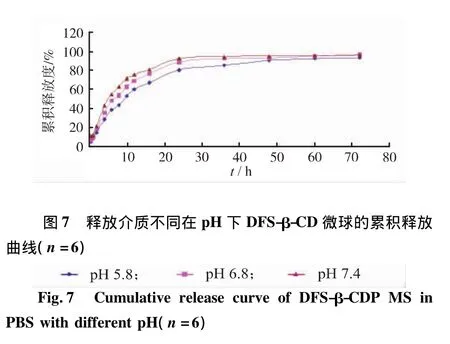
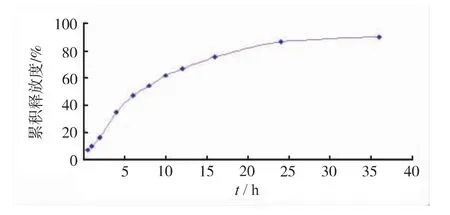
圖8 DFS-β-CDP微球的累積釋放曲線(n=6)Fig.8 Cumulative release curve of DFS-β-CDP MS(n=6)
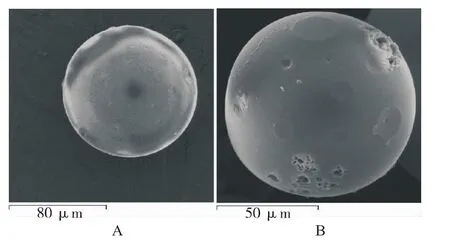
圖9 DFS-β-CDP微球釋放前后的掃描電鏡照片A.釋放前;B.釋放后Fig.9 SEM picture of DFS-β-CDP before release and after releaseA.before release;B.after release
3 討論
本研究以β-CD為原料、EPI為交聯劑、并以水相作為分散相、有機相煤油作為連續相、司盤80和聚山梨酯20為乳化劑,在強堿性條件下,采取反相聚合技術制備藥物控制釋放載體β-CDP微球。該技術具有聚合速率高、聚合物分子量高、得到的乳膠通過調節體系的pH或加入適當乳化劑的方法能使聚合物迅速地溶于水等優點。
本研究通過正交設計,確定制備DFS-β-CDP緩釋微球的最佳工藝條件為:DFS濃度30%,載藥溫度45℃,微球與藥物質量比為1∶1,載藥時間24 h。微球的體外釋放可以很好地用緩釋模型進行擬合。
體外釋放影響因素考察結果表明,不同的pH、袋內釋放介質體積、載藥率和粒徑對藥物的釋放有明顯影響,其中粒徑的影響最大。事實上,影響微球釋放速率的其他因素很多,包括微球的致密性、藥物在微球中的分散水平、組分間的親和作用等,它們對藥物的溶出和擴散都有影響,微球性質的變化是這些因素的綜合結果。
[1]MARTIN E M,VALLE D.Cyclodextrins and their uses:a review[J].Process Biochemistry,2004,39(9):1033 -1046.
[2]MARK E.DAVIS,MARCUS E B.Cyclodextrin-baesd pharmaceutics:past,present,future[J].Nature Reviews:Drug Discovery,2004,3(12):1023 -1035.
[3]陳新謙,金有豫,湯光.新編藥物學[M].17版,北京:人民衛生出版社,2011:188.
[4]彭衛珍,陳華,孔令春.雙氯芬酸鈉致不良反應46例分析[J].醫藥導報,2012,31(3):392 -394.
[5]王曉明,譚載友,曹磊,等.聚β-環糊精微球的制備及結構表征[J].廣東藥學院學報,2009,25(3):226 -227.

