茄子遺傳轉化植株再生體系的優化
張明華,陳鈺輝,劉富中,張映,連勇
(中國農業科學院蔬菜花卉研究所,北京,100091)
茄子(Solanum melongena L.)是世界各地廣泛栽培的重要蔬菜之一,營養價值豐富,為加快育種進程,國內外已先后從茄子的器官分化[1,2]、花藥培養[3]、胚狀體誘導[4~6]、原生質體培養[7]、小孢子培養[8,9]子葉與下胚軸離體再生[10~12]等多方面進行了研究。近30 a來,國內的茄子組織培養研究工作取得了很大進展,但是和同科同屬的番茄[13]、馬鈴薯[14]相比,仍有一定距離。茄子再生體系研究面臨的一個主要難題就是不定芽分化頻率較低,缺少通用穩定的適于茄子遺傳轉化的植株再生體系。因此探索高效的受體再生途徑,建立完善的遺傳轉化體系是目前的主要任務。本試驗在課題組已有茄子離體培養研究的基礎上[15],探討了不同外植體、激素配比、基因型等因素對茄子離體培養植株再生的影響。通過對植株再生體系的優化,以期得到普遍適用的茄子離體培養再生體系,提高茄子遺傳轉化率,促進基因工程在茄子改良育種中的應用。
1 材料與方法
1.1 試驗材料
供試茄子品種為中國農業科學院蔬菜花卉研究所選育的高代自交系長茄03154、03204,圓茄07683、07675。以種子露白后苗齡10 d的茄子下胚軸、子葉作為外植體。
1.2 無菌苗培養及外植體接種
將茄子種子用75%酒精浸泡30 s,后用無菌水沖洗1次,再用10%NaClO溶液浸泡20 min后用無菌水沖洗3次。接種至附加0.7%瓊脂和2%蔗糖的1/2 MS 培養基上,置于(25±1)°C、光照時間為16 h/d、光強2000~3000 Lx光照培養箱內培養。種子露白后苗齡10 d的無菌苗2片子葉可完全展開時從瓶中取出無菌苗,無菌條件下,將下胚軸切成 0.8~1.0 cm小段、子葉切成(3~5)mm×5 mm小塊。將子葉正面向上放置,下胚軸橫向放置,接種到誘導分化培養基上,相同光照培養箱條件下培養。每個品種、每種處理接種3個培養皿,每皿接種8~10個外植體,重復3次。2周繼代1次,4周后統計結果,利用DPS軟件進行數據分析。
1.3 培養基的優化
①誘導培養基優化 以MS為基本培養基,設置ZT、6-BA、IAA3種激素不同種類及不同濃度組合,共12個組合處理,詳見表1。
②植株再生培養基優化 以MS為基本培養基,外源激素ZT設 0.2、0.5、0.8mg/L3個濃度處理。
③再生植株生根培養基優化 以1/2 MS為基本培養基,外源激素 NAA 設 0.10、0.30、0.5mg/L3個濃度處理。
所有處理培養基均附加有機成分Morel維生素 1000倍液 2mL/L、蔗糖 3%、瓊脂 8.0%,pH值5.8,121℃溫度下高壓滅菌 15 min。
1.4 不定芽生長和生根統計
待愈傷組織生長出不定芽后,轉移至植株再生培養基上,每種培養基接種5個三角瓶,每瓶接種6個外植體,重復3次,培養2周后統計不定芽生長情況。當不定芽長出2~4片真葉、長2~3 cm時,將其自基部切下并轉接于生根培養基上培養。每種培養基接種10個三角瓶,每瓶接種2個再生苗,重復3次,培養4周后統計生根情況。
2 結果與分析
2.1 外植體愈傷誘導培養基的優化
由表2可知,不同配比的12種培養基對4個品種的子葉和下胚軸均能誘導出不定芽,但其誘導率存在顯著差異。在不使用6-BA的培養基M1~M6中,ZT 2.0mg/L+IAA 0.2mg/L組合的M4培養基誘導產生不定芽的效果最好。為了研究比較6-BA與ZT對外植體不定芽誘導分化的效果,生長素IAA取最佳濃度 0.2mg/L,分裂素ZT、6-BA取不同濃度進行比較。當只加入6-BA時,M9培養基下胚軸的平均誘導率高于M7和M8培養基;當ZT和6-BA組合加入誘導培養基時,M10培養基的誘導效果最好,且誘導率明顯高于M4和M9。
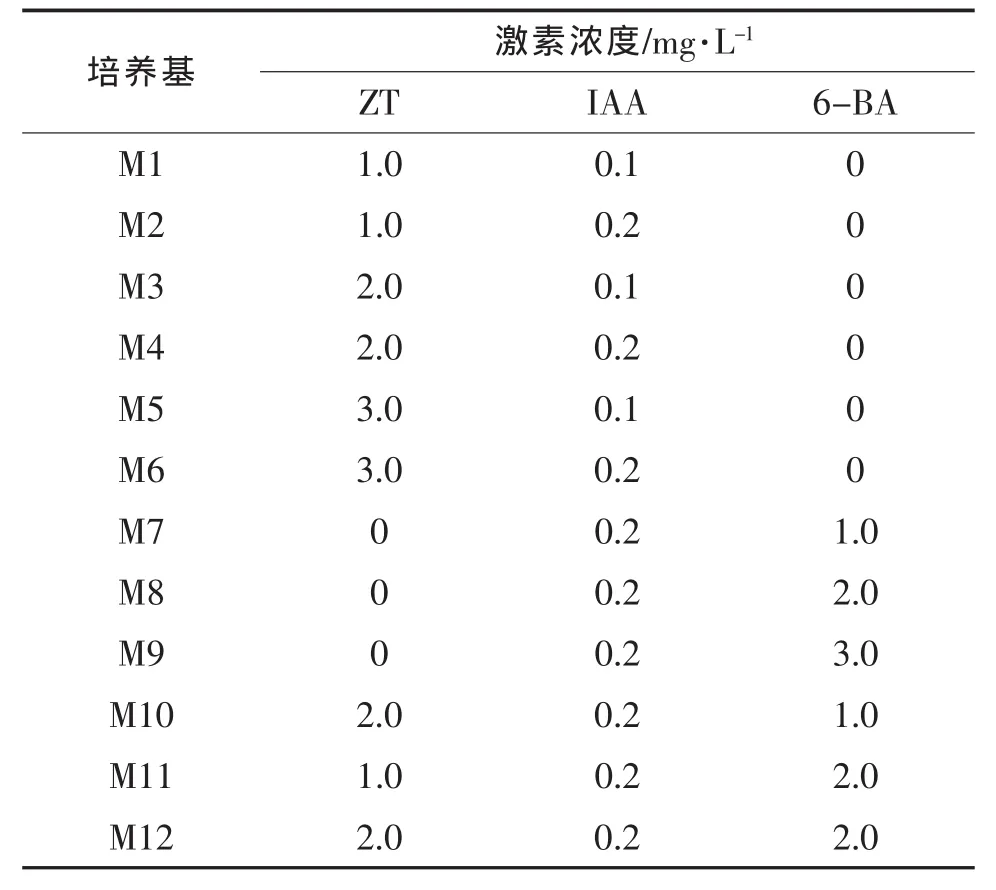
表1 愈傷誘導培養基的不同激素濃度組合
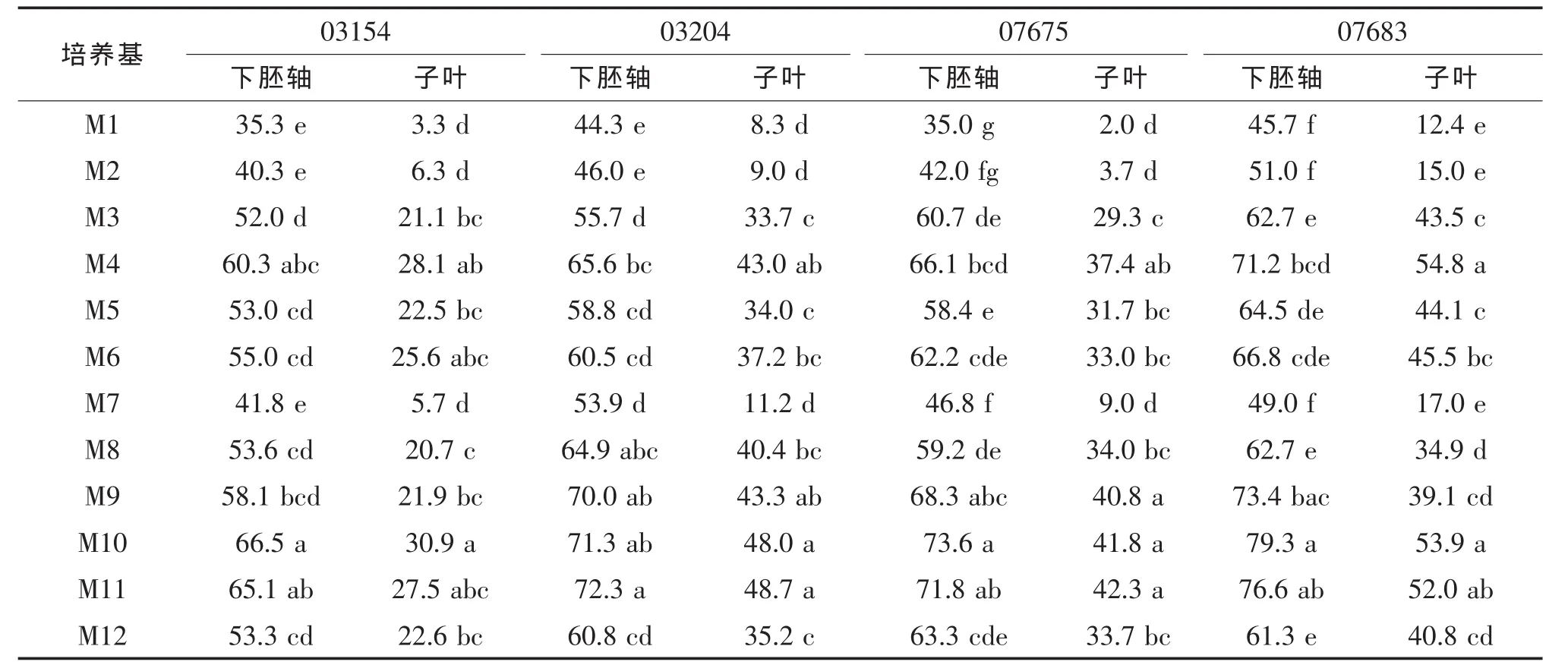
表2 不同生長調節物質組合誘導4種茄子品種不同外植體的不定芽誘導率 %
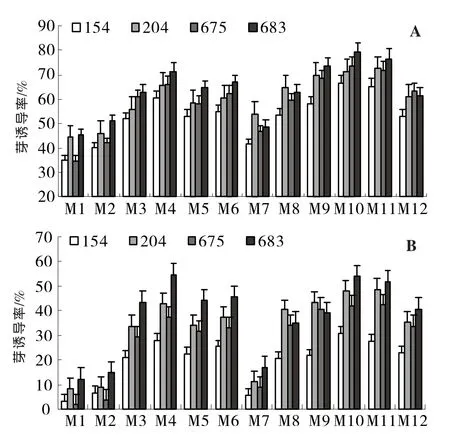
圖1 4個品種的下胚軸(A)和子葉(B)外植體在M1~M12培養基上的誘導率

圖2 下胚軸(A)和子葉(B)外植體在愈傷誘導培養基上的2周后的生長情況
由DPS軟件進行數據統計分析可知,不同激素濃度組合的培養基顯著地影響了茄子不定芽的誘導率,4個品種之間表現出相似的變化規律(圖1)。2.0mg/L ZT 和3.0mg/L 6-BA 均能較好地誘導產生不定芽,0.2mg/L的IAA可以最佳地促進分裂素ZT和6-BA對不定芽的誘導分化。6-BA、ZT對外植體的誘導分化效果與茄子外植體類型和基因型都相關。對于不同外植體,ZT對子葉的誘導效果高于6-BA,最佳濃度為2.0mg/L;6-BA對下胚軸的誘導效果較好,最佳濃度為3.0mg/L。對于不同基因型,不定芽誘導的最適分裂素不同,6-BA對圓茄07675和長茄 03204的誘導效果高于 ZT,ZT對07683和03154誘導效果較好。IAA濃度為0.2mg/L,ZT 1.0~2.0mg/L+6-BA 1.0~2.0mg/L 組合使用時對4個品種的不定芽誘導效果均較好,據此推測,該水平下的ZT+6-BA+IAA組合可以比較廣泛地適用于不同茄子品種的不定芽誘導分化。
2.2 外植體取材部位對植株再生的影響
橫向放置在誘導培養基上的下胚軸,培養1周后形態學頂端向上翹起,2周后開始有叢生芽在翹起的頂端形成,不經過愈傷組織階段,直接形成微型的小簇叢生芽結構,同時接觸到培養基的下胚軸形態學下端形成愈傷組織(圖2A)。在下胚軸形態學頂端沒有形成叢生芽或叢生芽生長緩慢的情況下,下端愈傷組織也可分化產生不定芽。平鋪在誘導培養基上的子葉,1周后體積明顯膨大,傷口處開始產生愈傷組織,2周左右生長出不定芽生長點(圖2B)。

表3 茄子愈傷組織誘導類型及其形態特征的比較
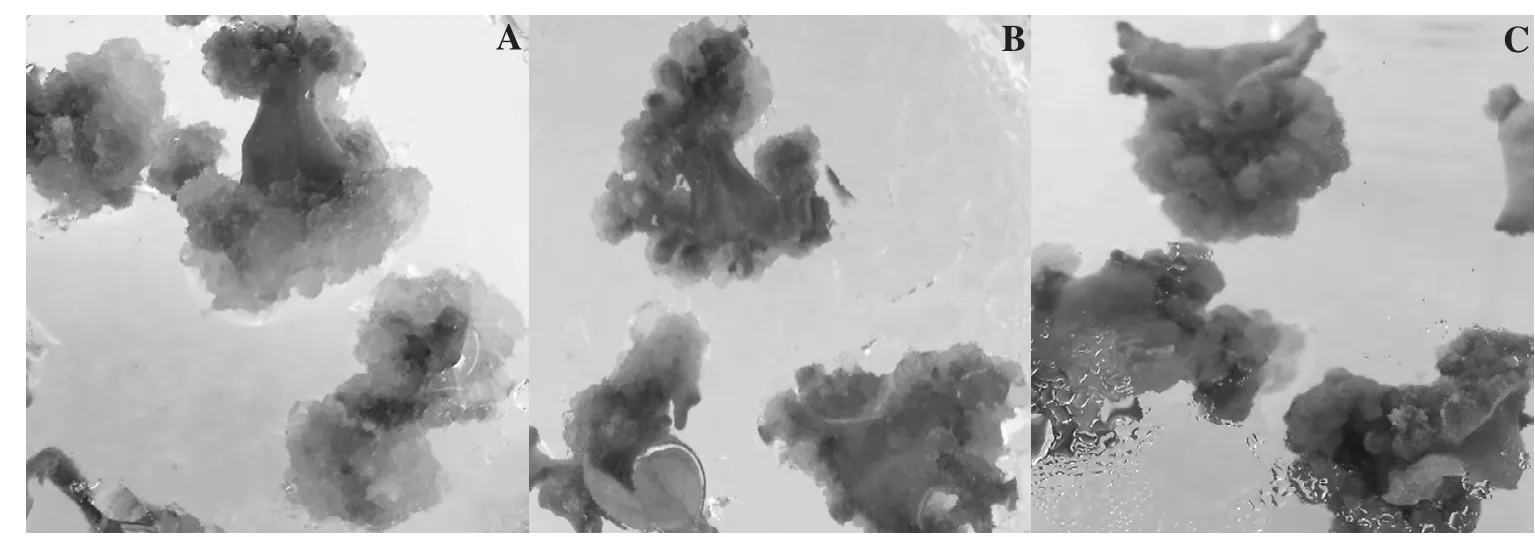
圖3 愈傷組織類型分類
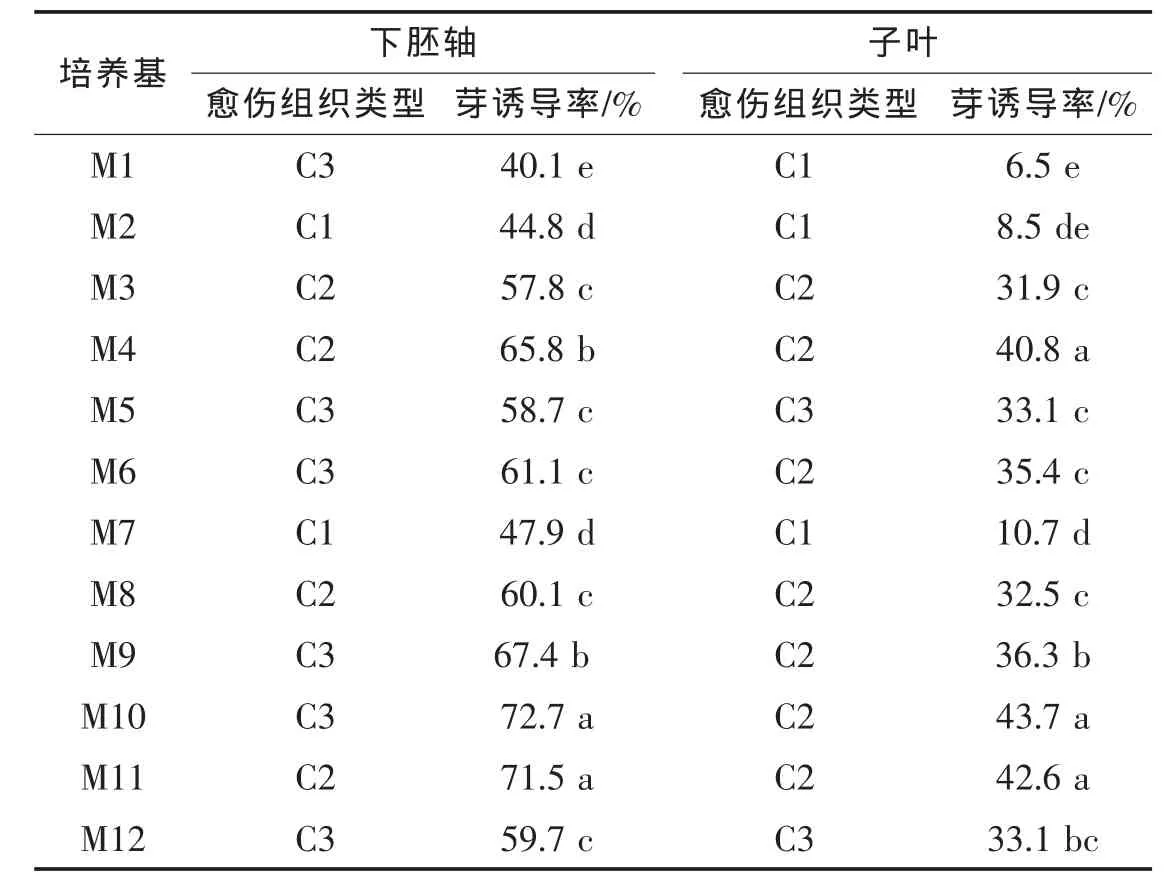
表4 不同外植體愈傷誘導類型和不定芽誘導率
試驗中茄子的子葉和下胚軸的愈傷組織誘導率都在80%以上,子葉出愈率相對稍高。外植體誘導形成的愈傷組織大致可以分為C1、C2、C33種類型(表3)。C1型愈傷組織疏松,多呈透明淡黃色(圖3A),分裂旺盛,較難誘導分化出不定芽;C2型愈傷組織較C1型緊密,多呈淺綠色(圖3B),分化成不定芽系數較高;C3型愈傷組織緊實,多呈綠褐色(圖3C),誘導分化產生少量不定芽。試驗可觀察到不同愈傷組織類型與不定芽的分化存在一定的制約關系,C2型最為理想,C1型和C3型愈傷組織產生不定芽的誘導率較低。但不同類型愈傷組織之間可以通過調節激素濃度在愈傷形成早期實現轉換。若愈傷組織生長過于旺盛,則應降低生長素濃度,提高分裂素濃度;若愈傷組織生長緩慢,過于緊實,或色澤暗淡,趨于褐化,則要提高生長素濃度,減少分裂素濃度。同時還應注意保證培養基的養分充足,及時繼代。
在各種誘導培養基中,子葉和下胚軸誘導出的主要愈傷組織類型不同,芽分化率也有顯著差異(表4)。由子葉得到的大多為C2型愈傷組織,部分為C1型以及少量C3型愈傷組織;下胚軸誘導產生的愈傷組織大多為C3型。下胚軸的誘導率平均為59.0%,最高達79.3%;子葉的誘導率平均為29.8%,最高為53.9%。4個品種下胚軸外植體的誘導率都顯著高于子葉,表明下胚軸外植體比子葉更容易誘導出芽,下胚軸分化能力高于子葉。
2.3 基因型對植株再生的影響分化能力影響的比較
4個品種的分化能力有明顯差異,且在分化能力較低的子葉外植體上差異更為顯著。圓茄07683最容易誘導分化出不定芽,其次是長茄03204和圓茄07675,長茄03154再生能力最差。4個品種不同外植體的最佳誘導培養基不同。就下胚軸來說,長茄03154和圓茄07675的最佳誘導培養基是M10,長茄03204和圓茄07683的為M11。從子葉來說,03154和07683的最佳誘導培養基是M11,03204和07675的為M10。
2.4 不同ZT濃度對不定芽生長的影響
下胚軸和子葉誘導出的不定芽在誘導培養基中生長緩慢,培養基中的IAA和高濃度的ZT或6-BA會抑制不定芽的生長,應及時轉移至植株再生培養基中,下胚軸及子葉愈傷組織在植株再生分化培養基上2周后的生長情況見圖4。由表5可知,下胚軸產生的不定芽在ZT濃度為0.5~0.8mg/L時,伸長率都為100%,但當ZT濃度為0.8mg/L時,不定芽畸形率較大。子葉產生的不定芽的畸形率隨著ZT濃度的增加也在不斷升高。當ZT濃度為0.5mg/L 時,伸長率最高,達 93.0%,且得到的有效再生苗數最多。本試驗結果顯示,最佳植株再生培養基為MS+ZT 0.5mg/L。

圖4 下胚軸和子葉愈傷組織接種于植株再生分化培養基上2周后的生長情況
2.5 不同生根培養基對再生苗生根的影響
將再生苗接種在生根培養基上1周后切口處出現膨大,并形成少量的愈傷組織,2周左右出現不定根(圖5A)。如表6所示,不加任何植物生長調節物質的1/2 MS培養基對茄子再生苗的生根效果較好,主根數最多(圖5B),添加 0.1mg/L NAA 誘導不定芽生根效果最好,根系粗壯,更適合移栽(圖5C)。隨著NAA濃度的升高,基部開始產生較大的白色或淡黃色愈傷組織,有效生根減少。本試驗結果表明,最佳生根培養基為1/2 MS+NAA 0.1mg/L。
3 結論與討論
本試驗研究了4個茄子品種的子葉和下胚軸組織培養和植株再生問題,建立了一套適于茄子遺傳轉化的優化組織培養與再生體系。試驗結果表明,不同激素組合的培養基、不同外植體類型和不同茄子基因型均顯著影響茄子不定芽的分化效果。2.0mg/L ZT和3.0mg/L 6-BA 能分別較好地誘導子葉和下胚軸產生不定芽,ZT 1.0~2.0mg/L+6-BA 1.0~2.0mg/L 組合比較廣泛地適用于不同茄子品種的不定芽誘導分化,0.2mg/L的 IAA 可以最佳地促進分裂素ZT和6-BA對不定芽的誘導分化;茄子下胚軸的再生能力要顯著高于子葉;不同茄子品種間的分化能力差異明顯。最佳誘導培養基為MS+ZT 2.0mg/L+6-BA 1.0mg/L+IAA 0.2mg/L,下胚軸的誘導率可提高至79.3%,子葉的誘導率可提高至53.9%;最佳植株再生培養基為MS+ZT 0.5mg/L;最佳生根培養基為1/2 MS+NAA 0.1mg/L。
下胚軸形態學下端和子葉產生的愈傷組織誘導出的不定芽多為單生芽,但子葉產生的不定芽易出現玻璃化和畸形苗現象。下胚軸形態學頂端產生的成簇叢生芽一般只有1~2株能夠生長發育成完整植株。利用下胚軸的極性現象,正向扦插比橫向放置可以縮短頂端產生叢生芽的分化時間,這與黃志銀等[16]的研究結果相似。下胚軸近根部片段比近子葉片段的形態發生潛能大,更易誘導分化出叢生芽。這與國外Matsuok等[4]、Sharma等[17]的研究結果相同,他們認為下胚軸的不同部位形態建成的潛能有明顯不同,可產生的不定芽數目從高到低依次是基部、亞基部、亞頂端、頂端。然而余瀾波等[10]得到相反的結果,他們認為下胚軸的上端比下端容易誘導出芽,且在極性上端易誘導出芽,下端易誘導出根,具體原因有待于進一步研究。
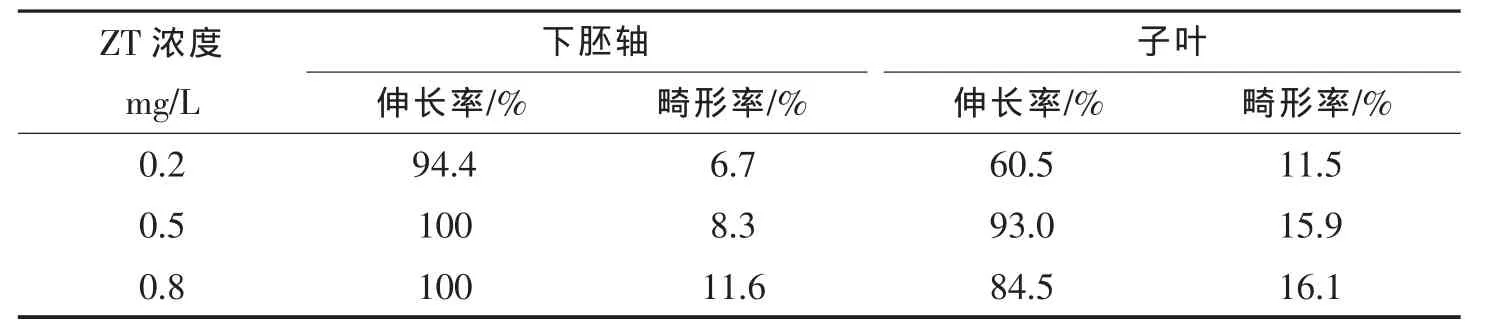
表5 不同ZT濃度對不定芽生長的影響
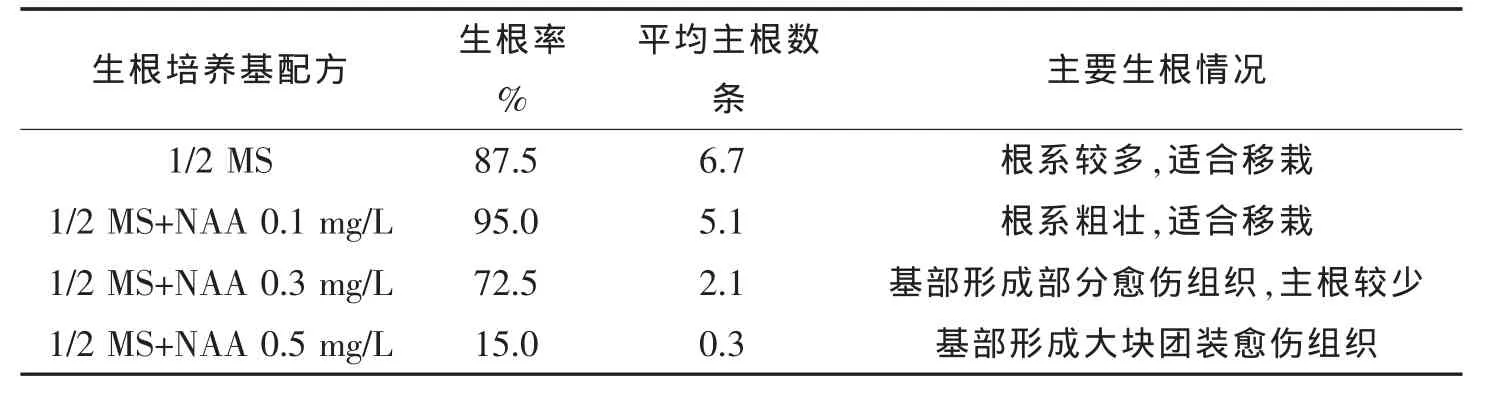
表6 不同培養基配方的生根效果比較

圖5 再生苗的生根情況
[1]Alicchio R,Antonioli C,Palenzona D.Karyotypic variability in plants of Solanum melongena regenerated from callus grown in presence of culture filtrate of Verticilli umdahliae[J].Theor Appl Genet,1984,67:267-271.
[2]Kamat M G,Rao P S.Vegetative multiplication of eggplants(Solanum melongena)using tissue culture techniques[J].Plant Sci Lett,1978,13:57-65.
[3]Raina S K,Iyer R D.Differentiation of diploid plants from pollen callus in anther cultures of Solanum melongenaL.[J].Z Pflanzenzucht,1973,70:275-280.
[4]Matsuoka H,Hinata K.NAA-induced organogenesis and embryo genesis in hypocotyl callus of Solanum melongena L.[J].Journal of Experimental Botany,1979,30:363-370.
[5]Raopv L,Singh B.Plantlet regeneration from encapsulated somatic embryos of hybrid Solanum melongenaL.[J].Plant Cell Rep,1991,10:7-11.
[6]Jia J F,Potrykus I.Mesophyll protoplasts from Solanum melongena var depressumbailey regenerate to fertile plants[J].Plant Cell Rep,1981,1:71-72.
[7]Saxena P K,Gill R,Rashid A,et al.Plantlet formation from isolated protoplasts of Solanum melongenaL.[J].Protoplasma,1981,106:355-359.
[8]Kazumitsu M.Callus induction and plantlet formation through culture of isolated microspores of eggplant(Solanum melongenaL.)[J].Plant Cell Reports,1996,15:391-395.
[9]連勇,劉富中,陳鈺輝,等.茄子體細胞雜種游離小孢子培養獲得再生植株[J].園藝學報,2004,31(2):233-235.
[10]余波瀾,張利明,孫勇如,等.茄子子葉和下胚軸的組織培養和植株再生[J].植物生理學通訊,2003,39(4):317-320.
[11]洪曉華,王瑛華,陳剛,等.茄子的組織培養和植株再生體系研究[J].北方園藝,2009(6):63-65.
[12]龔靜,褚云霞,許爽,等.茄子子葉下胚軸離體再生體系建立[J].北方園藝,2011(15):151-154.
[13]馬杰,邱棟梁.番茄組培再生體系優化研究[J].中國農學通報,2011,27(8):185-189.
[14]張之為,趙君,樊明壽.馬鈴薯不同品種葉片再生體系的建立[J].四川農業大學學報,2011,29(1):61-68.
[15]范適,連勇,劉志敏,等.四倍體茄子葉片離體培養和植株再生體系的建立[J].中國蔬菜,2005(9):19-20.
[16]黃志銀,曹必好.茄子組織培養高效再生植株體系的優化[J].長江蔬菜,2012(10):4-7.
[17]Sharma P,Rajam M V.Genotype,explant and position effects on organogenesis and somatic embryogenesis in eggplant(Solanum melongenaL.)[J].Journal of Experimental Botany,1995,46(1):135-141.

