凍干再水化血小板結(jié)構(gòu)與功能研究
徐晶,張瑩瑩,杜忻,陳火玲,楊南,張曉麗,尹金鳳
(1、南昌市血站,江西 南昌330025;2、南昌大學(xué)第四附屬醫(yī)院腎內(nèi)科,江西 南昌330003)
血小板(platelet)是由骨髓巨核細(xì)胞產(chǎn)生并釋放于血液循環(huán)中的最小細(xì)胞,在止血和凝血過(guò)程中發(fā)揮著重要的作用[1]。由于血小板保質(zhì)期較短,臨床輸注需求量大,加之臨床輸注需求時(shí)間的不確定性,造成了血小板過(guò)期浪費(fèi)和臨床供不應(yīng)求的兩難尷尬局面[2]。目前國(guó)內(nèi)血小板主要保存方式是22℃振蕩保存,有效期為5d。此外血小板還可深低溫冰凍保存,但這種方法的保存效果和臨床療效不確切[3,4]。冷凍干燥技術(shù)已廣泛應(yīng)用于各種生物材料的保存,凍干制品具有常溫下保存、性能穩(wěn)定、便于運(yùn)輸?shù)奶攸c(diǎn)[5]。本研究以過(guò)期血小板為原料,探索血小板凍干再水化的條件,檢測(cè)其凍干再水化后凝血功能的變化,為過(guò)期血小板再利用及新鮮血小板冰凍或低溫保存研究提供了依據(jù)。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1 血小板來(lái)源 實(shí)驗(yàn)組選擇體檢合格,一周內(nèi)未服用阿司匹林等抗血小板藥物的自愿獻(xiàn)血者,用血細(xì)胞分離機(jī)單采富含血小板血漿,22℃振蕩保存5d過(guò)期;對(duì)照組選擇新鮮機(jī)采血小板。
1.1.2 主要試劑和溶液 海藻糖 (CH22O11·2H2O,北京經(jīng)科宏達(dá)生物技術(shù)有限公司);牛血清白蛋白(BSA,上海生工生物工程有限公司);磷酸鹽緩沖液(PBS);血小板聚集誘導(dǎo)劑二磷酸腺苷(ADP,Sigma公司);凝血酶(Sigma 公司);膠原(Sigma 公司);瑞斯托霉素(Sigma 公司);CD62P-PE(Bioscience 公司);PAC-1-FITC(BDIS公司);海藻糖加載緩沖液(含50mmol/L 海藻糖,100mmol/L NaCl,10mmol/L KCl,10mmol/L EGTA,pH 為 6.8);凍干保護(hù)劑(含 20%海藻糖,1%牛血清白蛋白,9.5mmol/L HEPES,142.5mmol/L NaCl,4.8mmol/L KCl,1mmol/L Mg-Cl2);復(fù)水溶液為PBS緩沖液和蒸餾水以3:1比例混合制成。以上試劑和溶液均在有效期內(nèi)。
1.2 主要儀器 冷凍干燥機(jī)(LabConco,美國(guó));恒溫振蕩水浴(Bellco Glass,美國(guó));流式細(xì)胞儀(FACSCalibur,BD,美國(guó));血球計(jì)數(shù)儀(CELL-DYN 1700,Abbott,美國(guó));血小板聚集儀(APACT-2 型)。
1.3 實(shí)驗(yàn)方法
1.3.1 血小板的凍干保存 血小板濃縮液離心洗滌后重懸于海藻糖加載緩沖液中,將上述懸浮液轉(zhuǎn)移進(jìn)入離心管中,并用聚四氟乙稀生料帶密封,于37℃水浴中振蕩孵化4h。將孵化后的血小板懸浮液800g離心3min。去除上層孵化液,得到沉淀的血小板塊,加入凍干保護(hù)液打散重懸,使用血球計(jì)數(shù)儀進(jìn)行計(jì)數(shù),調(diào)節(jié)血小板在凍干保護(hù)液中的濃度為1×109個(gè)/ml。將制備好的血小板凍干懸浮液裝入特制凍干血盒中,密封充注口。將血小板凍干懸液先以20℃/min的速率凍結(jié)至-40℃,預(yù)凍2h后,再以1.5℃/min對(duì)擱板升溫至-30℃,退火0.5h,然后進(jìn)入一次干燥,-38℃維持一次干燥條件20h,最后以0.2℃/min的加熱速率使隔板溫度升高至20℃,維持二次干燥條件10h直至凍干結(jié)束。凍干的血小板密封保存在室溫。
1.3.2 凍干血小板的水化 將PBS緩沖液和蒸餾水以3:1的比例混合制成血小板凍干復(fù)水液,將1ml復(fù)水液在室溫下直接加入凍干樣品瓶中,輕輕震蕩直到樣品完全溶解于復(fù)水溶液中[6]。
1.3.3 檢測(cè)血小板回收率 用血球計(jì)數(shù)儀分別對(duì)凍干前和凍干再水化后的血小板計(jì)數(shù),計(jì)算凍干再水化血小板回收率。凍干再水化血小板回收率(%)=凍干再水化后血小板計(jì)數(shù)/凍干前血小板計(jì)數(shù)×100%。
1.3.4 檢測(cè)血小板穩(wěn)定性 凍干再水化血小板分別在室溫放置 0h、2h、4h、6h、8h 后,用血球計(jì)數(shù)儀測(cè)定血小板回收率。
1.3.5 血小板形態(tài)及超微結(jié)構(gòu)觀察 用掃描電鏡觀察血小板的形態(tài);分別以戊二醛固定、脫水、環(huán)氧樹(shù)脂包埋后制作超薄切片,用透射電鏡觀察血小板超微結(jié)構(gòu)變化。
1.3.6 血小板聚集反應(yīng)檢測(cè) 將凍干血小板復(fù)水后轉(zhuǎn)入離心管中進(jìn)行洗滌以去除細(xì)胞外保護(hù)劑,再用新鮮冰凍血漿重懸血小板,調(diào)整血小板濃度為(0.2~0.3)×1012/L。用APACT-2型血小板聚集儀檢測(cè)凍干再水化后血小板對(duì)四種同濃度誘導(dǎo)劑—凝血酶、膠原、ADP和瑞斯托霉素的聚集反應(yīng)。
1.3.7 血小板表面糖蛋白檢測(cè) 用三色流式細(xì)胞儀分別檢測(cè)凍干再水化血小板表面激活指標(biāo)CD62p和PAC-1的表達(dá),經(jīng)凝血酶激活后測(cè)定CD62p和PAC-1的再表達(dá)。再表達(dá)率=凝血酶處理后表達(dá)率-血小板表達(dá)率
2 結(jié)果
2.1 血小板回收率及穩(wěn)定性 實(shí)驗(yàn)組和對(duì)照組間血小板計(jì)數(shù)有統(tǒng)計(jì)學(xué)意義(P<0.05),凍干再水化血小板回收率為49.36%,見(jiàn)表1;凍干再水化血小板穩(wěn)定性隨血小板放置時(shí)間的延長(zhǎng),血小板回收率逐漸下降,見(jiàn)圖1。

表1 實(shí)驗(yàn)組與對(duì)照組血小板計(jì)數(shù)均數(shù)比較
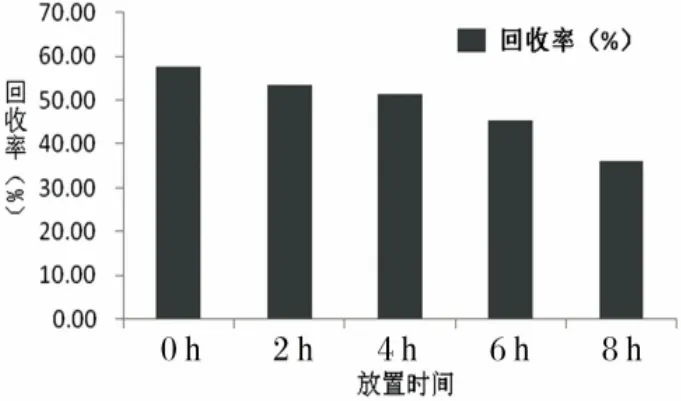
圖1 血小板放置不同時(shí)間點(diǎn)的回收率
2.2 血小板形態(tài)及超微結(jié)構(gòu) 掃描電鏡顯示新鮮血小板透光性較強(qiáng),形態(tài)呈圓形或橢圓形,邊緣光滑,而凍干再水化血小板透光性較弱,血小板變形,見(jiàn)圖2A和B。透射電鏡顯示新鮮血小板著色較深,α顆粒、致密顆粒、過(guò)氧化酶顆粒等分散、清晰,而凍干再水化血小板著色較淺,致密顆粒及α顆粒不夠清晰,且數(shù)目少于對(duì)照組,見(jiàn)圖2C和D。

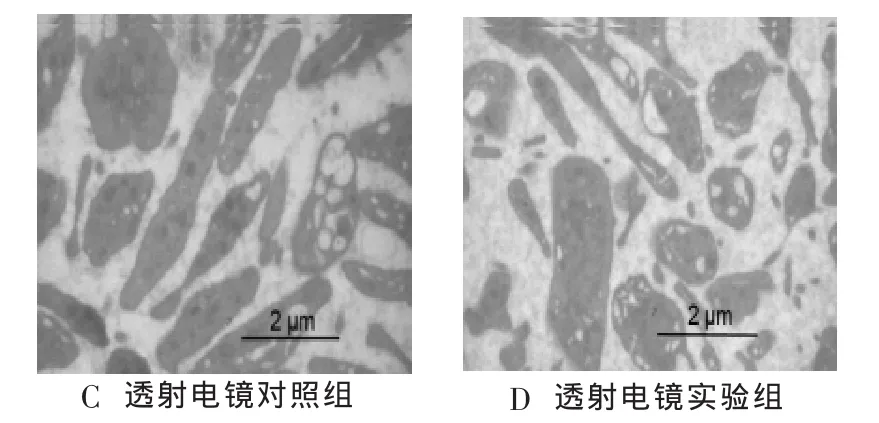
圖2 實(shí)驗(yàn)組和對(duì)照組血小板形態(tài)及超微結(jié)構(gòu)
2.3 聚集反應(yīng) 實(shí)驗(yàn)組和對(duì)照組間血小板同濃度誘導(dǎo)劑下的最大聚集率均有統(tǒng)計(jì)學(xué)意義 (P<0.05),實(shí)驗(yàn)組血小板對(duì)凝血酶、膠原、ADP和瑞斯托霉素的聚集功能較對(duì)照組均出現(xiàn)下降,見(jiàn)表2。

表2 實(shí)驗(yàn)組與對(duì)照組血小板最大聚集率(%)
2.4 血小板表面糖蛋白 實(shí)驗(yàn)組CD62p表達(dá)率和再表達(dá)率分別為50.25%、94.27%,均顯著高于對(duì)照組的8.12%、78.43%(P<0.05);凝血酶作用后CD62p再表達(dá)率為44.02%,顯著低于對(duì)照組70.31%(P<0.05)。實(shí)驗(yàn)組PAC-1表達(dá)率為3.85%,與對(duì)照組相比較無(wú)顯著性差異 (P>0.05),PAC-1再表達(dá)率為42.75%,顯著低于對(duì)照組67.29%(P<0.05),凝血酶作用后PAC-1再表達(dá)率為38.90%,顯著低于對(duì)照組 65.28%(P<0.05),見(jiàn)表 3。

表3 實(shí)驗(yàn)組與對(duì)照組CD62p和PAC-1的表達(dá)(%)
3 討論
血小板數(shù)目減少或功能不全所致出血性疾患的預(yù)防和治療,臨床多采用輸注血小板制劑。血小板保存技術(shù)的缺陷是血小板過(guò)期浪費(fèi)和臨床供不應(yīng)求的兩難處境的主要原因,因此,研究出一種能長(zhǎng)期、高效、安全和方便的血小板保存方法一直是國(guó)內(nèi)外輸血工作者關(guān)注的熱點(diǎn)和難題[7]。
將過(guò)期的血小板再利用及血小板的凍干保存有著廣闊的應(yīng)用前景。本研究顯示凍干再水化的過(guò)期血小板回收率及穩(wěn)定性較差,說(shuō)明凍干和再水化過(guò)程對(duì)血小板功能造成一定影響,應(yīng)進(jìn)一步改進(jìn)凍干保存時(shí)擱板溫度,復(fù)水液組分和比例,以及增加預(yù)復(fù)水步驟[8,9]。透射電鏡下新鮮血小板著色相對(duì)較深,可能為新鮮血小板生物活性較高或膜通透性相對(duì)較高,因而有較強(qiáng)吸附染料的能力。CD62p和PAC-1分別為血小板表面活化晚期標(biāo)志物和活化早期的標(biāo)志物,結(jié)果顯示過(guò)期血小板對(duì)凝血酶、ADP、膠原及瑞斯托霉素的最大聚集率明顯小于新鮮血小板,凝血酶作用后CD62p和PAC-1的再表達(dá)率低于新鮮血小板,說(shuō)明過(guò)期以及凍干和再水化過(guò)程對(duì)血小板凝血功能有影響,但凍干再水化的過(guò)期血小板仍具有一定的存活能力和功能活性,因此選擇血小板進(jìn)行冷凍干燥保存是血小板長(zhǎng)期保存切實(shí)可行的方法,為新鮮血小板冷凍干燥保存提供理論依據(jù)。但對(duì)該方法保存血小板的回收率、穩(wěn)定性以及凝血功能等還需做進(jìn)一步研究與改進(jìn),以達(dá)到臨床應(yīng)用的要求。
[1]王捷熙,楊超,王艷,等.小分子糖負(fù)載血小板+凍干保護(hù)劑混合懸液的相變點(diǎn)測(cè)定與屏蔽實(shí)驗(yàn)研究[J].中國(guó)輸血雜志,2010,5(23):338-340.
[2]王捷熙,韓穎,楊超,等.生物化學(xué)穩(wěn)定法冰凍干燥血小板制劑的功能研究[J].中國(guó)輸血雜志,2010,5(23):341-343.
[3]池春燕,林力紅.外科DIC患者輸注冷沉淀凝血因子的療效觀察[J].實(shí)驗(yàn)與檢驗(yàn)醫(yī)學(xué),2014,32(1):53-56.
[4]鄧日富.臨床用血情況分析[J].實(shí)驗(yàn)與檢驗(yàn)醫(yī)學(xué),2013,31(4):388-389.
[5]徐祥蓮,王麗,徐晶,楊娟,等.2008年至2011年南昌市地區(qū)捐獻(xiàn)機(jī)采血小板情況分析[J].實(shí)驗(yàn)與檢驗(yàn)醫(yī)學(xué),2012,30(6):615-616.
[6]周俊,張長(zhǎng)虹,劉景漢,等.凍干血小板功能的體外評(píng)價(jià)[J].中國(guó)輸血雜志,2008,10(21):774-777.
[7]Hoshi R,Murata S,Malsuo R,et al.Freeze-dried platelets promote hepatocyte proliferation in mice[J].Cryobiology,2007,55(3):255-260.
[8]劉瑛,許先國(guó),洪小珍,等.血小板凍干再水化的形態(tài)結(jié)構(gòu)與凋亡[J].基礎(chǔ)醫(yī)學(xué)與臨床,2008,11(28):1169-1173.
[9]戚新,孟跟東,王薇.冷凍保存血小板質(zhì)量評(píng)估的主要指標(biāo)[J].中國(guó)誤診學(xué)雜志,2008,26(8):6376-6377.

