高同型半胱氨酸血癥患者氧化應激指標的研究
蔣興亮, 劉素蘭, 易婷婷
(川北醫學院附屬醫院檢驗科,四川南充637000)
高同型半胱氨酸血癥(hyperhomocysteinemia,HHcy)作為動脈粥樣硬化發病的獨立危險因素,與血管疾病存在著密切的聯系,其機制可能與對血管內皮細胞結構和功能的直接或間接損傷及基因毒性作用、增強脂質過氧化、促進血管平滑肌細胞(vascular smooth musole cell,VSMC)的增殖和遷移、改變血小板功能及影響凝血系統、促進血管鈣化等幾個方面有關[1]。同型半胱氨酸(homocysteine,Hcy)在體內極易被氧化,在氧化的同時,釋放出活性氧離子(reactive oxygen species,ROS),過量的 ROS引起分子、細胞和組織的損傷。ROS在心血管病變,尤其是動脈粥樣硬化過程中扮演重要角色[2]。目前國內、外對HHcy患者氧化與抗氧化狀態研究較少,我們擬通過對HHcy患者血漿代表抗氧化狀態的循環谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、對氧磷酯酶1(paraoxonase 1,PON1)活性,反映氧化程度的丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)水平及一氧化氮合酶(nitric oxide synthose,NOS)活性的測定,觀察 HHcy患者氧化與抗氧化狀態,以探討Hcy致動脈粥樣硬化的機制。
材料和方法
一、研究對象
以空腹血漿Hcy≥15μmo l/L為診斷HHcy的標準,選擇2011年10月至2012年2月川北醫學院附屬醫院住院患者108例,其中男78例,女30例,年齡25~68歲。根據血漿Hcy升高的程度將HHcy分為輕度(16~30μmol/L)、中度(31~100 μmol/L)和重度(>100 μmol/L)[3],其中輕度組50例、中度組40例、重度組18例。排除冠心病、糖尿病、高血壓、甲狀腺功能異常、急性感染、嚴重營養不良、肝腎功能不全、血液系統疾病及惡性腫瘤、接受器官移植的患者和近6個月內服用葉酸、維生素B6、維生素B12以及影響Hcy水平的藥物(如卡馬西平、苯妥英鈉等)。以同期川北醫學院附屬醫院門診健康體檢者106名作為正常對照組,其中男66名,女40名,年齡29~65歲,其年齡和性別與HHcy組比較差異無統計學意義(P>0.05),全部經體格檢查和血生化、心電圖、腹部B超等檢查無心、肝、腎疾病及糖尿病。
二、方法
1.標本收集 所有受檢者禁食12 h,于清晨采集靜脈血液,肝素抗凝,分離血漿,置-20℃保存備檢。
2.血漿PON1活性測定[4]采用速率法測定PON1活性。取試劑1(0.05 mol/L甘氨酸緩沖液,pH 值 10.5,含 1 mmol/L CaCl2、1 mol/L NaCl)150μL,試劑2(試劑1中含1 mol/L對氧磷)50μL,標本8μL,測定350~500 s內對硝基苯酚產生的速度,波長410/340 nm。對硝基苯酚的摩爾吸光系數為1.805×104。儀器為日立7170S自動生化分析儀。
3.血漿MDA測定 硫代巴比妥酸法。試劑盒由南京建成生物工程公司提供。
4.血漿GSH-Px活性測定 5',5'-二硫代雙2-硝基苯甲酸比色法。試劑盒由南京建成生物工程公司提供。
5.血漿NO及NOS測定 分別采用硝酸酶還原法及化學比色法測定血漿NO及NOS。試劑盒由南京建成生物工程公司提供。
6.血漿Hcy測定采用酶循環法。試劑盒由四川新成生物科技有限責任公司提供。
7.血脂測定 分別采用磷酸甘油氧化酶-過氧化酶法、膽固醇酯酶-膽固醇氧化酶法、清除法(一步法)及選擇性遮蔽法(一步法)測定甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)及低密度脂蛋白膽固醇(LDL-C);采用透射免疫濁度法測定載脂蛋白A(apo A)、載脂蛋白B(apo B)。試劑盒由浙江東甌診斷產品有限公司提供。所有生化項目均在日立7170S生化分析儀上完成。
8.血漿SOD活性測定 黃嘌呤氧化酶法。試劑盒由南京建成生物工程公司提供。
9.血漿葉酸測定 離子捕獲免疫分析法。儀器和試劑均由美國雅培公司提供。
三、統計學方法
結 果
一、HHcy組和對照組各項指標比較
2組的年齡和性別構成比差異均無統計學意義(P>0.05)。HHcy組與對照組血脂、體重指數、血壓差異均無統計學意義(P>0.05)。見表1。
二、HHcy組與對照組血漿 PON1、GSH-Px、SOD、NOS活性及MDA、NO、葉酸水平比較
HHcy患者血漿 PON1、SOD、GSH-Px、NOS 活性及NO水平明顯低于正常對照組(P<0.01),血漿MDA水平則明顯高于正常對照組(P<0.01),見表2。
表1 HHcy組和正常對照組一般資料的比較(±s)

表1 HHcy組和正常對照組一般資料的比較(±s)
注:與正常對照組比較**P<0.01,*P<0.05
?
表2 HHcy組和正常對照組血漿PON1、SOD、GSH-Px、NOS活性及MDA、NO水平比較(±s)
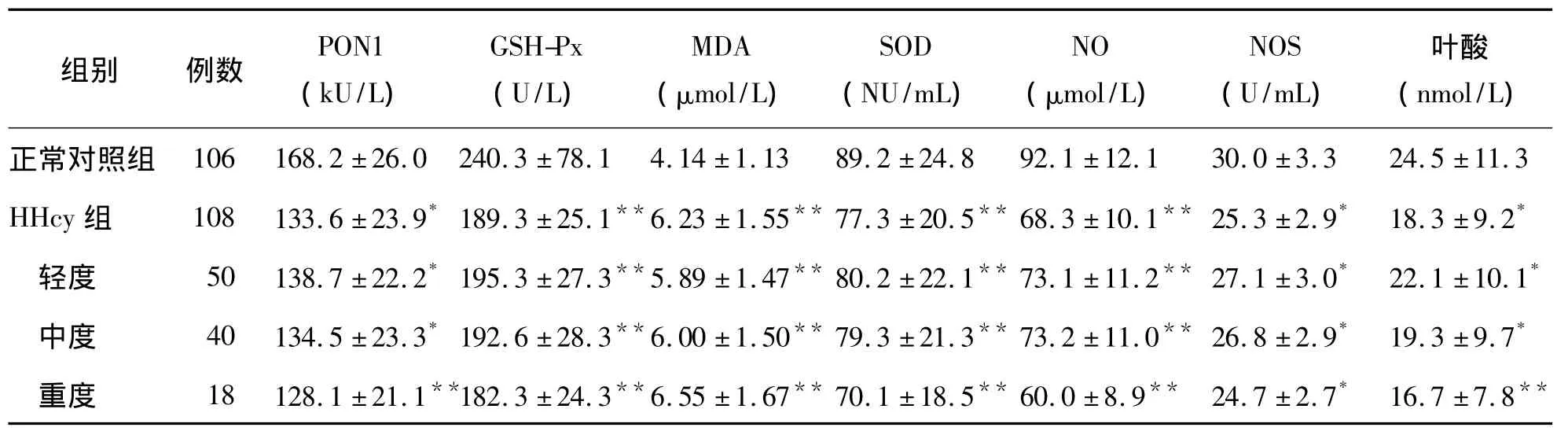
表2 HHcy組和正常對照組血漿PON1、SOD、GSH-Px、NOS活性及MDA、NO水平比較(±s)
注:與正常對照組比較,*P<0.05,**P<0.01
?
三、HHcy患者血漿 Hcy與PON1、GSH-Px、SOD、NOS、MDA、NOS 的相關性分析
HHcy患者血漿 Hcy與PON1、GSH-Px、SOD、NOS、NO呈明顯負相關,與MDA呈明顯正相關,見表3。
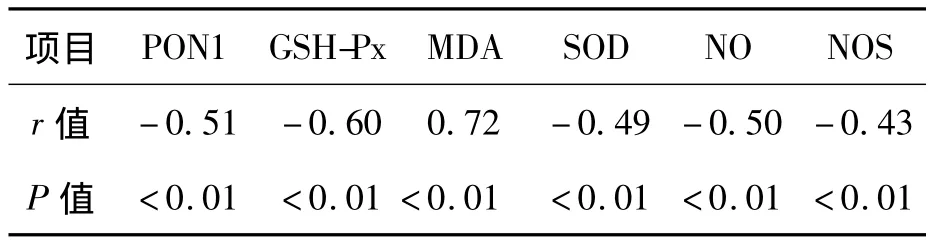
表3 HHcy患者血漿Hcy與PON1、GSH-Px、SOD、NOS、MDA、NO 的相關性分析
討 論
心腦血管疾病患病率與病死率迄今仍居高不下,已成為威脅人類健康的主要疾病之一。而動脈粥樣硬化(AS)是該類疾病重要的病理基礎。Hcy是體內蛋氨酸代謝途徑中形成的一種含硫氨基酸,屬于蛋氨酸循環的中間產物。近年來大量研究證實,HHcy成為繼高血脂、高血壓、糖尿病、吸煙等因素之后AS和血栓性疾病的一個新的、重要的、獨立的危險因素。據估計有5%~7%的普通人血中Hcy有輕至中度的增高,而40%以上確診為冠狀動脈疾病、腦血管疾病、外周動脈阻塞性疾病、周圍血管性疾病或反復性靜脈血栓癥的患者都伴有HHcy[5]。因此,Hcy的致病機制研究成為當今醫學領域研究的熱點。
本研究結果顯示,HHcy患者血漿MDA水平明顯高于正常對照組(P<0.01),PON1、GSH-Px、SOD、NO、NOS水平明顯降低(P<0.01),且血漿Hcy與MDA呈明顯正相關(P<0.01),與PON1、GSH-Px、MDA、SOD、NO、NOS呈明顯負相關(P<0.01)。GSH-Px和SOD均為人體內重要的抗氧化酶,在水解ROS的過程中逐步被消耗,使其直接參與血中脂質過氧化物的水解的能力減弱,不能有效清除過氧化物,特別是脂質過氧化物,使其在血中大量蓄積。本研究結果顯示HHcy患者體內GSH-Px、SOD活性均明顯降低,提示其抗氧化能力降低。而MDA為脂質過氧化的較穩定的代謝產物之一,其水平升高提示脂質過氧化作用增強。本研究結果顯示HHcy患者MDA水平明顯增高,說明其體內存在脂質過氧化的傾向。
PON1是近年來頗受關注的一種抗氧化酶,與還原型谷胱甘肽(GSH)有協同抗氧化作用[6]。PON1的主要作用一是通過過氧化物酶樣作用,降解高密度脂蛋白(HDL)和低密度脂蛋白(LDL)中的氧化脂肪酸和氧化膽固醇,減少脂質的過氧化以抑制LDL和HDL的氧化,保護HDL的抗氧化功能和逆行轉運膽固醇的功能[7],抵抗低密度脂蛋白的氧化而減少氧化低密度脂蛋白的生成;二是降解Hcy的代謝產物硫內酯,以減少其致動脈粥樣硬化作用[8]。
因此,HHcy患者由于種種原因使ROS產生過多,抗氧化酶如GSH-Px、SOD和PON1及其他抗氧化劑在與ROS的作用中消耗或抗氧化酶產生減少,導致抗氧化酶及其他抗氧化劑不同程度下降,不能清除體內過多的ROS,氧化與抗氧化失衡,大量的ROS在體內蓄積,可能通過多種機制參與了動脈粥樣硬化的發生、發展。
導致HHcy患者氧化應激增強的因素還不完全清楚,可能與下列因素有關:第一,Hcy含自由巰基,在金屬離子(Fe3+和Cu2+)的存在下,可以自身氧化成同型胱氨酸、Hcy混合性二硫化物和Hcy硫內酯,同時產生H2O2、羥自由基(OH·)和超氧陰離以加劇LDL的氧化反應,形成ox-LDL,從而導致動脈粥樣硬化的發生[9]。另外,Hcy抑制前列環素的合成,在黃嘌呤氧化酶催化的氧化反應及花生四烯酸代謝途徑中產生的大量自由基、過氧化物及其他有高度活性的物質都參與了Hcy對內皮細胞的損傷作用。第二,Hcy抑制抗氧化酶活性。H2O2生成后可自由地穿透細胞膜,迅速被GSH-Px還原生成H2O。研究顯示,Hcy可以降低內皮細胞內穩定狀態的GSH-Px的mRNA水平,并抑制酶的活性,導致內皮細胞的抗氧化機制受損,并加強了超氧自由基介導的NO滅活作用[10]。SOD是超氧離子歧化的必需催化酶,具有保護細胞不受氧自由基損害的作用。Hcy可抑制其表達和分泌,導致其對細胞的保護作用減弱。第三,Hcy對NO的影響。Hcy氧化過程中產生的H2O2、,可使NO氧化生成過氧亞硝基(ONOO-),使NO失去生物活性。當HHcy時,Hcy長期作用于內皮細胞使得NOS受損,NOS基因表達減少,NO合成減少。由于NO相對缺乏,S-亞硝基-同型半胱氨酸(S-NO-Hcy)生成減少,導致未被NO結合的游離Hcy損傷內皮細胞,而受損的內皮細胞產生的NO更少,形成惡性循環,最終導致細胞變性壞死[11]。此外,Hcy通過增加NOS抑制劑非對稱性二甲基精氨酸(ADMA)的生成,而降低內皮細胞釋放 NO[12]。
本研究結果只針對單純HHcy患者氧化與抗氧化指標的變化,而以前多集中于HHcy合并糖尿病、腦梗死等患者中氧化與抗氧化指標的變化的研究,其結果基本一致,說明HHcy患者無論有無臨床表現,其氧化與抗氧化已失衡,尤其是單純HHcy患者其氧化與抗氧化指標已發生明顯變化,應引起臨床高度重視。
綜上所述,HHcy患者ROS產生增加,機體的抗氧化酶在清除ROS時其活性降低,導致抗氧化能力下降,使體內氧化與抗氧化處于不平衡狀態,產生氧化應激,通過氧化應激機制參與動脈粥樣硬化的發生發展。因此,有必要關注HHcy患者體內氧化與抗氧化狀態。
[1]Zhou J,Austin RC.Contributions of hyperhomocysteinemia to atherosclerosis:causal relationship and potential mechanisms[J].Biofactors,2009,35(2):120-129.
[2]Lakshmi SV,Padmaja G,Kuppusamy P,etal.Oxidative stress in cardiovascular disease[J].Indian J Biochem Biophys,2009,46(6):421-440.
[3]Tascilar N,Ekem S,Aciman E,etal.Hyperhomocysteinemia as an independent risk factor for cardioembolic stroke in the Turkish population[J].Tohoku J Exp Med,2009,218(4):293-300.
[4]Atamer A,Bilici A,Yenice N,etal.The importance of paraoxonase 1 activity,nitric oxide and lipid peroxidation in hepatosteatosis[J].J Int Med Res,2008,36(4):771-776.
[5]Antoniades C,Antonopoulos AS,Tousoulis D,etal.Homocysteine and coronary atherosclerosis:from folate fortification to the recent clinical trials[J].European Heart J,2009,30(1):6-15.
[6]陳曉蓓,徐根云,呂國才.冠心病血清對氧磷酯酶1活性與氧化功能指標的研究[J].檢驗醫學,2007,22(4):488-489.
[7]Ferretti G,Bacchetti T,Masciangelo S,etal.Effect of homocysteinylation on high density lipoprotein physico-chemical properties[J].Chem Phys Lipids,2010,163(2):228-235.
[8]Atamer A,Kocyigit Y,Ecder SA,etal.Effect of oxidative stress on antioxidant enzyme activities,homocysteine and lipoproteins in chronic kidney disease[J].J Nephrol,2008,21(6):924-930.
[9]Antoniades C,Shirodaria C,Warrick N,etal.5-methyltetrahydrofolate rapidly improves endothelial function and decreases superoxide production in human vessels:effects on vascular tetrahydrobiopterin availability and endothelial nitric oxide synthase coupling[J].Circulation,2006,114(11):1193-1201.
[10]Hoffman M.Hypothesis:hyperhomocysteinemia is an indicator of oxidant stress[J].Med Hypotheses,2011,77(6):1088-1093.
[11]Sharma M,Rai SK,Tiwari RK,etal.Effects of nitric oxide modulators on cardiovascular risk factors in mild hyperhomocysteinaemic rat model[J].Basic Clin Pharmacol Toxicol,2008,103(1):25-30.
[12]Veresh Z,Racz A,Lotz G,etal.ADMA impairs nitric oxide-mediated arteriolar function due to increased superoxide production by angiotensinⅡ-NAD(P)H oxidase pathway[J].Hypertension,2008,52(5):960-966.

