喹乙醇在鯽體內消除規律的研究
彭玉芬,蔡勤仁,薛良辰,吳潔珊,馮家望,凌蕓輝
(珠海出入境檢驗檢疫技術中心,廣東珠海519015)
喹乙醇(olaquindox,OLA),屬于喹噁啉類抗菌藥,本類藥物具有廣譜抗菌、促進生長雙重作用。該類藥物曾經被廣泛應用于豬、牛、雞、羊和水生動物促進生長,抗菌治病,但近年來的研究表明,喹乙醇及其代謝物3-甲基-喹啉-2-羥酸(3-methylquinolin-2-carboxylic acid,MQCA)有中度至明顯的蓄積毒性,對大多數動物有明顯的致畸作用,對人也有潛在的三致性,即致畸形、致突變、致癌。我國也出臺相應的測定標準[1]。美國和歐盟都禁止將喹乙醇用作飼料添加劑。《中華人民共和國獸藥典》(2005版)作出明確規定,喹乙醇禁止用于家禽及水產養殖,但由于養殖者的違規使用,國內水產品中仍屢有檢出喹乙醇殘留。目前,喹乙醇在豬[2-3]、雞[4-5]、兔[6]和老鼠[7]等陸生動物體內代謝的研究有見報道,但水生動物的相關研究卻很少。本文建立了水產品中喹乙醇的LC-MS/MS檢測方法,并對喹乙醇在鯽魚體內的消除規律進行了研究,研究結果為水產品中喹乙醇的殘留檢測和不合格追溯提供了理論依據和技術手段,對保障我國食品安全具有重要意義。
1 材料與方法
1.1 藥品與試劑 喹乙醇,含量為99.0%,CAS號為23696-28-8,Sigma公司生產;3-甲基喹噁啉-2-羧酸,含量94.0%,CAS號為92513-28-5,Dr.Ehrenstorfer公司生產;喹乙醇原料藥,購于廣州惠華動物保健品有限公司;甲醇、乙腈、乙酸乙酯、鹽酸和甲酸均為色譜純(Merck),其他試劑均為廣州化學試劑廠生產的分析純。
1.2 儀器和設備 WATERS UPLC高效液相色譜儀,API4000Q Trap質譜儀(配有電噴霧離子源);HitachiCR22GII離心機;Zymark TurboVap?LV濃縮儀;Siemens冰箱;恒溫水浴振蕩器等實驗室常用設備。
1.3 試驗魚及飼養條件 實驗用鯽魚80尾,購自珠海一源水產品養殖場,體重(250±20)g,抽樣檢查無喹乙醇殘留,養在8個玻璃缸內10 d后用于實驗,實驗期間不斷充氣并對水體進行循環過濾,水溫控制在20~25℃,實驗期間每日早晚投喂適量鯽魚飼料各1次,及時排出殘餌和糞便,每2 d換水1/2體積,實驗期間鯽魚成活率為100%。
1.4 給藥與采樣 采用口灌給藥的方式,按劑量為50 mg/kg 給藥,從給藥后開始,第 0、1、2、3、4、5、7、9、12、15、20天用沙網撈起,隨機取鯽魚5尾,從每尾靜脈取血5 mL,放入離心管(離心管事先放入4滴1%的肝素鈉),混合均勻后離心分離血漿,剖殺,迅速取出肝胰臟及背脊兩側肌肉,分別裝于白色塑料袋中,立即做好標記,保存于-20℃冰箱中。
1.5 樣品前處理方法
1.5.1 喹乙醇提取 組織樣品:準確稱取均質后的試樣5 g,精確到0.01 g,置于50 mL聚丙烯離心管中,加入5 g中性氧化鋁,用20 mL乙酸乙酯+乙腈(1∶1,V/V)混合溶劑,振蕩 15 min,5000 r/min離心5 min,取上清液,樣品重復提取一次,合并提取液,加入10 mL正己烷,振蕩2 min,5000 r/min離心5 min,棄上層正己烷。45℃吹氮濃縮至近干,用1 mL流動相溶解殘渣,旋渦混勻,0.22 μm微孔濾膜過濾,用于LC-MS/MS測定。
血漿:取0.5 mL血漿于玻璃試管中,加入3%的三氯乙酸3.5 mL,渦旋30 s,渦旋混勻30 s,80℃水浴 5 min,3000 r/min 離心5 min,0.22 μm 微孔濾膜過濾,用于LC-MS/MS測定。
1.5.2 代謝產物MQCA的提取 準確稱取2 g試樣,精確到0.01 g,置于50 mL離心管中,加入15 mL乙酸乙酯,旋渦混勻,振蕩15 min,4000 r/min離心5 min,取上清液轉入另一支50 mL離心管中,再用15 mL乙酸乙酯提取一次,合并上清液于同一離心管中。
往樣品殘渣中加入0.1 mol/L磷酸鹽緩沖液10 mL,旋渦混勻,振蕩15 min,8000 r/min 離心10 min,取上清液合并到離心管中,振蕩15 min,6000 r/min離心5 min,取下層溶液至50 mL具塞離心管中。
加入鹽酸 200 μL,混勻,再加入乙酸乙酯8 mL,振蕩 15 min,8000 r/min 離心 10 min,上層溶液轉入玻璃試管中,再用8 mL乙酸乙酯重復提取一次,合并上層溶液于同一玻璃試管,55℃吹氮濃縮至干,用1 mL 0.1%甲酸-甲醇(體積比95∶5)溶液溶解殘渣,旋渦混勻,0.22 μm微孔濾膜過濾,用于LC-MS/MS分析。
1.6 測定
1.6.1 色譜條件 色譜柱:UPLC ACQUITY BEH C18 2.1×100 mm,1.7 μm;柱溫:30 ℃;進樣量:10 μL;流動相A為5 mmol/L乙酸銨(含0.1%的甲酸),B為乙腈。梯度洗脫(表1)。
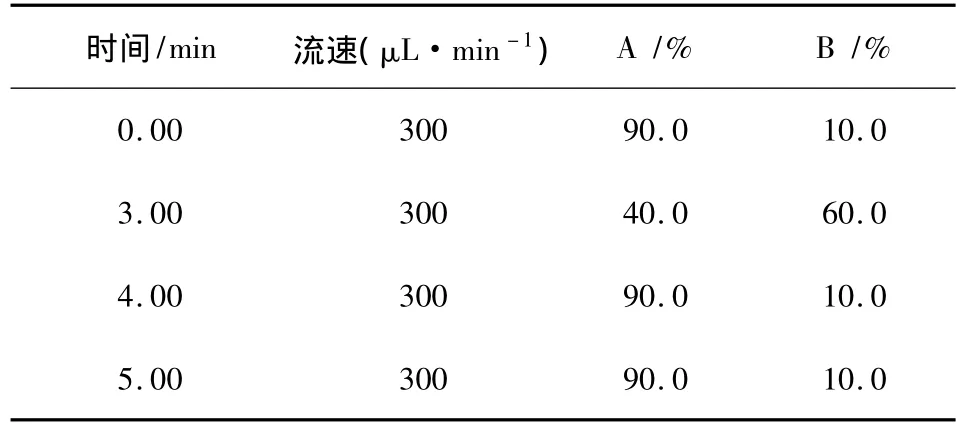
表1 梯度洗脫程序
1.6.2 質譜條件 離子源:電噴霧離子源(ESI);掃描方式:正離子掃描;檢測方式:多反應選擇離子檢測;電噴霧電壓:5500 V;霧化氣:60 MPa,氣簾氣:20 MPa,輔助加熱氣:70 MPa;碰撞氣:Medium,四種氣體均為氮氣;離子源溫度:550℃;碰撞能量、去簇電壓見表2。
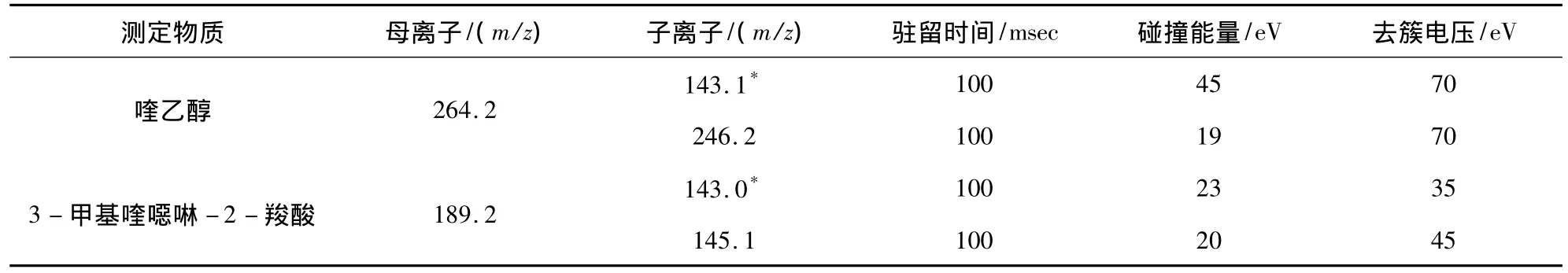
表2 喹乙醇及3-甲基喹噁啉-2-羧酸部分儀器參數
1.6.3 標準曲線 將喹乙醇及3-甲基喹噁啉-2-羧酸標準工作液依次稀釋得到0.001、0.005、0.010、0.050、0.100 μg/mL 的標準系列,由低到高的濃度進行測定,以標準溶液濃度為橫坐標,以峰面積為縱坐標繪制標準曲線。
1.6.4 回收率及精密度 在空白血漿、肌肉及肝胰臟中添加喹乙醇及3-甲基喹噁啉-2-羧酸濃度0.005 μg/mL(μg/g)、0.010 μg/mL(μg/g)和0.050 μg/mL(μg/g),每個濃度 6 個重復,按 1.5項處理方法進行處理后上機測試。
1.7 樣品中喹乙醇及其代謝物的測定 給藥后采集的血漿樣品及組織樣品的前處理按1.5項的操作方法進行,然后上機測試,將測得的峰面積值代入相應的回歸方程計算出樣品的濃度。
2 結果
2.1 喹乙醇及其代謝物標準曲線的制定 在建立的色譜質譜條件下,喹乙醇在0.001~0.100 μg/mL濃度范圍內,峰面積(y)與濃度(x)呈良好線性關系,回歸方程分別為 y=8330x+4970(r=0.9996)。3-甲基喹噁啉 -2-羧酸在0.001~0.100 μg/mL濃度范圍內,峰面積(y)與濃度(x)呈良好線性關系,回歸方程分別為y=2490x-1410(r=0.9999),喹乙醇及3-甲基喹噁啉-2-羧酸的最低檢測限為0.001 μg/mL(μg/g)。
2.2 回收率及精密度的測定 喹乙醇的添加回收率(%)和變異系數(%)分別在60% ~86%、4.2% ~11.8%之間,3-甲基喹噁啉-2-羧酸的添加回收率(%)和變異系數(%)分別在60% ~92%、2.6% ~10.2%之間。
2.3 喹乙醇在各組織中的殘留消除 鯽魚按劑量為50 mg/kg口灌喹乙醇,不同組織的不同時間點的肌肉、血漿和肝胰臟中的喹乙醇濃度的實測值見表3,從表中可以看出喹乙醇在鯽魚體內的消除非常迅速,血漿第五天檢測不到,組織中喹乙醇的濃度第七天小于0.001 μg/g。鯽魚口灌喹乙醇后肌肉中譜圖見圖1,從譜圖中可以看出喹乙醇與雜質分離良好且檢測效率高。
2.4 代謝物在各組織中的殘留消除規律 鯽魚按劑量為50 mg/kg口灌喹乙醇后,不同時間點的肌肉、血漿和肝胰臟中的3-甲基喹噁啉-2-羧酸濃度的實測值見表4,從表中可以看出喹乙醇代謝物3-甲基喹噁啉-2-羧酸在鯽魚體內消除比喹乙醇緩慢,而且在第五天時組織中3-甲基喹噁啉-2-羧酸的濃度有緩慢回升。肌肉中喹乙醇代謝物3-甲基喹噁啉-2-羧酸沒有雜質干擾且峰形良好,具體見圖2。
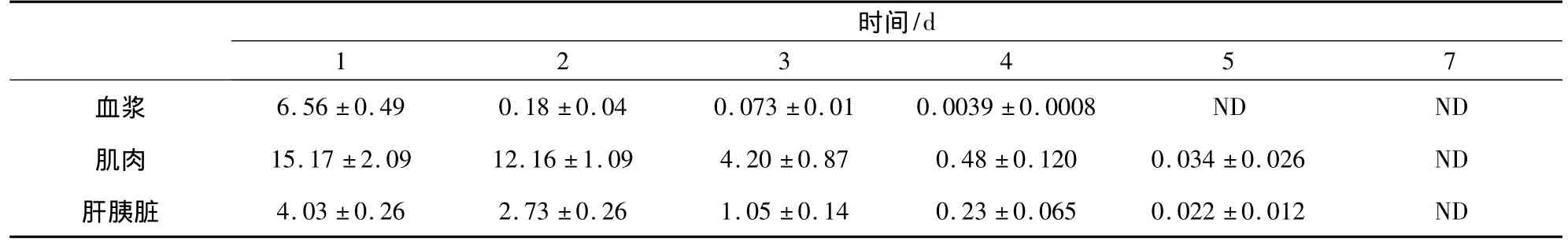
表3 鯽魚口灌單劑量喹乙醇(50 mg/kg)后組織藥物濃度(μg/g) (n=5)

表4 鯽魚口灌單劑量喹乙醇(50 mg/kg)后組織中代謝物3-甲基喹噁啉-2-羧酸藥物濃度(ng/g)(n=5)
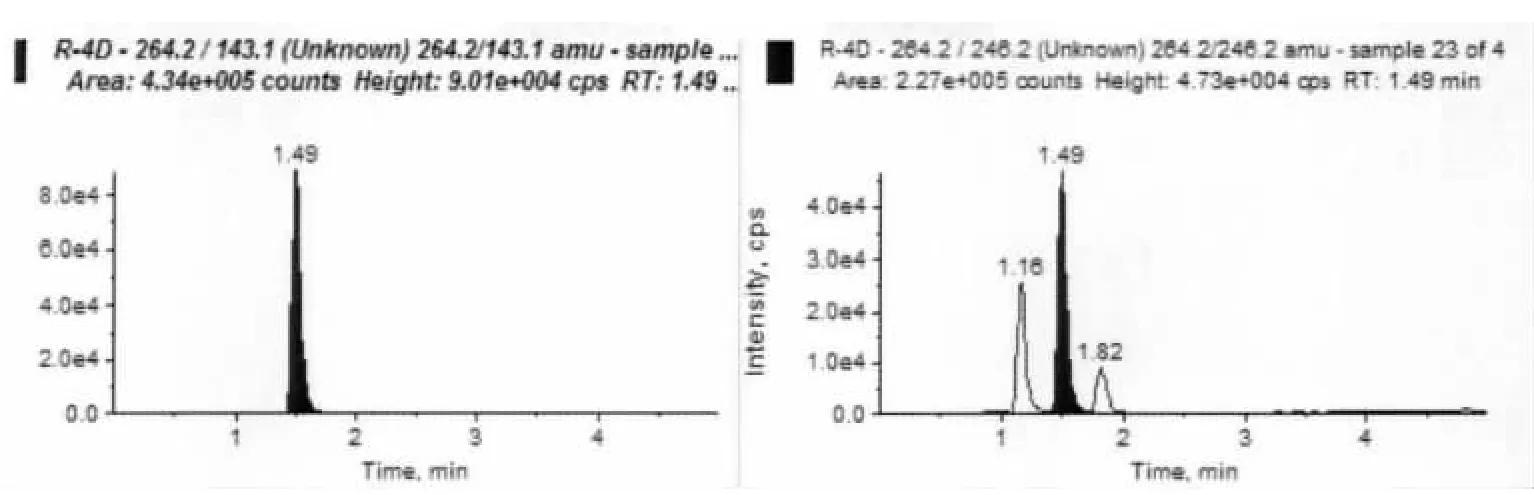
圖1 鯽魚口灌喹乙醇后肌肉MRM色譜圖

圖2 鯽魚口灌喹乙醇后肌肉中3-甲基喹噁啉-2-羧酸MRM色譜圖
3 討論
喹乙醇在動物體內吸收良好且迅速,適用于防治淡水養殖魚類細菌出血性敗血癥、癤瘡病等疾病[8]。在動物體內代謝過程中大部分以原形物質的形式從體內排出,其余主要以代謝物的形式經腎臟排出。本實驗不僅測定了血漿、組織中喹乙醇的含量,還對組織中喹乙醇代謝物進行了研究,揭示了喹乙醇在鯽魚體內的消除規律。
實驗結果表明,鯽魚按50 mg/kg口灌喹乙醇后,鯽魚血漿中喹乙醇的濃度1 d后為(6.56±0.49)mg/L,2 d后迅速下降到(0.18±0.04)mg/L,4 d 后喹乙醇下降至(0.0039±0.0008)mg/L,5 d后已經檢測不到。肌肉中喹乙醇消除的規律與在血漿中相似,但消除的速度并不快,至3 d肌肉中喹乙醇的濃度還有(4.20±0.87)mg/kg,在第7天時完全檢測不到喹乙醇。肝胰臟中喹乙醇的消除與肌肉相比,消除速率更加快速。與艾曉輝等[9]通過口灌給藥方式一次性給予鯉魚30 mg/kg的喹乙醇后消除特征基本一致。喹乙醇在鯽魚體內消除速度比雞[4-5]、兔[6]、鼠[7]慢。
喹乙醇代謝物3-甲基喹噁啉-2-羧酸在鯽魚肌肉和肝胰臟中消除比較緩慢,肌肉中到15 d基本檢測不到,肝胰臟中到20 d才檢測不到。但有一個共同點,在第5天的時候3-甲基喹噁啉-2-羧酸濃度有不同程度的回升,然后再下降直到檢測不出。通常情況下,應該是達到最大藥物濃度后隨著時間的延長,組織中濃度越來越低,但由于魚是變溫動物,出現藥物濃度下降后又回升這種情況可能與水溫的變化及魚體中某些臟器對藥物存在再吸收等因素的影響有關。這種現象在艾曉輝等[9]測定喹乙醇在鯉魚組織中的(第12小時)濃度時出現過。
[1]農牧發[2001]38號.動物源食品中獸藥殘留檢測方法[S].
[2]陶琳麗,高士爭,葛長榮,等.喹乙醇在豬組織中殘留的數學模型分析[J].云南農業大學學報,2009,24(3):394-398.
[3]Joe O.Boison,Stephen C.Lee,Ron G.Gedir.A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues[J].Analytica Chimica Acta,2009,637:128-134.
[4]曾振靈,董漓波,陳杖榴.喹乙醇在雞組織的消除及殘留研究[J].畜牧獸醫學報,1995,26(4):327-333.
[5]Zhao-Ying Liu,Ling-li Huang,Dong-Mei Chen,et al.The metabolism and N-oxide reduction of olaquindox in liver preparations of rats,pigs,and chinkens[J].Toxicology Letters,2010,195:51-55.
[6]蔣永培.新飼料添加劑“喹乙醇”在兔體內代謝動力學研究[J].畜牧獸醫雜志,1987,3:8-9.
[7]Kaemmer K.Studies with olaquindox.3rd communication.Blood level pattern in rats and pigs after oral ingestion[J].Vet.Med.Rev.1982,(1):40-58.
[8]農業部“漁藥手冊”編撰委員會.漁藥手冊[M].北京:中國科技出版社.1998,195-196.
[9]艾曉輝,陳正望,張春光,等.喹乙醇在鯉體內的藥物代謝動力學及組織濃度[J].水生生物學報,2003,27(3):273-277.

