煙草種質(zhì)材料TSNA含量的關聯(lián)分析
余義文,夏巖石,李榮華,呂永華,郭培國,邱妙文,趙偉才,何其芳
1 廣州大學生命科學學院,廣州 510006;
2 廣東省煙草專賣局(公司),廣州 510610;
3 廣東省煙草公司南雄科學研究所,南雄 512400
農(nóng)藝與調(diào)制
煙草種質(zhì)材料TSNA含量的關聯(lián)分析
余義文1,夏巖石1,李榮華1,呂永華2,郭培國1,邱妙文3,趙偉才3,何其芳1
1 廣州大學生命科學學院,廣州 510006;
2 廣東省煙草專賣局(公司),廣州 510610;
3 廣東省煙草公司南雄科學研究所,南雄 512400
為尋找與煙葉TSNA 含量顯著關聯(lián)的標記位點,利用分布于煙草24個染色體具多態(tài)性的SSR標記和MFLP標記,分析24份煙草種質(zhì)材料的遺傳多樣性,在此基礎上對煙葉中煙草特有亞硝胺(TSNA)含量的表型變異與標記多態(tài)性進行關聯(lián)分析。結果顯示,33對MFLP引物和28對SSR引物在24份煙草材料中共發(fā)現(xiàn)188個多態(tài)位點;群體結構分析將24份煙草材料分為3個亞群,且亞群劃分與煙草類型(烤煙、晾曬煙和白肋煙)基本一致;關聯(lián)分析發(fā)現(xiàn)1個SSR位點和6個MFLP位點至少與1種TSNA含量的相關性在0.01水平上顯著,其中標記MFLP26與烤后煙葉中NNN含量的相關性在0.001水平上顯著,表型變異解釋率最高(R2=0.5831)。這些顯著關聯(lián)的分子標記可為篩選低TSNA含量的煙草材料提供參考。
煙草特有亞硝胺;SSR標記;MFLP標記;關聯(lián)分析
煙草特有亞硝胺(Tobacco Specific Nitrosamines,TSNA)是煙草及其制品中的特有成分,主要包括N-亞硝基去甲基煙堿(NNN)、4-(N-亞硝基甲基氮)-1-(3-吡啶基)-1-丁酮(NNK)、N-亞硝基假木賊堿(NAB)和N-亞硝基新煙草堿(NAT)四種類型[1-2]。大量研究認為TSNA是一類具有致癌性的化合物[3-4],其中NNK和NNN被指定為一類(Class 1)致癌物,可對小鼠、大鼠及敘利亞金田鼠等動物誘發(fā)肺癌;而NAB和NAT由于對實驗動物的致癌性的證據(jù)較少,相關資料不充分,所以它們的致癌性尚不能確定[5]。
卷煙煙葉原料中的TSNA是煙氣中TSNA的主要來源之一[6-7]。不同煙草種質(zhì)間總TSNA含量不同,且不同形式的TSNA在每種煙草所占比例也不同[8-12]。相同的栽培和調(diào)制條件下,不同類型煙草中TSNA的含量存在著種屬特異性且差異顯著,如烤煙煙葉中無論是葉片還是葉脈,其TSNA水平都要低于白肋煙[10-11],不同烤煙品種及不同白肋煙品種間TSNA含量與基因型顯著相關[13-15]。這些研究結果表明,TSNA含量與煙草品種本身的遺傳特性明顯相關。因此,選育出低TSNA含量的煙草品種,可降低卷煙對人體健康的危害程度。
我國在這方面的研究剛剛起步,具有很大的潛力。煙葉生產(chǎn)中煙堿轉化時常存在,需加強對煙堿轉化規(guī)律的研究,更為重要的是研究這些TSNA及相關前體的遺傳規(guī)律,采取遺傳選擇方法對品種進行改良,是降低我國煙葉TSNA含量的一種有效途徑[16-18]。如近年來我國采用常規(guī)育種方法對白肋煙主栽品種鄂煙1號雜交種的親本進行遺傳改良,并配制出改良雜交種,新品種煙葉的煙堿轉化率、降煙堿含量和TSNA含量均大幅度降低,有效地提高了白肋煙的安全性[18]。這些結果更進一步證明煙草中的TSNA含量受主效基因控制,可以在了解其遺傳規(guī)律的條件下選育出系列符合優(yōu)質(zhì)低害要求的烤煙新品種。
到目前為止,尚未見我國開展烤煙TSNA遺傳規(guī)律方面的研究工作,亦未見有從事適用于TSNA含量的分子標記開發(fā)的研究報道。本實驗在SSR(Simple Sequence Repeat)標記和 MFLP(Microsatellite-anchored fragment length polymorphism)技術檢測不同煙草材料遺傳多樣性的基礎上,對不同煙草材料煙葉中TSNA含量的變異與標記多態(tài)性進行關聯(lián)分析,以期發(fā)現(xiàn)與煙葉TSNA 含量顯著關聯(lián)的標記位點,為低TSNA含量的煙草品種的選育提供參考。
1 材料與方法
1.1 植物材料
供試的24個煙草材料由廣東省煙草公司南雄科學研究所提供,其中包含了19個烤煙、3個晾曬煙和2個白肋煙,其來源和類型如表1所示。
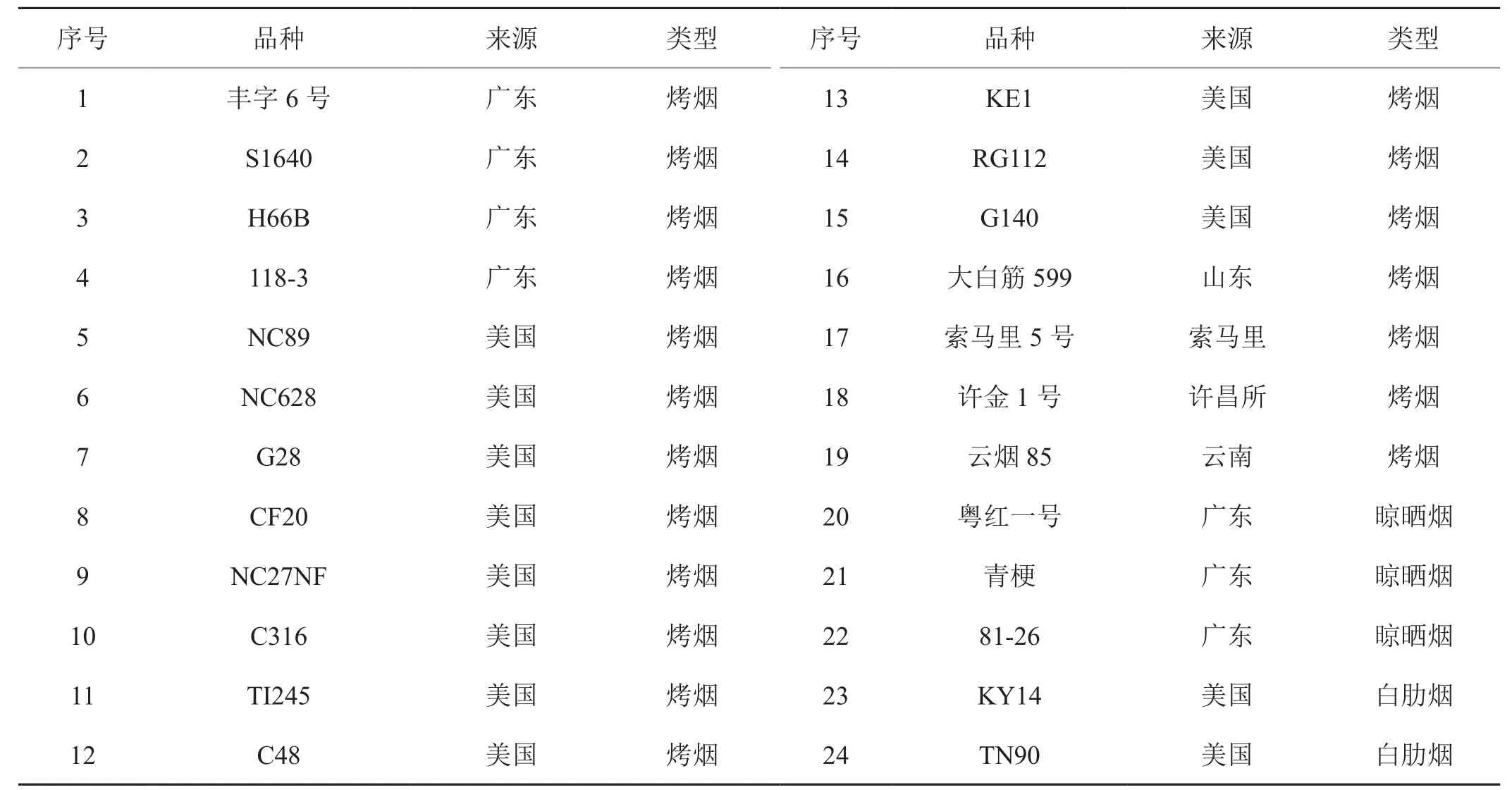
表1 煙草種質(zhì)材料來源及類型Tab.1 Type and origin of tobacco accessions
1.2 煙葉TSNA含量的測定
煙草材料于2011年種植在廣東省煙草公司南雄科學研究所的試驗地,并設3個重復,按常規(guī)水肥管理。于成熟期采集不同品種相同節(jié)位的中部葉片進行殺青(105℃,30 min)和調(diào)制處理。參照丁時超等[19]方法測定調(diào)制前后煙葉中TSNA的含量。取適量煙葉除去主脈,在研缽中加入液氮迅速磨成粉末狀,過40目篩,準確稱取1.000 g待測煙粉用0.1%乙酸銨的水溶液(用雙蒸水配制)超聲萃取30 min,萃取液與等體積的乙腈(溶液中含有100 ng/mL內(nèi)標)混合,高速離心分離后取上層清液,經(jīng)0.22 μm水系微孔濾膜過濾,采用LC-MS/MS儀定量分析煙葉中TSNA含量。實驗所需內(nèi)標(NNN-d4和NNK-d4,純度大于99%)和標樣(NNN、NAT、NAB和NNK,純度大于98%)均購自加拿大的TRC公司。
1.3 煙草材料遺傳多樣性的分析
采收煙草幼苗,按李榮華等[20]改進的CTAB方法提取煙草樣品的DNA。根據(jù)Bindler等[21]的研究結果,選用分布于煙草24個連鎖群的30個SSR標記(表2)來檢測煙草材料的遺傳多樣性,PCR擴增體系參考何其芳等[22]所描述的方法進行;同時依據(jù)Yang等[23]MFLP技術的原理,結合熒光標記技術,檢測煙草材料的遺傳多樣性,試驗所使用的MFLP引物信息如表3所示。MFLP操作流程參考何其芳等[24]所描述的方法進行。PCR擴增產(chǎn)物在LICOR 4300 DNA遺傳分析儀上進行變性聚丙烯酰胺凝膠電泳檢測,使用GelBuddy 軟件[25]對熒光掃描圖譜中的擴增條帶進行判讀,根據(jù)條帶的有無,排除模糊不清的條帶和無法準確標識的條帶,然后構建0,1二元數(shù)據(jù)矩陣,根據(jù)熒光標記DNA Marker 50-350 分子量標準,確定擴增條帶的分子量來計算SSR標記和MFLP標記在煙草群體內(nèi)的多態(tài)性。利用NTSYS-pc 2.11軟件(Biostatistics Inc.,USA)計算了各煙草材料之間的遺傳相似系數(shù),然后采用非加權算術平均(Unweighted Pair-Group Mean Average,UPGMA)方法構建了煙草材料間的遺傳聚類圖。試驗所需的熒光引物M13-F-IRDye 700(5′-CACGACGTTGTAAAACGAC-3′)購自美國LICOR 公司,其它引物、酶和試劑均購自上海生物工程有限公司。
1.4 關聯(lián)分析
為了減少基因型與表型關聯(lián)分析中存在的假陽性, 應用Structure 2.3軟件(Pritchard et al.2000),對24個煙草材料進行基于數(shù)學模型的類群劃分, 并計算材料相應的Q 值(第i材料其基因組變異源于第k 群體的概率)。然后將各個體Q值作為協(xié)變量,使用TASSEL軟件的GLM(General Linear Model)程序[26],對煙葉的TSNA含量與標記多態(tài)性進行線性回歸分析,閾值選擇以P<0.05為顯著性,P<0.01為極顯著性。
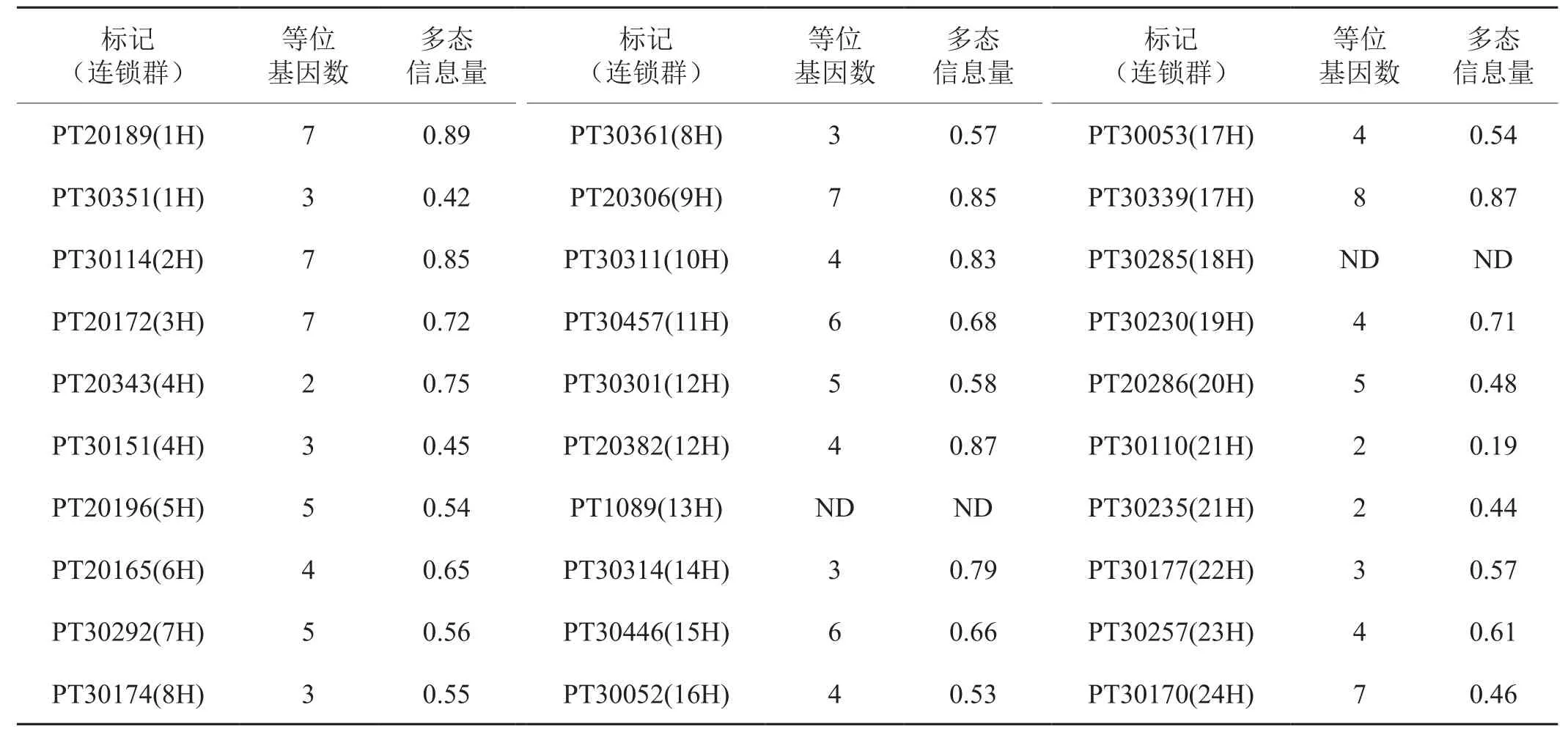
表2 30個SSR標記的名稱,等位位點數(shù)及多態(tài)信息量(PIC)Tab.2 Name, number of alleles and polymorphism information content (PIC) of 30 SSR markers

表3 MFLP 預擴增和選擇性擴增的引物Tab.3 MFLP primers used in pre- and selective-amplification
2 結果與分析
2.1 不同煙草品種調(diào)制前后煙葉中TSNA含量的差異
經(jīng)LC-MS/MS檢測分析,24個煙草品種調(diào)制前后煙葉中TSNA含量的統(tǒng)計結果如表4所示。由表4可知,調(diào)制前煙葉中TSNA含量較低,TSNA總含量的平均值僅為32.85 ng/g,其中NNK在所有材料中都檢測不到含量;調(diào)制后煙葉中TSNA顯著增加,TSNA總含量的平均值增加到144.56 ng/g,其中NNN增加最顯著,占TSNA總增加量的70%以上。不同煙草品種間TSNA含量的變異較大,調(diào)制前青煙葉中的NNN、NAT和NAB等3種成分的變異系數(shù)略低于調(diào)制后煙葉,而調(diào)制前后煙葉中TSNA總含量的變異系數(shù)基本一致,分別為1.47和1.49,這點說明煙葉中TSNA含量受品種基因型影響較大,且TSNA含量在群體中呈現(xiàn)連續(xù)分布,表明該性狀受多基因控制。煙葉中TSNA各成分的相關性分析顯示(表4),除調(diào)制前煙葉中NAB成分外,調(diào)制前后煙葉中其余各成分之間都存顯著性正相關,且調(diào)制前煙葉中TSNA總含量與調(diào)制后煙葉中TSNA總含量也存顯著性正相關,說明控制這4個TSNA含量的多基因中可能存在一些相同的微效基因。
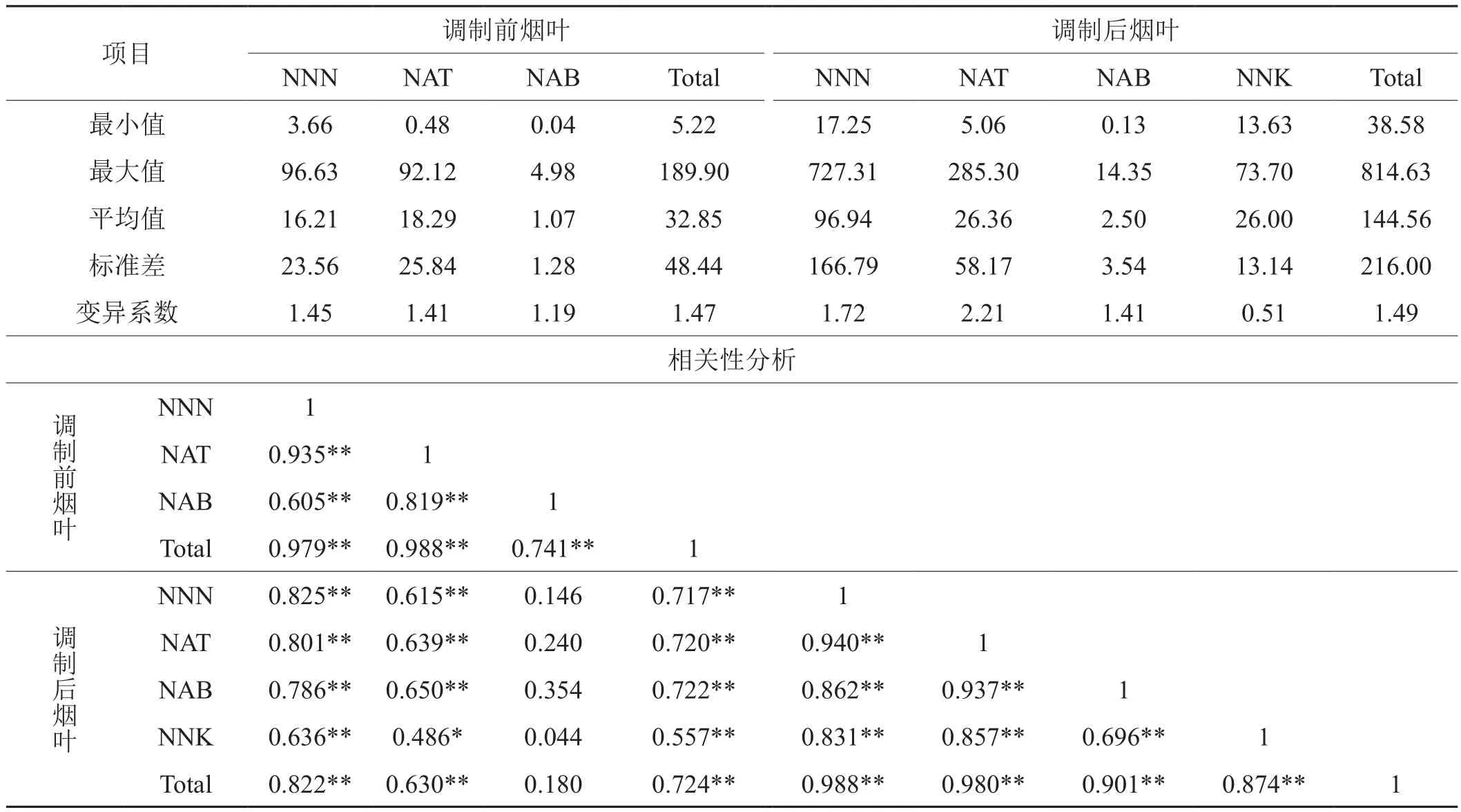
表4 煙葉中TSNA含量及相關性分析Tab.4 TSNA content and its association analysis in tobacco leaves ng/g
2.2 煙草材料的遺傳多樣性及群體結構
試驗所用的30個SSR 標記中,由于2個SSR標記沒有擴增出特異性條帶,僅用了28個SSR標記對24份煙草材料的遺傳多樣性進行了分析,共檢測到127個等位變異,結果如表3所示;而MFLP多態(tài)性分析中, 5個加尾SSR錨定引物分別與15種MseI選擇性擴增引物組合后篩選出33對適宜的引物組合,在24個煙草材料中共檢測到61個多態(tài)位點。基于SSR標記和MFLP標記共同發(fā)現(xiàn)的188個多態(tài)位點,計算24個煙草材料間的遺傳相似系數(shù),再進行UPGMA聚類分析,結果如圖1所示。由圖1 可知,在相似系數(shù)0.65水平上,可將24個煙草品種分為3個分支:C1、C2和C3。第1分支(C1)僅包括兩個烤煙品種,T1245 和 S1640; 第2分支(C2)包括2個晾曬煙(81-26和青梗)和1個烤煙品種(索馬里5號),第3個分支(C3)包括1個晾曬煙(粵紅一號)和16個烤煙品種和2個白肋煙。采用Structure 2.3軟件分析參試種質(zhì)的遺傳結構,確定參試種質(zhì)的亞群數(shù)目。結果表明24個煙草種質(zhì)的等位變異頻率特征類型數(shù)K=3(即服從Hardy-Weinberger平衡的亞群數(shù)目為3)時其模型后驗概率最大,因此24個煙草材料分為3個亞群:G1,G2 和G3,分別包含了16、4和4個煙草材料(圖2)。由圖2可知,除了少數(shù)材料,Structure 2.3 軟件的亞群分析與UPGMA聚類分析大體一致,其中G1的16個煙草材料都分布在C1中,G2包含了C2的3個煙草材料和C1中的1個晾曬煙,G3 包含了C3的2個煙草材料和C1中的2個白肋煙。進一步分析亞群的生物學意義,發(fā)現(xiàn)24個煙草亞群劃分與不同煙草類型(烤煙、晾曬煙和白肋煙)基本一致。
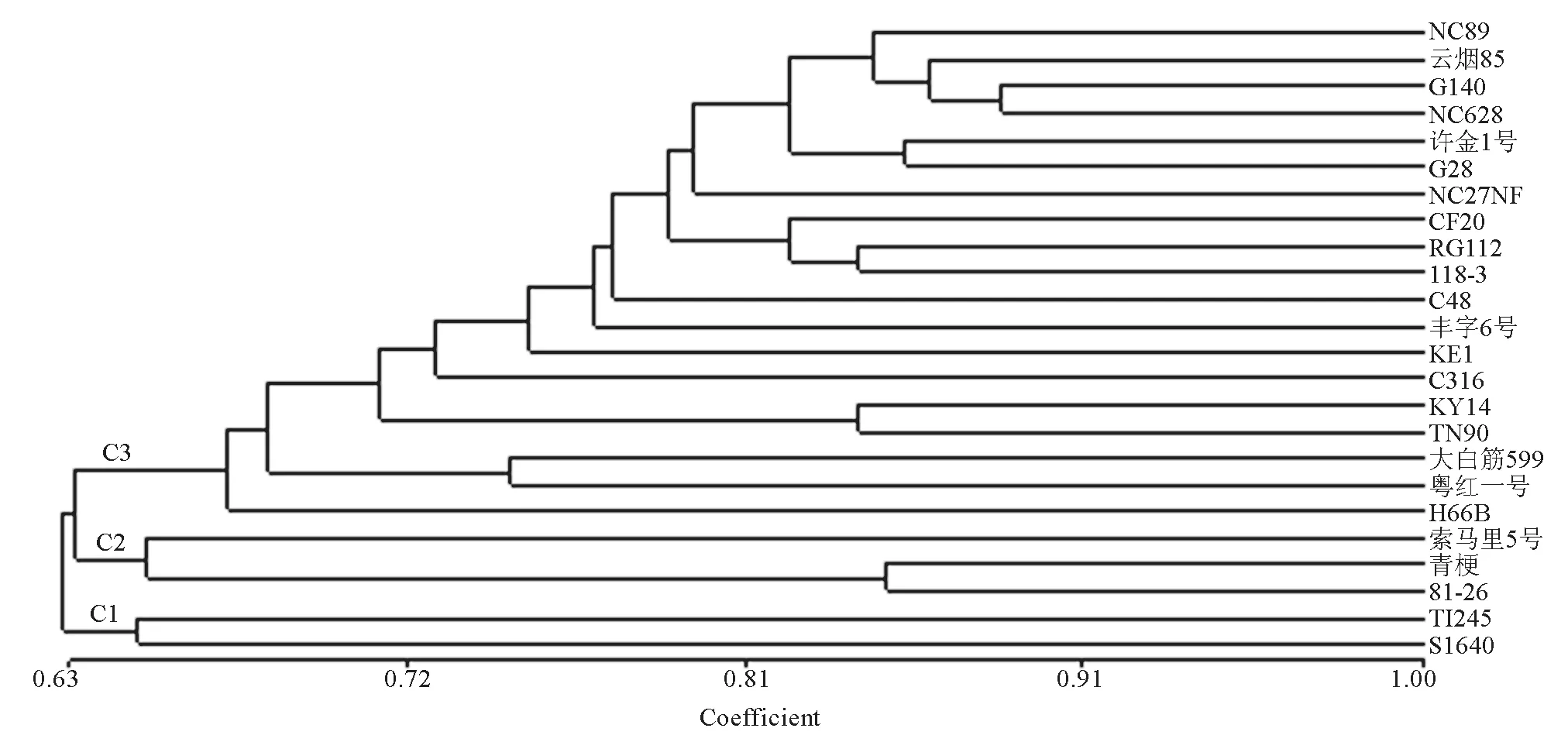
圖1 24 個煙草品種基于遺傳相似系數(shù)的UPGMA聚類分析Fig.1 UPGMA cluster analysis of 24 tobacco accessions based on genetic similarity coefficient
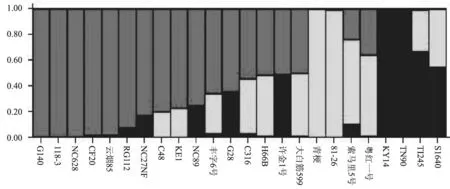
圖2 24個煙草品種的群體結構分析Fig.2 Population structure of 24 tobacco accessions
2.3 煙葉TSNA含量與分子標記的關聯(lián)分析
鑒于煙草材料由3個亞群體組成,將各個體相應的Q值作為協(xié)變量,利用TASSEL軟件分析28個SSR標記和61個MFLP標記與煙葉中4種TSNA含量之間的關聯(lián)性。關聯(lián)分析結果顯示,6個MFLP標記和1個SSR標記的變異至少與煙葉中1種TSNA含量在P<0.01水平上顯著關聯(lián),其中1個MFLP標記(MFLP26)存在極顯著相關性(P<0.001);7個關聯(lián)標記對表型變異的解釋率在28.78%~58.31%之間,平均值為36.02% (表5)。
由表5可知,SSR標記(PT30151)與調(diào)制后煙葉中NAB、NAT和NNK的含量都顯著關聯(lián),其表型變異解釋率分別為30.93%、40.20%和39.30%;同時,該SSR標記與調(diào)制前煙葉中NNN的含量也顯著關聯(lián),其表型變異解釋率41.17%。6個顯著關聯(lián)的MFLP標記中,MFLP55和MFLP5 分別與調(diào)制后煙葉中NAB和NNK的含量顯著關聯(lián),其表型變異的解釋率分別為28.78%和31.83%;MFLP26和MFLP1同時與調(diào)制后煙葉中NNN的含量顯著關聯(lián),其表型變異的解釋率分別為58.31%和34.12%;MFLP7同時與調(diào)制前煙葉中NAT和NNN顯著關聯(lián),其表型變異的解釋率分別為29.27%和31.00%;MFLP31與調(diào)制前煙葉中NNN顯著關聯(lián),其表型變異的解釋率為31.28%。
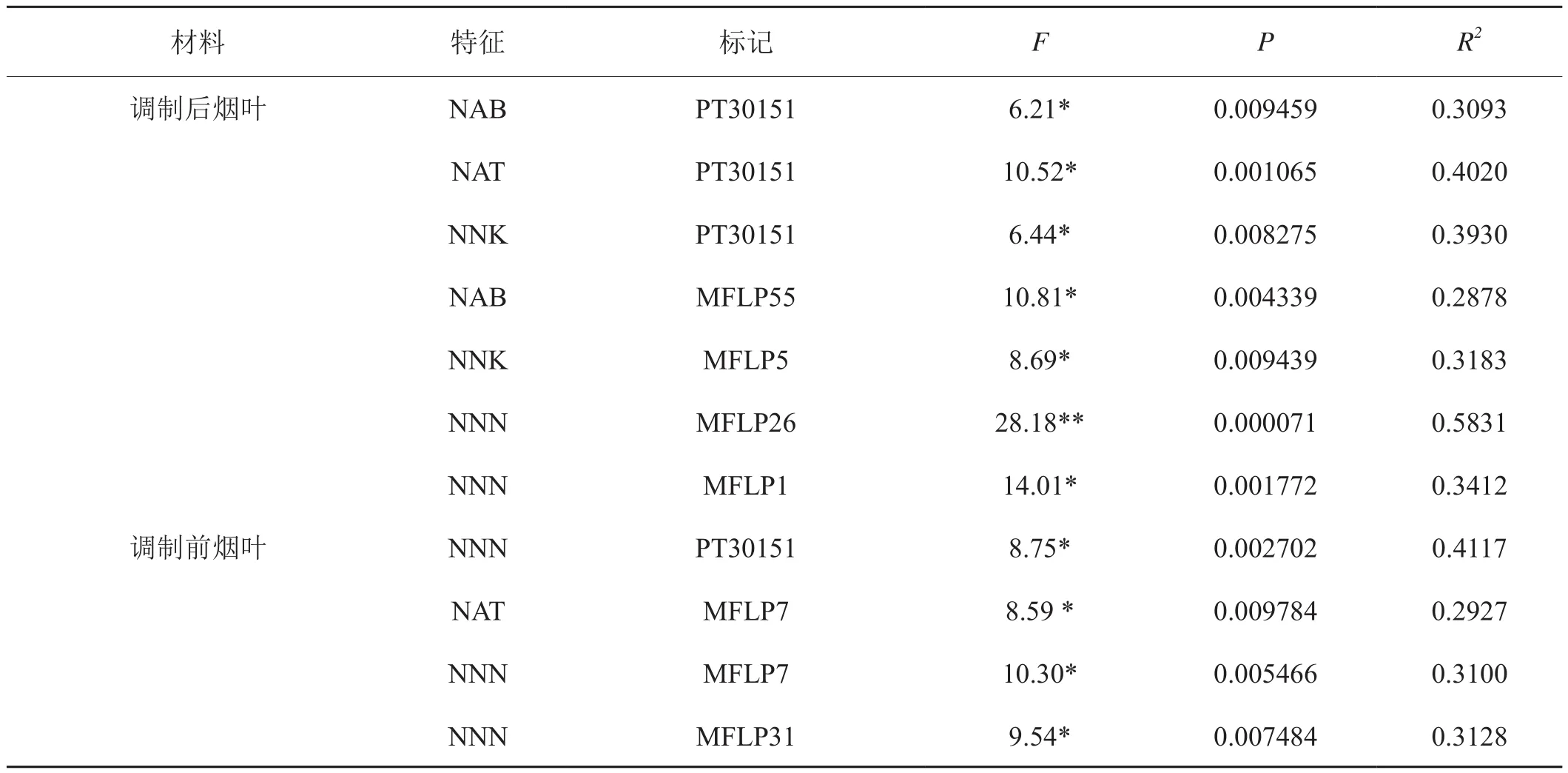
表5 與TSNA含量顯著相關的標記位點及對表型變異的解釋率Tab.5 Marker loci associated with TSNA content and their explained portion of phenotypic variation
3 討論
關聯(lián)分析 (association analysis),又稱關聯(lián)作圖(association mapping),是一種以連鎖不平衡為基礎,以自然群體為研究對象,將目標性狀表型的多樣性與基因(或標記位點)的多態(tài)性結合起來分析,可直接鑒定出與表型變異密切相關且具有特定功能的基因位點或標記位點[27]。與傳統(tǒng)的QTL作圖相比,關聯(lián)分析具有3個明顯特點:(1)花費時間少,不需要專門構建作圖群體,自然群體或種質(zhì)資源都可作為研究材料;(2)廣度大,廣泛的遺傳材料可同時考察多個性狀的關聯(lián)位點及其等位變異,不受傳統(tǒng)QTL作圖的“兩親本范圍”的限制;(3)精度高,利用自然群體在長期進化中積累的重組信息,具有較高的解析率,可實現(xiàn)數(shù)量性狀基因座的精細定位[28-29]。目前,關聯(lián)分析已在擬南芥[30]、玉米[31]、水稻[32]、小麥[33]和高粱[34]等作物中廣泛應用。
關聯(lián)分析中最大的問題是假陽性關聯(lián)的增大,這是由于材料的群體結構沒有被計算而引起的等位變異評估的偏差產(chǎn)生[35]。本研究利用分布煙草24個染色體的28個SSR標記和MFLP標記技術分析煙草材料遺傳多樣性的基礎上,對材料的群體結構進行了分析,24個煙草材料分為3個亞群(G1-G3),與UPGMA聚類分析分布的3個分支(C1-C3)比較,除了少數(shù)材料,亞群分布與遺傳聚類分支基本對應(G1/C1,G2/C2和G3/C3),且亞群劃分與煙草類型(烤煙、晾曬煙和白肋煙)基本一致。早期的一些研究也顯示,我國煙草材料不同煙草類型間遺傳差異較大,而種內(nèi)遺傳多樣性水平較低,且不同地理來源品種間的遺傳差異不明顯[36-37,22]。因此,群體結構分析比UPGMA聚類分析能更好地從分子水平上揭示煙草種質(zhì)資源的遺傳背景和親緣關系。
利用了群體結構分析中材料的Q值作為協(xié)變量來關聯(lián)分析多態(tài)位點與TSNA含量間的關系,結果顯示煙草群體中1個SSR位點和6個MFLP位點至少與1種TSNA的相關性在P<0.01水平上顯著,其中SSR位點與4種TSNA顯著關聯(lián),該位點可能共同作用于這4種TSNA的形成;而4個MFLP位點都與NNN顯著關聯(lián),則表明NNN可能由多基因控制,其中標記MFLP26可能與其主效基因相關聯(lián)。劉萬峰[13]對不同組合的親本和F1中的TSNA研究也推斷,TSNA含量是一種由寡基因控制的不完全顯性遺傳或者是一種由微效多基因控制的數(shù)量性狀。多數(shù)研究證實[8,38-41],TSNA在鮮煙葉中積累很少或幾乎不產(chǎn)生,其形成與積累主要是在采收后產(chǎn)生的,且大部分是產(chǎn)生于調(diào)制期間。在調(diào)制過程中,煙草中的硝酸鹽被微生物還原為亞硝酸鹽以及氮氧化物(NOx),然后與煙草生物堿作用形成TSNA[42],且調(diào)制后煙葉中TSNA含量與煙葉中的煙堿及亞硝酸鹽的含量呈正相關性[10,41,44]。史宏志等[18]研究顯示,煙堿轉化在遺傳上受顯性基因控制,通過遺傳改良降低煙堿轉化率和降煙堿含量可有效降低煙葉NNN和總TSNA的含量。Julio等[45]利用114個烤煙重組自交系發(fā)現(xiàn)了控制降煙堿和假木賊煙堿含量的4個QTL位點,其對變型變異的解釋率在9.0%~27.8%,這些QTL位點也間接地影響煙葉TSNA的含量。本次試驗結果顯示,調(diào)制后的煙葉總TSNA的含量比調(diào)制前煙葉增加了3.4倍之多,但調(diào)制前后煙葉中總TSNA含量間的相關系數(shù)僅為0.724,且調(diào)制前后顯著關聯(lián)的分子標記也不盡相同,這可能的原因是不同品種間煙葉中煙堿和亞硝酸鹽含量存在一定差異,或調(diào)制方式及微生物含量的變動,致使調(diào)制后品種間煙葉中TSNA含量有較大變化。因此,本實驗顯著關聯(lián)的分子標記需要在雜交群體中進一步驗證后才能應用于分子輔助育種。
4 結論
利用分布于全基因組的28個SSR標記和MFLP標記技術,分析了24個煙草材料的遺傳特性,群體結構分析發(fā)現(xiàn),24個煙草材料分為3個亞群,且亞群劃分與不同基因類型(烤煙、晾曬煙和白肋煙)相關。對煙葉中TSNA含量的變異與標記的多態(tài)性關聯(lián)分析顯示,6個MFLP標記和1個SSR標記的變異至少與煙葉中1種TSNA含量在P<0.01水平上顯著性關聯(lián),其中1個MFLP標記(MFLP26)存在極顯著性相關聯(lián)(P<0.001)。這些關聯(lián)標記可能為進一步的培育出低TSNA的高安全性煙草品種提供參考,也為采用分子生物學手段或常規(guī)育種手段來進行遺傳改良降低煙草中的TSNA含量提供了可靠的方法與途徑。
[1]Hecht S S, Chen C H B, Young R, et al.Mass spectra of tobacco alkaloid-derived nitrosamines, their metabolites,and related compounds[J].Beitr?ge zur Tabakforschung International, 1981, 11(2): 57-66.
[2]Brunnemann K D, Hoffmann D.Analytical studies on tobaccospecific N-nitrosamines in tobacco and tobacco Smoke[J].Critical Reviews in Toxicology, 1991, 21(4): 235-240.
[3]Hecht S S, Hoffmann D.The relevance of tobacco-specific nitrosamines to human cancer[J].Cancer Surveys, 1989, 8(2):273-294.
[4]Spiegelhalder B, Bartsch H.Tobacco-specific nitrosamines[J].European Journal of Cancer Prevention, 1996, 5 (S1): 33-38.
[5]Hecht S S.Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines[J].Chemical Research in Toxicology, 1998, 11(6): 559-603.
[6]Wu J C, Joza P, Sharifi M, et al.Quantitative method for the analysis of tobacco-specific nitrosamines in cigarette tobacco and mainstream cigarette smoke by use of isotope dilution liquid chromatography tandem mass spectrometry[J].Analytical Chemistry, 2008, 80(4):1341-1345.
[7]李勇.卷煙主流煙氣中幾類有害化合物的分析技術的研究與應用[D].湘潭: 湘潭大學, 2007.
[8]Bhide S V, Nair J, Maru G B, et al.Tobacco-specific N-nitrosamines (TSNA) in green mature and processed tobacco leaves from India[J].Beitrage zur Tabakforschung International, 1987, 14(1): 107-112.
[9]史宏志, Bush L P, 黃元炯, 等.我國煙草及其制品中煙草特有亞硝胺含量及與前體物之間的關系[J].中國煙草學報, 2002, 8(1): 14-19.
[10]Chamberlain W J, Chortyk O T.Effects of curing and fertilization on nitrosamine formation in bright and burley tobacco[J].Beitr?ge zur Tabakforschung international, 1992,2(15): 87-91.
[11]Burton H R, Dye N K, Bush L P.Relationship between tobacco specific N-nitrosamines and nitrite from different air-cured tobacco varieties[J].Journal of agricultural and food chemistry,1994, (42): 2007-2011.
[12]余義文, 夏巖石, 李榮華, 等.不同類型及品種煙草特有亞硝胺含量的分析[J].煙草科技, 2013(4): 46-51.
[13]劉萬峰.不同基因型烤煙煙葉中TSNA及其前體物質(zhì)的研究[D].北京: 中國農(nóng)業(yè)科學學院, 2002.
[14]Lewis R S, Parker R G, David A, et al.Impact of alleles at the yellow burley (Yb) loci and nitrogen fertilization rate on nitrogen utilization efficiency and tobacco-specific nitrosamine(TSNA) formation in air-cured tobacco[J].Journal of agricultural and food chemistry, 2012, 60: 6454-6461.
[15]Guo Peiguo, Xia Yanshi, Li Ronghua, et al.Assessment of tobacco specific nitrosamines in tobacco genotypes[J].Advanced Materials Research, 2013, 641(642):871-874.
[16]張俊杰, 林國平, 王毅, 等.白肋煙低TSNA含量的品種篩選初探[J].中國煙草學報, 2009, 15(3): 54-57.
[17]史宏志, 劉國順.白肋煙煙堿轉化及煙草特有亞硝胺形成[J].中國煙草學報, 2008, 14(增刊): 41-46
[18]史宏志, 李進平, 李宗平, 等.遺傳改良降低白肋煙雜交種煙堿轉化率研究[J].中國農(nóng)業(yè)科學, 2007, 40(1): 153-160.
[19]丁時超, 杜文, 任建新, 等.LC-MS /MS 定量分析卷煙中的煙草特有亞硝胺(TSNA) [J].中國煙草學報, 2005,11(6):17-21.
[20]李榮華, 夏巖石, 劉順枝, 等.改進的CTAB提取植物DNA方法[J].實驗室研究與探索, 2009, 28(9): 14-16.
[21]Bindler G, Hoeven R, Gunduz I, et al.A microsatellite marker based linkage map of tobacco[J].Theor Appl Genet, 2007,114: 341-349.
[22]何其芳, 李榮華, 郭培國, 等.利用SSR熒光標記技術分析煙草種質(zhì)的遺傳多樣性[J].中國農(nóng)學通報, 2012a,28(10): 95-102.
[23]Yang H, Sweetingham M W, Cowling W A, et al.DNA fingerprinting based on microsatellite-anchored fragment length polymorphisms, and isolation of sequence-specific PCR markers in lupin (Lupinus angustifoliusL.)[J].Molecular Breeding, 2001(7): 203-209.
[24]何其芳, 李榮華, 郭培國, 等.利用熒光MFLP 標記技術分析煙草種質(zhì)的遺傳多樣性[J].中國煙草科學, 2012b,33(1): 12-18.
[25]Zerr T, Henikoff S.Automated band mapping in electrophoretic gel image using background information[J].Nucleic Acids Research, 2005, 33: 2806-2812.
[26]Bradbury P J, Zhang Z, Kroon D E, et al.TASSEL: software for association mapping of complex traits in diverse samples[J].Bioinformatics, 2007, 23(19): 2633-2638.
[27]March R E.Gene mapping by linkage and association analysis[J].Mol Biotechnol, 1999, 13: 113-122.
[28]Yu J, Edward S B.Genetic association mapping and genome organization of Maize[J].Current Opinion in Biotechnology,2006, 17: 155-160.
[29]Mackay I, Powell W.Methods for linkage disequilibrium mapping in crops[J].Trends Plant Science, 2007, 12: 57-63.
[30]Ehrenreich I M, Hanzawa Y, Chou L, et al.Candidate gene association mapping of Arabidopsis flowering time[J].Genetics, 2009, 183: 325-335.
[31]Harjes C E, Rocheford T R, Bai L, et al.Natural genetic variation in lycopene epsilon cyclase tapped for maize biofortification[J].Science, 2008, 319: 330-333.
[32]Iwata H, Ebana K, Uga Y, et al.Genome-wide association study of grain shape variation amongOryza sativaL.germplasms based on elliptic Fourier analysis[J].Molecular Breeding, 2010, 25: 203-215.
[33]Breseghello F, Sorrells M E.Association mapping of kernel size and milling quality in wheat (Triticum aestivumL.)cultivars[J].Genetics, 2006, 172: 1165-1177.
[34]Casa A M, Pressoira G, Brown P J, et al.Community resources and strategies for association mapping in sorghum[J].Crop Sciences, 2008, 48: 30-40.
[35]Ahmadi N, Negr?o S, Katsantonis D, et al.Targeted association analysis identifiedjaponicarice varieties achieving Na+/K+homeostasis without the allelic make-up of the salt tolerantindicavariety Nona Bokra[J].Theoretical and Applied Genetics, 2011, 123: 881-895.
[36]楊友才, 周清明, 尹晗琪.利用RAPD和AFLP標記分析煙草種質(zhì)資源的遺傳多樣性[J].農(nóng)業(yè)生物技術學報,2006, 14(4): 585-593.
[37]李鳳霞, 王衛(wèi)鋒, 王魯, 等.煙草屬植物遺傳多樣性和親緣進化關系的熒光AFLP分析[J].中國農(nóng)業(yè)科學, 2010,43(12): 2418-2427.
[38]楊煥文,李永忠,劉彥中,等.白肋煙晾制中亞硝胺及前體物質(zhì)的變化[J].西南農(nóng)業(yè)大學學報,1999, 21(5): 444-448.
[39]劉國順, 趙春華, 崔樹毅, 等.煙草特有亞硝胺及其前體物的研究進展[J].中國煙草學報, 2007, 13(1): 44-47.
[40]雷麗萍,Luo L, Shi H, 等.煙葉調(diào)制過程中相關物質(zhì)的測定[J].中國煙草科學,2002, 23(4): 32-34.
[41]Djordjevic M V, Gay S L, Bush L P, et al.Tobacco-specific nitrosamine accumulation and distribution in flue-cured tobacco alkaloid isolines[J].J Agr Food Chem, 1989, 37(3):752-756.
[42]宮長榮,沈劍波,司輝,等.煙草N-TSNAs 及其前體物在煙葉烘烤過程中含量的變化[J].中國農(nóng)學通報,2007,23(6): 179-182.
[43]Burton H R, Childs G H, Anderson R A, et al.Changes in chemical composition of burley tobacco during senescence and curing.3.tobacco-specific nitrosamines[J].J Agr Food Chem,1989, 37(2): 426-430.
[44]Mackown C T, Eivagi F, Sims L.Tobacco specific N-nitrosamines: effects of burley isolines and nitrogen fertility management[J].J Agr Food Chem, 1984, 32(6): 1269-1272.
[45]Julio E, Denoyes-Rothan B, Verrier J L, et al.Detection of QTLs linked to leaf and smoke properties inNicotiana tabacumbased on a study of 114 recombinant inbred lines [J].Mol Breed, 2006, 18: 69-91.
Association analysis of tobacco specific nitrosamines content in tobacco germplasm
YU Yiwen1, XIA Yanshi1, LI Ronghua1, Lü Yonghua2, GUO Peiguo1, QIU Miaowen3, ZHAO Weicai3, HE Qifang2
1 College of Life Sciences, Guangzhou University, Guangzhou 510006, China;
2 Guangdong Provincial Tobacco Monopoly Administration, Guangzhou 510610, China;
3 Nanxiong Research Institute of Guangdong Tobacco Co.Ltd., Nanxiong, Guangdong 512400, China
Genetic diversity analysis for 24 tobacco accessions was performed with SSR and MFLP markers which distributed in 24 chromosomes.Association analysis was conducted between polymorphic markers and tobacco specific nitrosamine (TSNA) contents through GLM model using software TASSEL.Result showed that 188 allelic variations were detected among 24 tobacco accessions with 33 MFLP and 28 SSR primer combinations.These accessions were clustered into 3 subgroups in genetic analysis of population structure.The subgroup is in coincidence with tobacco types, i.e.flue-cured, sun-cured and burley.Association analysis showed that 6 MFLP markers and 1 SSR marker were associated with at least one of TSNA contents at P<0.01 level.The marker of MFLP26 was significantly associated with NNN content (P<0.001), and explains 58.31% of phenotypic variation for NNN content in cured leaves.These markers could be used in tobacco breeding programmes to assist with selection of tobacco genotypes with low TSNA content.
tobacco specific-nitrosamine; SSR marker; MFLP marker; association analysis
國家煙草專賣局面上項目“煙草特有亞硝胺含量的關聯(lián)分析及遺傳篩選”(2010[99]18);廣東省煙草專賣局科技計劃項目“煙草特有亞硝胺含量的關聯(lián)分析及遺傳篩選”(200903)
余義文(1987—),碩士研究生,主要從事煙草分子生物學研究,Tel: 020-39366915, Email: 358614803@qq.com
郭培國(1963—),博士,教授,主要從事作物功能基因組和分子遺傳育種的教學與研究,Tel: 020-39366915,Email: guopg@yahoo.com
2013-02-12
10.3969/j.issn.1004-5708.2014.03.008
S572.03; Q78 文獻標志碼:A 文章編號:1004-5708(2014)03-0048-08

