高強度聚焦超聲治療對肝癌細胞裸鼠移植瘤低氧誘導(dǎo)因子表達和細胞凋亡的影響
付志豪,武 倫,喬正榮,周世驥,李生偉*
(重慶醫(yī)科大學(xué) 附屬第二醫(yī)院 1.肝膽外科; 2.胃腸外科, 重慶 400010;3.重慶市第五人民醫(yī)院 普外科, 重慶 400062)
研究論文
高強度聚焦超聲治療對肝癌細胞裸鼠移植瘤低氧誘導(dǎo)因子表達和細胞凋亡的影響
付志豪1,武 倫1,喬正榮3,周世驥2,李生偉1*
(重慶醫(yī)科大學(xué) 附屬第二醫(yī)院 1.肝膽外科; 2.胃腸外科, 重慶 400010;3.重慶市第五人民醫(yī)院 普外科, 重慶 400062)
目的探討高強度聚焦超聲(HIFU)治療后的殘余肝癌組織中低氧誘導(dǎo)因子(HIF-1α)、P53和凋亡的變化及關(guān)系。方法建立肝癌HpG2細胞系裸鼠移植瘤模型30只,采用CZF-Ⅱ型HIFU治療儀治療,隨機分為對照組、治療后1、3及5 d和1及2周組。HE染色觀察標(biāo)本病理變化;TUNEL法檢測殘余癌組織凋亡及計算凋亡指數(shù);免疫組化、Western blot和實時熒光定量 PCR技術(shù)檢測HIF-1α、P53蛋白和mRNA水平。結(jié)果治療后有殘余腫瘤細胞和大片壞死區(qū)域。與其他組相比,凋亡指數(shù)在3 d組顯著升高(Plt;0.05),在5 d、1和2周組逐漸下降。HIF-1α和P53蛋白在各組中出現(xiàn)強弱不同的表達。HIF-1α和P53蛋白和mRNA在治療后1~3 d表達逐漸升高,在3 d組顯著高于其他組(Plt;0.05),在5 d、1和2周組逐漸下降。結(jié)論HIFU治療肝癌細胞裸鼠移植瘤后可以促進殘余癌細胞凋亡,此可能與HIF-1α、P53基因表達異常關(guān)系密切。
肝癌;低氧誘導(dǎo)因子;凋亡;高強度聚焦超聲
肝癌(hepatocellular carcinoma)是一種常見的消化系統(tǒng)惡性腫瘤,手術(shù)切除一直是首要的治療手段。但由于肝癌的早期癥狀與體征不明確,致使大多患者在確診時就已錯過最佳手術(shù)治療時機。高強度聚焦超聲(high-intensity focused ultrasoun-d,HIFU)是一種對實體腫瘤進行非侵入性治療的局部治療手段[1],為中晚期肝癌的治療提供了契機。但是HIFU治療后殘余腫瘤組織是影響療效的主要因素。研究發(fā)現(xiàn),HIFU治療對腫瘤的微血管產(chǎn)生損害,導(dǎo)致殘余癌組織微環(huán)境低氧[2]。低氧會誘導(dǎo)機體產(chǎn)生一系列因子,其中最重要的是HIF-1α。同時低氧也可以誘導(dǎo)的P53表達增多,而P53是細胞凋亡最主要因子之一[3]。本研究通過建立人肝癌裸鼠移植模型,觀察HIFU治療后殘余癌組織中細胞凋亡與HIF-1α、P53的表達情況。
1 材料與方法
1.1 實驗材料
清潔級,裸鼠30只,6 ~8周齡,雌雄不限,體質(zhì)量18 ~20 g[重慶醫(yī)科大學(xué)動物實驗中心,合格證號SCXK(渝)2012-0001 ],混合飼料,隔籠喂養(yǎng)。
鼠抗人單克隆抗體HIF-1α、P53(Abcam公司),TUNEL試劑盒(Roche公司),免疫組化試劑盒(中衫金橋公司),RT reagent Kit(Takara公司),RNA抽提試劑盒(Omega公司),反轉(zhuǎn)錄試劑盒(Takara公司)。
1.3 方法
1.3.1 裸鼠肝癌移植瘤模型的建立、分組及治療方式:30只裸鼠, 用0.25%胰蛋白酶消化呈單個的人肝癌細胞HpG2(由重慶醫(yī)科大學(xué)生命科學(xué)院實驗室惠贈)細胞,調(diào)整細胞數(shù)至1×107/mL,在裸鼠右側(cè)前頸部皮下接種細胞懸液0.1 mL。待裸鼠皮下移植瘤直徑約0.5 ~1.0c m時,使用CZF-Ⅱ型超聲治療儀,輸入治療參數(shù)(探頭頻率8.6 MHz,脈沖1 000 Hz,功率5 W),治療時間為30 s。非治療組不給于任何處理。對照組、HIFU治療后1、3及5 d和1及2周各取5只裸鼠頸椎脫臼法處死,收集標(biāo)本。
1.3.2 HE染色觀察各組腫瘤組織的病理變化:處死裸鼠后,標(biāo)本使用4%多聚甲醛固定24 h后,給予常規(guī)脫水,透明浸蠟和包埋。石蠟切片,厚約4 μm,每組標(biāo)本取5片HE染色,光鏡下觀察。
1.3.3 缺口末端核苷標(biāo)記法(TUNEL)檢測凋亡及計算凋亡指數(shù):取出各組標(biāo)本,具體步驟按TUNEL試劑盒說明書進行。陽性標(biāo)準(zhǔn):顯微鏡下腫瘤細胞系顯色棕黃色顆粒為陽性,每組隨機取5個高倍視野(×400),計算凋亡指數(shù)(AI)=陽性細胞數(shù)/腫瘤細胞數(shù)×100%。
1.3.4 免疫組化檢測各組腫瘤組織中的HIF-1α和P53蛋白變化:取出各組標(biāo)本,采用免疫組化SP法檢測各組HIF-1α、P53蛋白表達情況。具體步驟按照免疫組化試劑盒說明書進行。陽性標(biāo)準(zhǔn):在顯微鏡下,胞質(zhì)或胞核出現(xiàn)棕黃色為陽性。
1.3.5 Western blot 檢測各組腫瘤組織中的HIF-1α和P53蛋白含量:取出各組標(biāo)本,提取組織蛋白、制備SDS-聚丙烯酸胺凝膠電泳、轉(zhuǎn)膜、封閉、孵育一抗、孵育二抗、洗滌等過程,然后顯影,分析結(jié)果。
1.3.6 實時熒光定量PCR法檢測各組基因HIF-1αmRNA和P53 mRNA的表達。將組織磨碎,提取無RNase的水溶解RNA,RNA定量。反轉(zhuǎn)錄參照試劑盒,熒光定量聚合酶鏈反應(yīng)擴增條件為95 ℃預(yù)變性2 min;隨后95 ℃ 10 s,退火溫度15 s,72 ℃ 延伸45 s,共40個循環(huán);最后72 ℃延伸10 min。上游引物5′-AAACCTAAATGTTCTGCCTAC-3′,下游引物5′-GGATGTTAATAGCGACAAAGT-3′。P53:上游引物5′-CCTCCTCAGCATCTTATCCG-3′,下游引物 5′-TGGTACAGTCAGAGCCAACCT-3′。采用ΔΔCT法進行實時定量PCR相對定量反應(yīng),計算相對含量。
(1)讓學(xué)生改變角色,想象自己是孟母。(2)小組討論:孟母在這樣的環(huán)境,看到孟子的表現(xiàn),她有什么感受?有何打算?
1.4 統(tǒng)計學(xué)分析
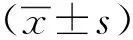
2 結(jié)果
2.1 移植瘤HIFU治療后的肉眼改變。
與對照組相比,1 d組標(biāo)本的消融區(qū)域可見到成灰白色的凝固性壞死,周圍存在殘余腫瘤組織。在消融后3及5 d和1及2周組的標(biāo)本可見靶向區(qū)存在陳舊性壞死 (圖1)。
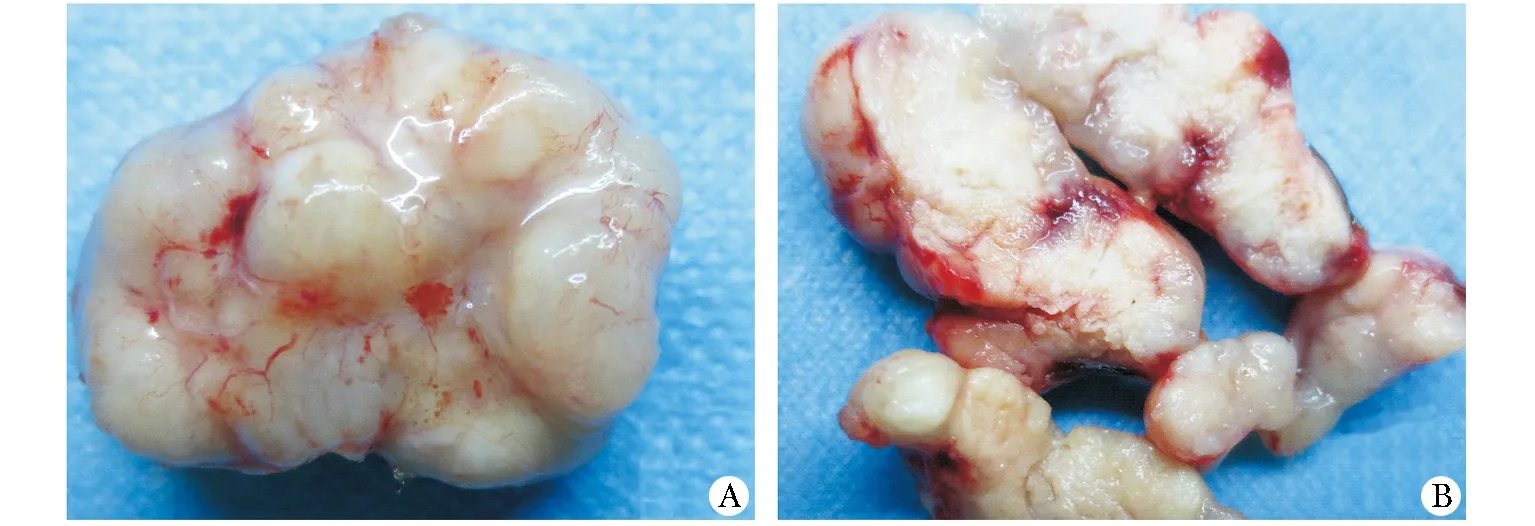
2.2 光鏡下HIFU治療后移植瘤的病理變化
與對照組相比,在1 d組的消融區(qū)出現(xiàn)大量壞死,在空白區(qū)域之間有殘留腫瘤細胞。在3 d組的消融靶區(qū)邊緣可見少量小血管和正常的腫瘤細胞,同時纖維組織增生,逐漸將壞死區(qū)域包裹。在5 d和1及2周組中殘余腫瘤細胞也在逐漸增生(圖2)。
2.3 在光鏡下TUNEL檢測殘余腫瘤的凋亡結(jié)果
在各組觀察的細胞凋亡,可見細胞系呈棕黃色顆粒的凋亡細胞(圖3)。與對照組相比,在1 d組凋亡指數(shù)出現(xiàn)升高(Plt;0.05)。在3 d組達到高峰,在5 d和1及2周組凋亡指數(shù)呈現(xiàn)下降趨勢(圖4)。
2.4免疫組化檢測HIF-1α、P53蛋白在各組的表達
在顯微鏡下,HIF-1α蛋白的表達定位于腫瘤細胞胞質(zhì),P53蛋白的表達定位于細胞系出現(xiàn)棕黃色顆粒。在對照組,可見胞質(zhì)或胞核染色淺,數(shù)量也較少。消融后胞質(zhì)或胞核染色逐漸加深,而且數(shù)量也逐漸增加(圖5)。
A.control group;B.1 day group圖1 HIFU治療后的移植瘤變化Fig 1 The changes of xenograft after treatment by HIFU
A.contol group;B.1 day group;C.1 week group圖2 不同組腫瘤的形態(tài)學(xué)改變Fig 2 Changes of morphology on tumorous tissues in different groups(HE ×200)
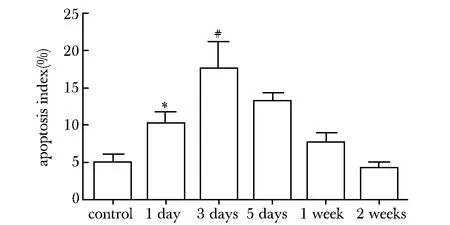
*Plt;0.05 compared with control group;#Plt;0.05 compared with other groups圖4 凋亡指數(shù)在各組情況Fig 4 Apoptosis index in different groups
2.5Westernblot檢測HIF-1α和P53蛋白在各組的表達
治療后HIF-1α和P53蛋白表達逐漸升高,在3 d組達到高峰(Plt;0.05)。在5 d和1及2周組HIF-1α和P53蛋白的表達呈現(xiàn)逐漸下降(圖6)。
2.6實時熒光定量PCR技術(shù)檢測HIF-1α、P53mRNA水平
治療后HIF-1α和P53 mRNA水平逐漸升高,在3 d組達到高峰(Plt;0.01)。在5 d和1及2周組HIF-1α和P53 mRNA的表達呈現(xiàn)逐漸下降(圖7)。
3 討論
HIFU是中晚期癌癥的一種安全易行的局部非侵入治療方法[4],已在部分良惡腫瘤中廣泛應(yīng)用[5],但在肝癌治療時由于肋骨遮擋、熱沉積效應(yīng)、呼吸運動和定位方式存在治療盲區(qū)等因素,引起殘癌細胞的存在,而后者正成為影響HIFU治療肝癌效果的關(guān)鍵環(huán)節(jié)[6]。因此,弄清殘癌細胞的凋亡規(guī)律可能為盡可能的殺傷殘癌組織、提高HIFU治療效果而備受關(guān)注。本實驗結(jié)果顯示HIFU治療肝癌細胞裸鼠移植瘤后,第1天腫瘤細胞凋亡指數(shù)顯著增加,3 d時達到高峰,隨后下降,2周時凋亡指數(shù)回到基線水平。此與HIFU消融兔肝后消融區(qū)域周圍出現(xiàn)的細胞凋亡變化規(guī)律相一致[7]。由此可見HIFU治療肝癌細胞裸鼠移植瘤后可以促進殘余癌細胞凋亡,其效應(yīng)的時間窗為2周。
本實驗通過檢測HIFU治療后殘余腫瘤組織中HIF-1α表達情況,發(fā)現(xiàn)其在治療后1 d顯著升高,在3 d時達到高峰,隨后下降。研究表明HIFU治療腫瘤時可以對腫瘤的微細血管造成嚴重損傷,從而導(dǎo)致殘余腫瘤組織的微環(huán)境低氧[2]。低氧可以引起HIF-1α的表達和聚集,它通過促進紅細胞生成,血管形成,核苷、氨基酸、糖的能量代謝,細胞存活,凋亡等生物學(xué)效應(yīng)使機體、 組織、細胞適應(yīng)低氧環(huán)境[8-9]。此可能部分解釋了HIFU治療早期殘癌細胞中HIF-1α表達上調(diào)。而另一方面已證實HIF-1α主要在氧濃度0%~2%之間穩(wěn)定聚集[10],隨著消融時間的延長,血管新生和單個殘癌細胞微環(huán)境氧含量的增多,HIF-1α?xí)谎杆俳到狻1緦嶒炓嘤^察到HIF-1α表達達峰后隨著HIFU治療時間延長表達下調(diào),同時還發(fā)現(xiàn)HIF-1α表達與殘癌細胞凋亡指數(shù)變化的時間點規(guī)律一致。關(guān)于HIFU治療后HIF-1α與殘癌細胞凋亡的機制尚不清楚,既往研究表明P53在低氧微環(huán)境時表達,而表達穩(wěn)定性與HIF-1α相關(guān)[11~12]。HIF-1α可以通過與MDM2結(jié)合,促進P53基因的穩(wěn)定從而促進低氧區(qū)域細胞凋亡[13]。因此本研究進一步觀察了P53在殘余腫瘤組織中表達情況,結(jié)果發(fā)現(xiàn)P53與HIF-1α和凋亡指數(shù)出現(xiàn)顯著升高的時間點基本一致。推測HIFU治療引起肝癌細胞裸鼠移植瘤的殘癌細胞凋亡作用可能與HIF-1α、P53基因表達異常關(guān)系密切,確切的信號通路機制本實驗課題組正在探討中。總之,HIFU治療肝癌細胞裸鼠移植瘤后可誘導(dǎo)殘余癌細胞凋亡,此效應(yīng)可能與HIF-1α、P53基因表達異常關(guān)系密切;調(diào)控HIF-1α基因的表達有望成為HIFU治療后殘余癌組織靶向殺傷作用的潛在靶點,這為增強HIFU治療效果提供了新方法。
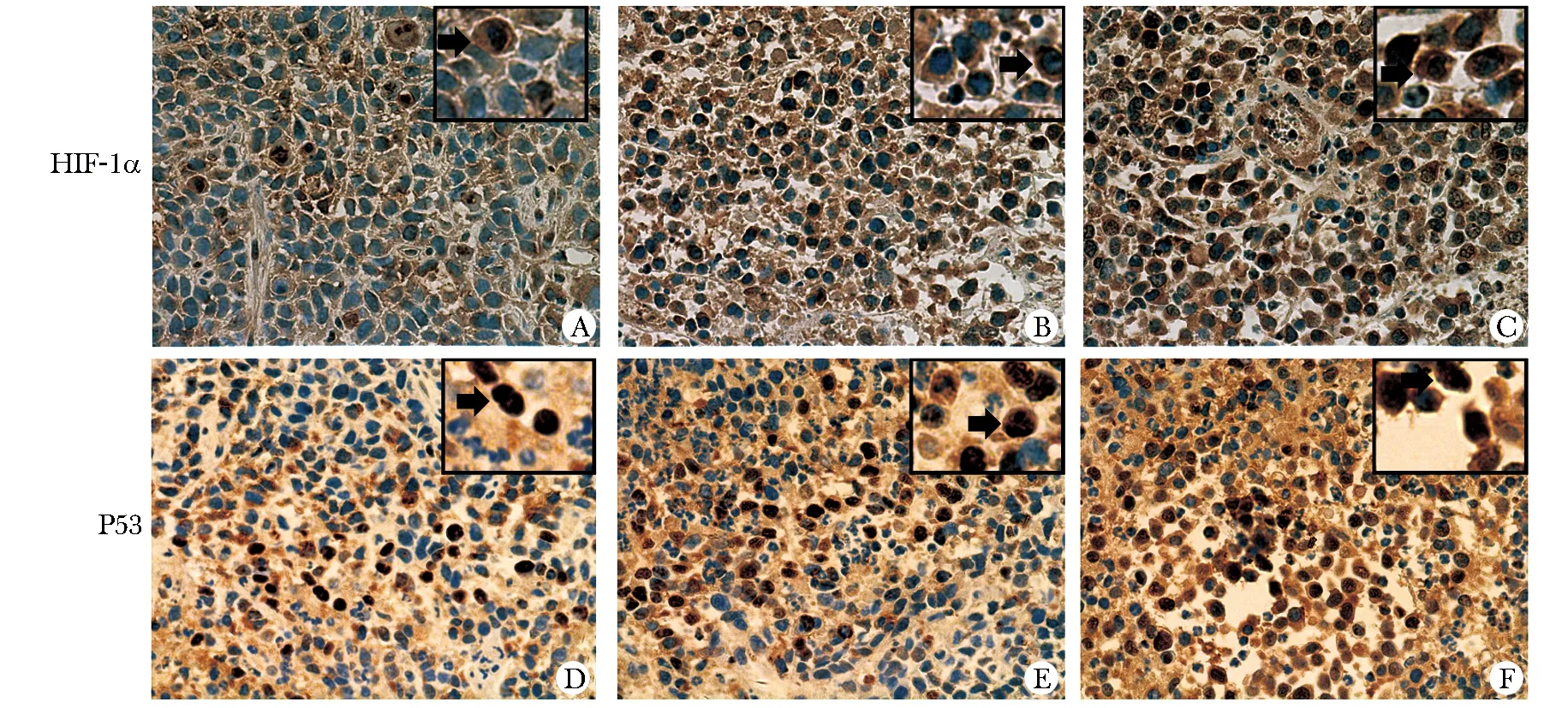
A.control group(weak) ; B.1 day group(moderate) ;C.3 days group(strong); D.control group (weak) ; E.1 day group(moderate) ;F.3 days group(strong)
圖5免疫組化檢測HIF-1α、P53蛋白表達的情況
Fig5ExpressionofHIF-1α,P53intumoroustissuesofdifferentgroups(Immunohistochemistry×400)
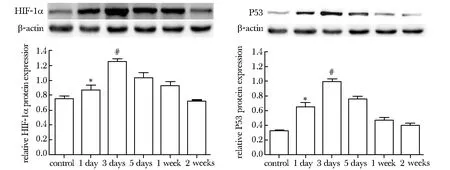
*Plt;0.05 compared with control group; #Plt;0.05 compared with other groups圖6 HIF-1α和P53蛋白在各組腫瘤組織中的表達Fig 6 Expression of HIF-1α,P53 in tumorous tissues of different groups detected by Western blot(±s,n=5)
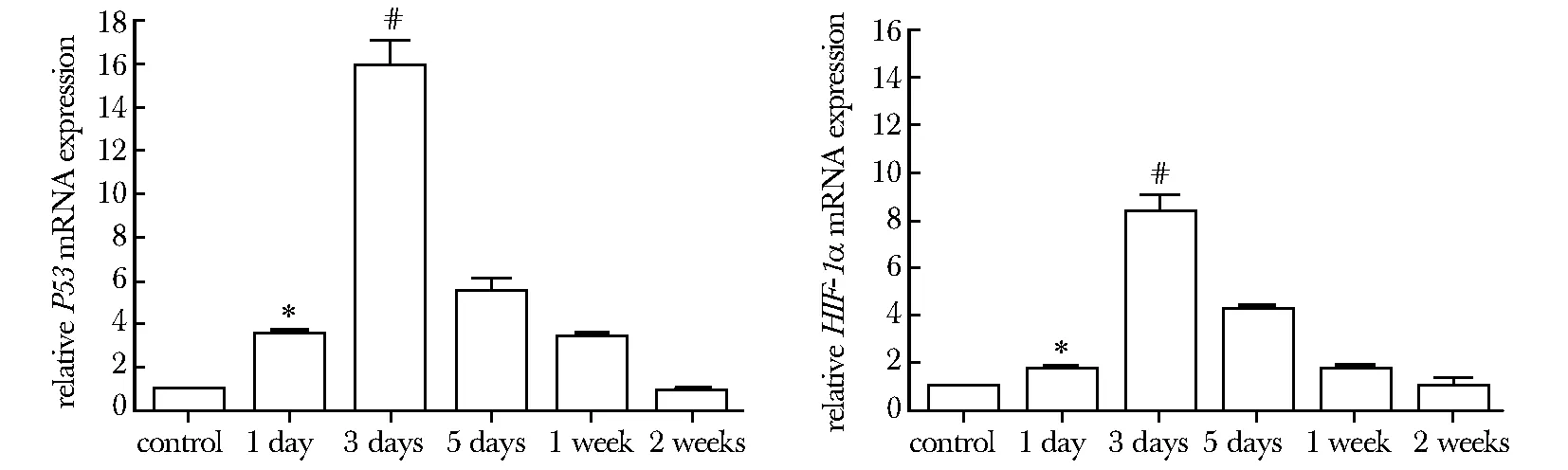
*Plt;0.05 compared with control group; #Plt;0.01 compared with other groups圖7 實時熒光定量 PCR檢測HIF-1α、P53 mRNA在各組中的表達
[1] Shen HP, Gong JP, Zuo GQ. Role of high-intensity focused ultrasound in treatment of hepatocellular carcinoma[J].Am Surg, 2011,77:1496-1501.
[2] Chen LP, Li N, Ye H.The Effect of high intensity focused ultrasound on vascular endothelial growth factor and microvessel density in rabbit V-X2 hepatocellular carcinoma models[J]. Hepatogastroenterology,2012,12;60.
[3] Weinmann M, Jendrossek V, Handrick R,etal.Molecular ordering of hypoxia-induced apoptosis: critical involvement of the mitochondrial death pathway in a FADD/caspase-8 independent manner[J].Oncogene,2004,6;23:3757-3769.
[4] Cheung TT, Fan ST, Chan SC,etal. High-intensity focused ultrasound ablation: An effective bridging therapy for hepatocellular carcinoma patients[J]. World J Gastroenterol,2013,28;19: 3083-3089.
[5] AL-Bataineh O, Jenne J, Huber P.Clinical and future applications of high intensity focused ultrasound in cancer[J].Cancer Treat Rev, 2012,38:346-353
[6] Rijkhorst EJ, Rivens I, Haar Gt,etal.Effects of respiratory liver motion on heating for gated and model-based motion-compensated high-intensity focused ultrasound ablation[J]. Med Image Comput Comput Assist Interv,2011;14(Pt 1):605-612.
[7] Luo W, Zhou X, Gong X,etal. Study of sequential histopathologic changes, apoptosis, and cell proliferation in rabbit livers after high-intensity focused ultrasound ablation[J].J Ultrasound Med,2007,26:477-485.
[8] Keith B, Johnson RS, Simon MC. HIF-1α and HIF2α: sibling rivalry in hypoxic tumour growth and progression[J]. Nat Rev Cancer,2011,15;12:9-22.
[9] Majmundar AJ, Wong WJ, Simon MC.Hypoxia-inducible factors and the response to hypoxic stress[J].Mol Cell,2010,40:294-309.
[10] Holmquist-Mengelbier L, Fredlund E, L?fstedt T,etal.Recruitment of HIF-1alpha and HIF-2alpha to common target genes is differentially regulated in neuroblastoma: HIF-2alpha promotes an aggressive phenotype[J].Cancer Cell,2006,10:413-423.
[11] Pan Y, Oprysko PR, Asham AM,etal.P53 cannot be induced by hypoxia alone but responds to the hypoxic microenvironment[J].Oncogene,2004,23:4975-4983.
[12] An WG, Kanekal M, Simon MC,etal.Stabilization of wild-type p53 by hypoxia-inducible factor 1alpha[J].Nature,1998,392:405-408.
[13] Chen D, Li M, Luo J,etal.Direct interactions between HIF-1 alpha and Mdm2 modulate p53 function[J].J Biol Chem,2003,278:13595-13598.
Effect of HIFU on hypoxia-inducible factor (HIF-1α)expression and cell apoptosis in liver cancer cell xenografts of nude mice
FU Zhi-hao1, WU Lun1, QIAO Zheng-rong3, ZHOU Shi-ji2, LI Sheng-wei1*
(1.Dept. of Hepatobiliary Surgery; 2.Dept. of General Surgery, the Second Affiliated Hospital of Chongqing Medical UniversityChongqing 400010; 3.Dept. of General Surgery,People’s Five Hospital of Chongqing,Chongqing 400062,China)
ObjectiveTo study the effects of hypoxia-inducible factor (HIF-1α) on apoptosis of the residual tumor cells in nude mice after treatment by high-intensity focused ultrasound (HIFU).MethodsHuman HCC implantation was established in 30 nude mice. CZF-Ⅱ HIFU therapeutic apparatus was used for treatment.Nude mice were randomly divided into control group and treatment group (included 1 d group, 3 d group, 5 d group, 1 week group,and 2 weeks group). Pathological changes were observed with HE staining;Cell apoptosis was detected by DNA agarose gel electrophoresis and terminal deoxynucleotidyltransferase-mediated Dutp nick end-labeling (TUNEL) assay; SP immunohistochemistry was used to detect HIF-1α protein;Western blot and real-time quantitative PCR were used to detect HIF-1α, P53 protein and mRNA expression levels.ResultsHE showed that there were residual tumor cells and large necrotic areas after treatment. Compared with other groups, the apoptosis index
in 3 d group was significantly higher (Plt;0.05), while in the 5 d group,1 week group,2 weeks group gradually decreased. Immunohistochemistry showed that the expression of HIF-1α, P53 protein was different in each group. Compared with other groups,Western blot and RT-PCR showed an increase of HIF-1α, P53 protein and mRNA levels in groups after treatment of 1 to 3 days, and peaked in 3 d group(Plt;0.05).ConclusionsHIFU treatment can induce consistent apoptosis in residual tumor, which may be related with disordered expression of HIF-1α and P53.
liver neoplasms; hypoxia-inducible factor; apoptosis; high-intensity focused ultrasound
2013-06-21
2014-03-22
國家自然科學(xué)基金 (81301975,81272570);重慶市衛(wèi)生局重點資助項目(渝衛(wèi)2012-1-040,渝衛(wèi)2010-1-68)
*通信作者(correspondingauthor):lswgg@126.com
1001-6325(2014)05-0648-06
R 735.7
A

