寡聚化α-突觸核蛋白在不同年齡段食蟹猴消化道中的表達
李 昕 楊巍巍 李旭冉 于 順*
(1.首都醫科大學宣武醫院神經生物學研究室教育部神經變性病重點實驗室,北京100053;2.北京市老年病醫療研究中心分子診斷實驗室,北京100053)
帕金森病(Parkinson's disease,PD)是臨床上常見的神經系統退行性疾病之一。早期表現為非運動癥狀(non-motor symptoms,NMS)可達數年,如嗅覺障礙、胃腸功能紊亂、便秘、睡眠紊亂等。晚期PD特征性病理改變為中腦黑質多巴胺能神經元選擇性、進行性丟失,殘存神經元中有路易體(Lewy body),其主要成分為聚集的 α-突觸核蛋白(α-synuclein,α-Syn)。文獻[1-3]報道,PD病程進展有可能是由于α-Syn由胃腸道神經叢擴散到相聯的神經系統,累及延髓之后,伴隨損傷神經元數量的增加而出現臨床癥狀。α-Syn參與神經元生長、重塑、變性,其磷酸化修飾及寡聚化形成可促進神經元變性[4]。α-Syn單體形成在正常發育的神經元核及突觸表達,目前認為其寡聚化修飾后有毒性[5]。本研究以靈長類動物食蟹猴為模型,應用Western blotting法及 ELISA方法證實 oligo-α-Syn和α-Syn在消化道不同部位中的表達,觀察oligo-α-Syn和α-Syn在不同部位的表達差異以及與年齡的關系。
1 材料和方法
1.1 材料
健康食蟹猴(4~16歲)9只,購自廣西雄森靈長動物養殖中心,實驗動物許可證號:SYXK(桂)2009-0006,所有動物均有詳細出生檔案和檢疫證書,動物研究方案經動物福利委員會(Institutional Animal Care and Use Committee,IACUC)認證批準。青年猴3只(4歲),中年猴3只(10~11歲),老年猴3只(15~16歲)。兔抗人磷酸化α-Syn多克隆抗體(Santa cruz公司,美國);鼠抗人α-Syn單克隆抗體3D5由本室制備;HRP標記山羊抗兔IgG、HRP標記山羊抗小鼠IgG(北京中杉公司),生物塑化的鼠單克隆抗體(康為世紀標記公司);4-硝基磷酸二鈉鹽(pNPP)(Sigma公司,美國);ELISA 96孔酶標板(Corning公司,美國);酶標儀(Tecan公司,瑞士);其他試劑為分析純。
1.2 方法
1)消化道中寡聚化α-Syn的ELISA檢測:用質量濃度為1×10-3g/L的3D5單抗包被96孔酶標板,100 μL/孔,37 ℃孵育2 h,4 ℃過夜,PBST 洗板。10%BSA封閉,200 μL/孔,37 ℃孵育2 h,PBST 洗板。加入倍比稀釋的重組人 α-Syn(0.5 mol/L、0.25 mol/L、0.125 mol/L、0.006 25 mol/L、0.031 25 mol/L、0 mol/L)和待測樣品,100 μL/孔,37 ℃孵育 2 h,PBST 洗板,然后加入生物素化的3D5(1(10-3g/L)100 μL/孔,37℃孵育2 h,PBST洗板,再加入親和素標記的堿性磷酸酶(1∶5 000),100 μL/孔,37 ℃孵育 1 h,PBST 洗板,最后加入 pNPP,100 μL/孔,37 ℃顯色 30 min,405 nm 處測定吸光度值。每次每個樣品重復3孔,重復3次。
2)不同年齡段食蟹猴消化道蛋白樣品制備:抽提青、中、老年食蟹猴消化道不同部位的全細胞蛋白組分,BCA法蛋白定量,-20℃保存備用。
3)α-Syn寡聚體的免疫印跡分析:分別取20 μg各組蛋白樣品用10%SDS-PAGE分離后,半干法轉移至PVDF膜。將PVDF膜與3D5單抗(1∶5 000)室溫孵育2 h,然后與辣根過氧化物酶標記山羊抗小鼠IgG多克隆抗體(1∶5 000)室溫孵育1 h。ECL法檢測辣根過氧化物酶活性。
1.3 統計學方法
應用SPSS 18.0統計學軟件進行統計分析。計量資料以均數±標準差(±s)表示,組間比較使用單因素方差分析法和均數兩兩比較LSD方法。以P<0.05為差異有統計學意義。
2 結果
2.1 檢測寡聚體α-Syn的ELISA標準曲線的建立
本研究建立的檢測寡聚化α-Syn的ELISA方法,可以較特異地識別樣本中的α-Syn寡聚體,而在含有單體α-Syn溶液中,僅能檢測到極低的信號,詳見圖1。根據α-Syn的起始濃度,計算出本方法的最低檢測限為~48 ng/孔。
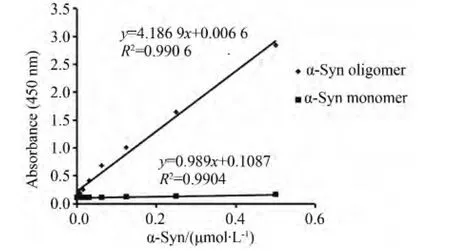
圖1 ELISA特異識別人α-Syn寡聚體Fig.1 ELISA method to recognize only the oligomeric species of human α-Syn
2.2 寡聚化α-Syn在不同年齡段猴消化道中的表達差異
ELISA結果顯示,在老年食蟹猴的食管、胃底、十二指腸、空腸、回腸和結腸中,寡聚化α-Syn質量濃度較青年與中年猴顯著增加,且差異有統計學意義(P<0.01)。其中,在胃底、空腸和回腸中,寡聚化α-Syn隨老化增加,呈年齡依賴性,詳見圖2。
2.3 α-Syn寡聚體在不同年齡段猴消化道中的Western blotting分析
抽提青年、中年、老年3組猴食管、胃底、回腸和結腸全細胞蛋白進行免疫印跡分析。在老年食蟹猴的食管、胃底、回腸和結腸中,寡聚化α-Syn質量濃度較青年與中年猴顯著增加。其中,在胃底和回腸中,寡聚化α-Syn隨老化增加,呈年齡依賴性,詳見圖3。
3 討論
利用本室制備的α-Syn單克隆抗體(3D5)同時作為捕獲抗體與檢測抗體,筆者建立了可以檢測寡聚化α-Syn的ELISA方法。本研究利用α-Syn寡聚體與單體標準品檢測此法的敏感度及特異度,發現其只能檢測寡聚化α-Syn,并且吸光度值與寡聚化α-Syn濃度呈線性關系,而對于單體形式的α-Syn不識別,提示此法有較高的特異度。本實驗利用上述ELISA方法檢測青(4歲)、中(10~11歲)、老(15~16歲)3個年齡組食蟹猴。以食蟹猴的年齡梯度作為自然老化的模型,研究α-Syn寡聚化在消化道不同部位肌間神經叢表達量與年齡的關系。

圖2 寡聚化α-Syn在食蟹猴消化道中的表達Fig.2 Expression of oligo-α-Syn in digestive tract of cynomolgus monkeys

圖3 寡聚化α-Syn在食蟹猴消化道中的Western blotting分析Fig.3 Western blotting for oligo-α-Syn in digestive tract of cynomolgus monkeys
筆者發現在老年食蟹猴的食管、胃底、十二指腸、空腸、回腸和結腸中,寡聚化α-Syn質量濃度較青年與中年猴顯著增加,且差異有統計學意義(P<0.01)。其中,在胃底、空腸和回腸中,寡聚化α-Syn隨老化增加,呈年齡依賴性。同在食蟹猴結腸中發現的結果類似,但是老齡化食蟹猴更易于α-Syn聚集的原因尚不明確。α-Syn的翻譯后修飾可能是原因之一:特殊的激酶如PLK使α-Syn磷酸化、硝基化反應,最終使α-Syn沉積形成路易包涵小體[6-8]。α-Syn經過磷酸化、硝基化的翻譯后修飾,形成有毒性的不可溶聚合體,最終導致神經系統的功能障礙和神經元的崩解死亡[6,9-10]。此外,老齡化所致內環境改變也可能是促使α-Syn聚集的重要原因。已有研究[6]表明消化道及血漿[1]中α-Syn隨年齡增加而增加,提示自然老化帶來的α-Syn含量增高,提高了激酶的表達和氧化應激的環境,促進了磷酸化、硝基化的修飾反應,最終在老年猴結腸組織的肌間神經叢中高表達了寡聚化α-Syn。有研究[11-13]指出α-Syn和n-Syn的高表達與自然老齡化導致的α-Syn寡聚體蓄積增加有密切的關系。
本實驗證實了自然老化對α-Syn的寡聚體有正向關系,可增加具有毒性的 oligo-α-Syn聚合物的表達,但具體的機制需要進一步的研究。本實驗對α-Syn在PD病理進程中可能從外周神經系統開始的學說[14-15]進行了一定程度的驗證,需繼續結合PD敏感腦區做深入的機制研究。在日趨老齡化的現代社會,本實驗的研究結果對PD典型臨床癥狀未出現的早期診斷提供了一定的指導意義,可以應用結腸鏡檢查技術和規范統一的免疫組化技術,對老齡高發人群行臨床前普查,提高早期診斷率。
[1] Abbott R D,Petrovitch H,White L R,et al.Frequency of bowel movements and the future risk of Parkinson's disease[J].Neurology,2001,57(3):456-462.
[2] Claassen D O,Josephs K A,Ahlskog J E,et al.REM sleep behavior disorder preceding other aspects of synucleinopathies by up to half a century[J].Neurology,2010,75(6):494-499.
[3] Liu Y,Qiang M,Wei Y,et al.A novel molecular mechanism for nitrated α-synuclein-induced cell death[J].J Mol Cell Biol,2011,3(4):239-249.
[4] Fujiwara H,Hasegawa M,Dohmae N,et al.α-Synuclein is phosphorylated in synucleinopathy lesions[J].Nat Cell Biol,2002,4(2):160-164.
[5] Mbefo M K,Paleologou K E,Boucharaba A,et al.Phosphorylation of α-synucleins by members of the Polo-like kinase family[J].J Biol Chem,2010,285(4):2807-2822.
[6] Giasson B I,Duda J E,Murray I V,et al.Oxidative damage linked to neurodegeneration by selective α-synuclein nitration in synucleinopathy lesions[J].Science,2000,290(5493):985-989.
[7] Hodara R,Norris E H,Giasson B I,et al.Functional consequences of α-synuclein tyrosine nitration:diminished binding to lipid vesicles and increased fibril formation [J].J Biol Chem,2004,279(46):47746-47753.
[8] Paleologou K E,Schmid A W,Rospigliosi C C,et al.Phosphorylation at Ser-129 but not the phosphomimics S129E/D inhibits the fibrillation of α-synuclein [J].J Biol Chem,2008,283(24):16895-16905.
[9] Kirkitadze M D,Bitan G,Teplow D B.Paradigm shifts in Alzheimer's disease and other neurodegenerative disorders:the emerging role of oligomeric assemblies[J].J Neurosci Res,2002,69(5):567-577.
[10]Yu S,Li X,Liu G,et al.Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody[J].Neuroscience,2007,145(2):539-555.
[11] Li W,Lesuisse C,Xu Y,et al.Stabilization of α-synuclein protein with aging and familial Parkinson's disease-linked A53T mutation[J].J Neurosci,2004,24(33):7400-7409.
[12] Chu Y,Kordower J H.Age-associated increases of α-synuclein in monkeys and humans are associated with nigrostriatal dopamine depletion:is this the target for Parkinson's disease[J].Neurobiol Dis,2007,25(1):134-149.
[13] Xuan Q,Xu S L,Lu D H,et al.Increase expression of αsynuclein in aged human brain associated with neuromelanin accumulation[J].J Neural Transm,2011,118(11):1575-1583.
[14]李昕,楊巍巍,李雁,等.一種檢測帕金森患者血漿促進α-突觸核蛋白寡聚體形成能力的方法[J].首都醫科大學學報,2013,34(6):830-831.
[15]尹娜,陳予東,李昕,等.帕金森病患者血漿增強α-突觸核蛋白寡聚體形成[J].首都醫科大學學報,2013,34(6):840-843.

