胃癌組織GSTP1第5外顯子基因型檢測及其與臨床病理特征的關系
王旭光,張 忠,王 瑩,張 珉,韓 瑩,潘曉蔚
(沈陽醫學院,沈陽110034)
研究發現,遺傳易感基因的存在增加胃癌的發病風險,特別是負責體內解毒和修復DNA的基因。谷胱甘肽轉移酶類(GSTs)是機體內重要的Ⅱ相解毒酶,π類GSTs(GSTP1)是其中之一。有研究顯示,GSTP1不同基因型與乳腺癌、口腔癌、結腸癌、前列腺癌和肺癌等多種腫瘤有關[1~3]。前期研究顯示,GSTP1第5外顯子不同基因型與胃癌發生前腸化生階段有關,在腸化生階段與幽門螺桿菌的感染存在著正交互作用[4,5]。但上述結果基于血清學研究,在組織學中該位點的不同基因型是否與胃癌有關,尚需要進一步研究。本研究檢測胃癌組織中GSTP1第5外顯子基因型,探討其與胃癌臨床病理特征的關系。
1 資料與方法
1.1 臨床資料 2008年3月~2012年12月中國醫科大學附屬第一醫院、沈陽奉天醫院和沈陽第四人民醫院收治經病理確診的胃癌患者216例(胃癌組),男163例,女53例;年齡28~87歲,平均61.1歲。另選良性胃疾病患者300例作為對照組,包括中度慢性胃炎100例、重度慢性胃炎106例、萎縮性胃炎94例,其中男227例,女63例;年齡30~85歲,平均60.8歲。兩組年齡、性別均具有可比性(P均 >0.05)。
1.2 方法
1.2.1 標本采集 對照組分別于患者的胃竇、胃角和胃體部胃鏡取活檢組織,胃癌組為術后標本(取材部位同對照組),經95%乙醛或10%中性甲醛固定,石蠟包埋制作切片。每例標本連續切10~12片,每片厚 5 μm。
1.2.2 GSTP1第5外顯子基因型檢測 采用PCRRFLP法。采用FFPE石蠟標本DNA提取試劑盒提取DNA,進行PCR擴增;上游引物5'-GTAGTTTGCCCAAGGTCAAG-3',下游引物5'-AGCCACCTGAGGGGTAAG-3';擴增條件:95 ℃ 12 min,95 ℃ 30 s,58℃ 30 s,72℃ 60 s,15個循環;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,25 個循環;72 ℃ 5 min;16 ℃ 保存[4]。取 PCR 產物 2 μL,加限制性內切酶 Alw26I 2 μL、NET緩沖液4 μL及去離子水配成20 μL體系,在37℃恒溫箱中酶切3 h,2%瓊脂糖凝膠進行電泳,EB顯色10 min后觀察DNA條帶。依據文獻[6]分析胃癌的不同病理特征與GSTP1基因型的關系。
1.2.3 統計學方法 采用SPSS17.0統計軟件。各組基因型的比較采用χ2檢驗;GSTP1基因型與胃癌臨床病理特征的關系分析采用非條件Logistic回歸分析。P≤0.05為差異有統計學意義。
2 結果
2.1 GSTP1第5外顯子基因型檢測結果 經限制性內切酶Alw26I酶切電泳后,GSTP1呈現3個不同條帶,具有329 bp和107/104 bp的為野生純合型AA,具有329 bp、222 bp和107/104 bp 3個條帶的為雜合突變型AG,具有222 bp和107/104 bp兩條帶為純合突變型GG。見圖1。
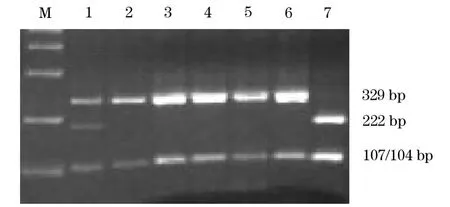
圖1 GSTP1第5外顯子不同基因型電泳圖
2.2 兩組GSTP1第5外顯子不同基因型比較 胃癌組AA基因型163例(75.5%),AG基因型43例(19.9%),GG 基因型10例(4.6%);對照組 AA 基因型248例(82.7%),AG基因型45例(15%),GG基因型7例(2.3%);胃癌組 AG+GG基因型比例為24.5%,高于對照組的17.3%(P <0.05)。
2.3 GSTP1第5外顯子基因型與胃癌臨床病理特征的關系 胃癌組AG+GG基因型比例在高分化組低于中、低分化組,在腸型胃癌組織中低于彌漫型胃癌組織,在>50歲人群中的比例高于≤50歲人群,P均<0.05;而性別、大體分型、腫瘤直徑、浸潤深度和淋巴結均與基因型無關(P均>0.05)。見表 1、2。
3 討論
據2012年統計,我國胃癌發病率為36.21/10萬[7]。胃癌的發生與外界環境因素和內在遺傳因素密切相關。近年來,人們在研究環境致胃癌的基礎上,更關注其內在的遺傳特性(即遺傳易感性)。研究發現,許多基因的變異與胃癌的關系密切,包括細胞增殖、凋亡及相關調控基因(Cyclin D1、Fas等)、修復基因(XRCC1等)、癌基因和抑癌基因(Ras、p53 等)、黏蛋白及黏附分子基因(MUC1、E-cadherin等)及細胞因子基因(IL-1β、IL-10、IL-8 等)的變異,特別是具有解毒功能的代謝酶基因(CYP2E1、GSTT1、COX-2 等)[8~12]。
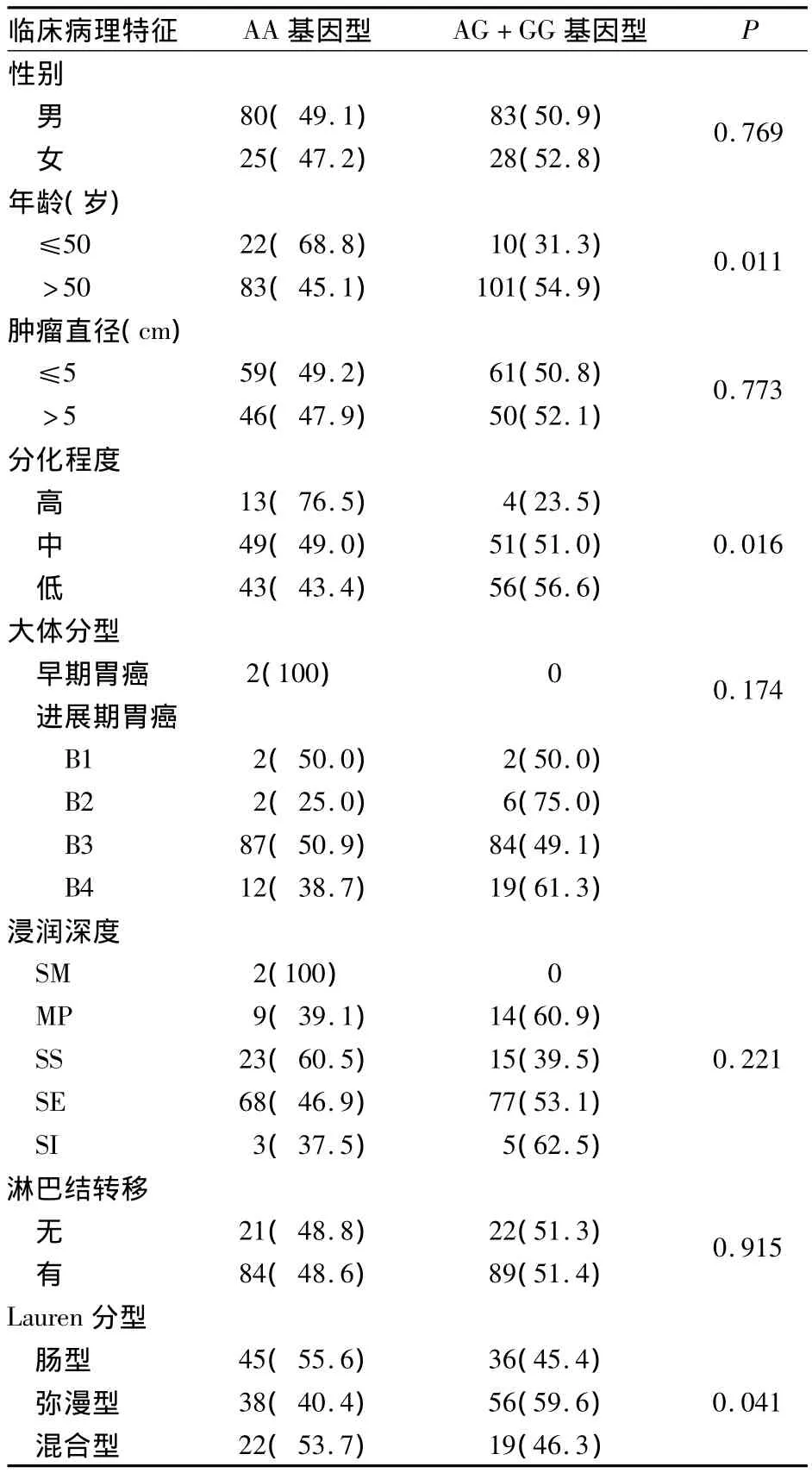
表1 GSTP1基因型與胃癌臨床病理特征的關系[例(%)]
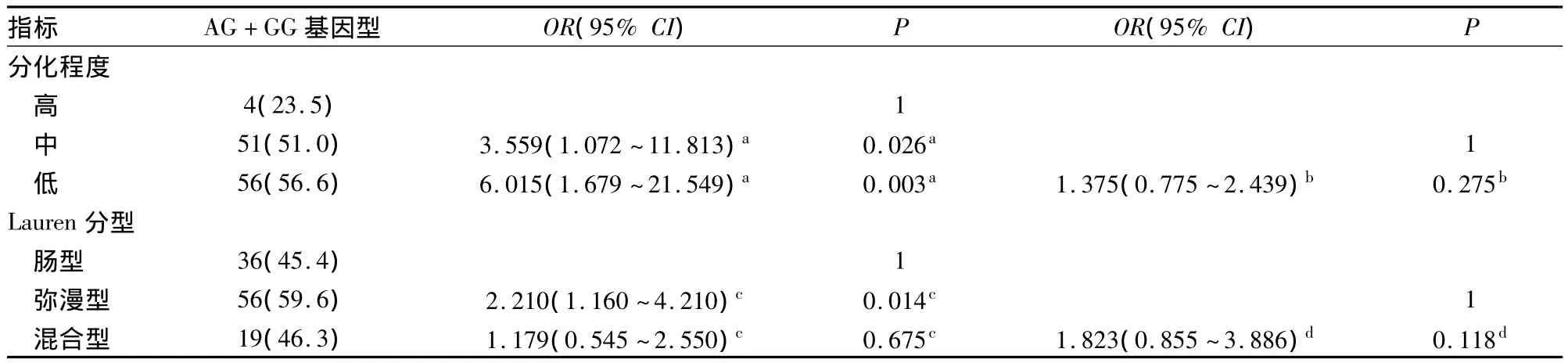
表2 GSTP1基因型與胃癌分化程度和Lauren分型關系的分層分析結果
GSTs在1961年由Booth首先發現,可分為兩類:一類是膜結合型家族,以微粒體為代表;另一類是細胞型家族,包含 6種,即 α(GSTA1~GSTA4)、μ(GSTM1~ GSTM5)、π (GSTP1)、θ(GSTT1 和GSTT2)、ζ(GSTZ1)和 ω[13]。編碼這些基因的多態性決定著這些酶的功能,特別是GSTP1基因第5外顯子1 587對堿基處A→G,導致異亮氨酸(Ile)-105→纈氨酸(Val),從而使其氨基酸的體積和疏水性發生改變,影響其熱穩定性,降低解毒功能。
GSTP1基因是代謝酶基因中的一種,就該基因變異與胃癌關系的研究結果顯示,胃癌組AG+GG基因型的比例高于對照組,提示G等位基因的突變是胃癌發生的原因之一。其機制可能為GSTP1基因發生突變后,熱穩定性發生改變,進而影響其功能,導致人體解毒功能不足,大量毒物進入體內,最終可能進一步導致其他基因變化,進而發生胃癌。有研究顯示,生理狀態下GSTP1所編碼的蛋白質(GSTP-pi)是以二聚體形式存在,并和C-JUN、JNK相結合形成復合物,當有毒物入侵時,GSTP-pi從復合物中解離,發揮解毒功能,同時釋放 C-JUN和JNK[14]。C-JUN和JNK是與腫瘤發生密切相關的基因,是否二者的激活進一步導致胃癌的發生,尚需深入研究。
本研究結果顯示,GSTP1第5外顯子基因型變異與胃癌患者性別及胃癌直徑、大體分型、浸潤深度、淋巴結轉移等因素無關。而>50歲胃癌患者AG+GG基因型比例高于≤50歲者,提示>50歲的GSTP1第5外顯子基因型變異者可能更易發生胃癌。胃癌的發生是致癌因素長期累積的結果,GSTP1基因變異,使這些致癌物更易累積,特別是>50歲的人群,機體無法對抗其制毒作用,導致胃腺體更易發生癌變。高分化組AG+GG基因型比例低于中、低分化組,提示GSTP1突變的個體更易發生分化較低的胃癌。前期免疫組織化學結果顯示,在高分化胃癌組織中GSTP-pi表達高于中、低分化胃癌,特別是在低分化胃癌中GSTP-pi幾乎不表達,推測GSTP1突變可能導致其蛋白表達和解毒能力降低,使胃癌去分化現象更加顯著,惡性度更高。Lauren分型結果顯示,腸型胃癌患者AG+GG基因型的比例低于彌漫型胃癌,提示GSTP1變異增加彌漫型胃癌的發病風險。
總之,GSTP1第5外顯子AG和GG基因型與胃癌患者年齡、胃癌的組織分化程度及Lauren分型有關,而與患者性別和胃癌大體分型、癌腫直徑、浸潤深度、淋巴結是否有轉移等無關。從GSTP1第5外顯子基因型突變為切入點,進一步分析其上游和下游的調控因子的變化,有望找出胃癌內在的發病因素和機制。
[1] Srivastava DS,Mandhani A,Mittal B,et al.Genetic polymorphism of glutathione S-transferase genes(GSTM1,GSTT1and GSTP1)and susceptibility to prostate cancer in Northern India[J].BJU Int,2005,95(1):170-173.
[2]Chen K,Jiang QT,He HQ.Relationship between metabolic enzyme polymorphism and colorectal cancer[J].World J Gastroenterol,2005,11(3):331-335.
[3]Li W,Chen J,Liu C.Glutathione S-transferase P1 Ile105Val polymorphism and oral cancer risk:a meta-analysis[J].Int J Med Sci,2013,10(4):392-398.
[4]王旭光,張忠,張曄,等.Pi類谷胱苷肽轉移酶基因多態性與胃粘膜場上皮化生癌變風險[J].中華醫學雜志,2009,89(9):582-586.
[5]王旭光,張忠,孫麗萍,等.谷胱苷肽轉移酶P1基因多態性和幽門螺桿菌感染的交互作用與胃黏膜上皮化生的風險[J].中華流行病學雜志,2010,31(8):80-84.
[6]國家“863”重大項目“胃癌分子分型與個體化診療”課題組.胃癌的病理分型和診斷標準的建議[J].中華病理學雜志,2010,39(4):266-269.
[7]赫捷,陳萬青.2012年中國腫瘤登記年報[M].北京:軍事醫學科學出版社,2012:52.
[8]Tahara T,Arisawa T,Shibata T,et al.Association between cyclin D1(CCND1)polymorphism and gastric cancer risk in Japanese population[J].Hepatogastroenterology,2009,56(93):1232-1235.
[9]Hussain SK,Mu LN,Cai L,et al.Genetic variation in immune regulation and DNA repair pathways and stomach cancer in China[J].Cancer Epidemiol Biomarkers Prev,2009,18(8):2304-2309.
[10]Liu Z,Liu L,Li M,et al.Epidermal growth factor receptor mutation in gastric cancer[J].Pathology,2011,43(3):234-238.
[11]Shirai O,Ohmiya N,Taguchi A,et al.p53,p21,and p73 gene polymorphisms in gastric carcinoma[J].Hepatogastroenterology,2010,57(104):1595-1601.
[12]Bammler TK,Smith CA,Wolf CR.Isolation and characterization of two mouse Pi-class glutathione S-transferase genes[J].Biochem J,1994,298(2):385-390.
[13]Kim JG,Sohn SK,Chae YS,et al.TP53 codon 72 polymorphism associated with prognosis in patients with advanced gastric cancer treated with paclitaxel and cisplatin[J].Cancer Chemother Pharmacol,2009,64(2):355-360.
[14]Thévenin AF,Zony CL,Bahnson BJ,et al.GST pi modulates JNK activity through a direct interaction with JNK substrate,ATF2[J].Protein Sci,2011,20(5):834-848.

