高脂飼養胰島素抵抗大鼠血清Apelin?36水平的變化
陳薇,趙曉娟,王楠楠,劉項楠
(1.中國醫科大學附屬第一醫院內分泌科,沈陽 110001;2.遼寧省人民醫院血液科,沈陽 110016)
長久以來,胰島素抵抗和胰島β細胞功能缺陷被認為是2型糖尿病發病的關鍵因素。近年研究認為,氧化應激、炎性反應與脂肪內分泌相互作用,從而引起胰島素抵抗和β細胞功能障礙。因此,對上述機制進行研究成為實驗研究及臨床治療的一個熱點。目前由于脂肪組織內分泌功能活躍,脂肪內分泌學科已經成為內分泌學的一個嶄新領域。很多的研究發現脂肪細胞通過活躍的分泌功能在調節能量代謝和胰島素抵抗方面發揮重要作用[1]。Apelin是近年新發現的脂肪因子,它是Tatemoto等利用反向藥理學的方法從牛胃的分泌物中提取并純化了的血管緊張素Ⅱ1型受體相關蛋白(angioten?sinⅡtype 1 receptor?associated protein,APJ)的內源性配體[2]。Apelin既受胰島素調控,又可抑制高血糖刺激下的胰島素分泌[3]。更多直接的證據表明它能增加胰島素敏感性及周圍組織對葡萄糖的攝取。但目前對于Apelin/APJ系統在脂代謝紊亂、胰島素抵抗(insulin risistence,IR)、糖尿病、高血壓、炎癥等病理生理過程中的作用機制尚不十分清楚。目前,對于Apelin的研究多圍繞于已發生2型糖尿病的患者或動物模型,本研究定位于最早期出現并伴隨著整個2型糖尿病發展過程的胰島素抵抗狀態,通過建立胰島素抵抗大鼠模型,測定其血清胰島素、Apelin?36、游離脂肪酸水平,探討在胰島素抵抗狀態時是否有Apelin的代償性分泌增加。
1 材料與方法
1.1 材料
1.1.1 實驗動物:SPF級雄性Wistar大鼠40只,體質量(230±20)g,由遼寧長生生物技術有限公司提供。飼養于中國醫科大學實驗動物中心屏障系統中,室溫(23±2)℃,濕度60%左右,明暗交替周期12 h,自由取食水。以基礎飼料(熱量比:蛋白質28.58%,脂肪9.59%,碳水化合物61.83%)適應性喂養1周。
1.1.2 主要試劑和儀器:胰島素放射免疫分析藥盒購于原子高科技股份有限公司。大鼠Apelin?36 ELISA試劑盒、大鼠游離脂肪酸ELISA試劑盒購自RD公司。胰島素放射免疫分析藥盒購自原子高科技股份有限公司。儀器包括微量輸液泵、全波長酶標儀、紫外分光光度儀。
1.2 方法
1.2.1 建立胰島素抵抗大鼠模型:大鼠適應性喂養1周后,按隨機數據表分為正常對照組(NC組,n=15)和胰島素抵抗組(HF組,n=15)。NC組給予基礎飼料喂養,HF組給予高脂飼料喂養誘導胰島素抵抗模型。高脂飼料由基礎飼料+豬油+奶粉配制,熱量比為蛋白質14%、脂肪59%、碳水化合物27%。配制好的高脂飼料經鈷源照射,密封保存。每周檢測體質量,共10周。
1.2.2 高胰島素正葡萄糖鉗夾實驗:喂養10周后,NC組、HF組各隨機抽取5只,采用高胰島素—正葡萄糖鉗夾實驗,了解大鼠葡萄糖輸注率的變化,評估胰島素抵抗模型,具體方法參照文獻[4]。實驗前禁食14 h后,10%水合氯醛(300 mg/kg)腹腔內麻醉。麻醉成功后固定,頸部和左腹股溝區備皮。剪開右側頸部皮膚及左側腹股溝皮膚,分離暴露右頸總動脈和左股靜脈,然后進行右頸總動脈和左股靜脈插管,插管成功后固定套管針,左頸總動脈接肝素生理鹽水注射器,右股靜脈接三通管后分別接裝有人胰島素注射液(40 mU/mL)和10%葡萄糖注射液的50 mL注射器,再接微量輸液泵,靜置30 min后,頸總動脈取血(1 mL)測基礎血糖和基礎胰島素。首先輸注胰島素,輸注率1.67 mU/(kg·min),每5 min頸總動脈取血(1滴)測血糖。當血糖<(基礎值±0.5)mmol/L時開始輸注葡萄糖。葡萄糖輸注率(glucose infusion rate,GIR)從4~6 mg/(kg·min)開始,每5 min測血糖1次,調整GIR,使血糖保持在(基礎值±0.5)mmol/L。連續3次血糖都在上述范圍內,鉗夾形成。實驗共計約2 h,計算60~120 min的平均GIR,以評價胰島素的敏感性。
1.2.3 標本采集與檢測:2組各剩余的10只大鼠禁食14 h,測定空腹尾尖血糖(fasting blood glucose,FBG);10%水合氯醛(300 mg/kg)腹腔內注射麻醉,內眥靜脈采血,分離血清,應用胰島素放免藥盒檢測血清胰島素水平,ELISA法測定血清Apelin?36、游離脂肪酸(free fatty acid,FFA)水平。鉗夾實驗結束后剖殺動物,完整剝離大鼠附睪脂肪,電子天平稱重,計算附睪脂肪質量占體質量的比例(g/g),即附睪脂肪質量指數。取出腎周組織,剔除血管和其他結締組織,將脂肪組織清洗后蘸干,用液氮迅速冷凍后,-70℃冰箱保存。
1.3 統計學分析
2 結果
2.1 高胰島素正葡萄糖鉗夾實驗節
喂養10周后行鉗夾實驗,HF組大鼠平均GIR顯著低于 NC 組[(1.17±0.36) mg· kg-1· min-1和(3.72±0.37)mg· kg-1· min-1,P<0.01],胰島素抵抗大鼠模型建立成功。
2.2 2組大鼠各項指標比較
大鼠喂養10周后,HF組較NC組體質量明顯升高[(582.28±30.77)g和(513.42±41.00)g,P<0.01]、附睪脂肪質量指數明顯升高[(1.11±0.96)%和(0.75±0.11)%,P<0.01]。2組大鼠基礎血糖比較無統計學差異(P>0.05)。HF組血清基礎胰島素、Apelin?36及游離脂肪酸較NC組均明顯升高(P<0.01),見表1。
2.3 2組大鼠檢測指標的相關性分析
血清Apelin?36與基礎胰島素、游離脂肪酸、附睪脂肪質量指數呈正相關(r1=0.452,P<0.05;r2=0.637,P<0.01;r3=0.756,P<0.01)。
3 討論
胰島素抵抗是2型糖尿病早期表現,并貫穿于糖尿病始終。胰島素抵抗是指胰島素作用的靶器官對胰島素作用的敏感性下降。攝食過多(尤其脂肪過多)、體力活動不足易導致肥胖及胰島素敏感性降低。本研究采用高脂飼料喂養大鼠10周后成功建立胰島素抵抗模型,HF組較NC組體質量明顯升高(P<0.01),高胰島素正葡萄糖鉗夾實驗結果顯示HF組大鼠平均葡萄糖輸注率顯著低于NC組(P<0.01),提示高脂攝入能夠成功制成胰島素抵抗和肥胖模型。附睪脂肪質量指數常用于評估內臟脂肪含量,本實驗結果表明高脂飲食明顯高于正常飲食組,提示長期高脂飲食導致的肥胖為內臟脂肪性肥胖。此外,研究[5]顯示高胰島素血癥和高游離脂肪酸是肥胖者胰島素抵抗的重要特征,本研究測得HF組大鼠血清基礎胰島素、游離脂肪酸水平均明顯高于NC組(P<0.01),與此特征相符。
表1 2組大鼠實驗室指標的比較(±s)Tab.1 Laboratory index contrast of rats between group NC and HF(±s)
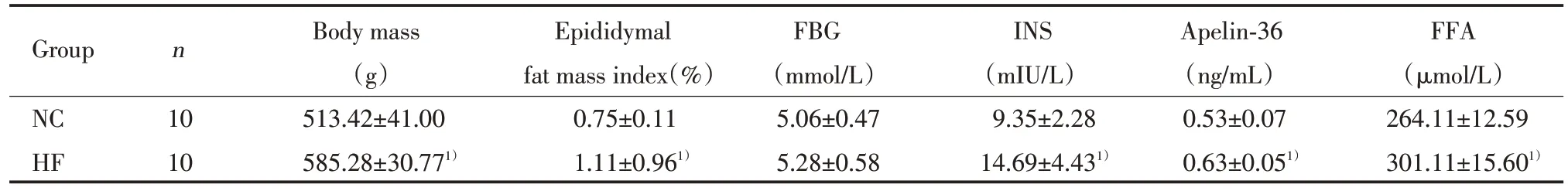
表1 2組大鼠實驗室指標的比較(±s)Tab.1 Laboratory index contrast of rats between group NC and HF(±s)
1)P<0.01 vs NC group.FBG,fasting blood glucose;INS,insulin;FFA,free fatty acid.
Group n Body mass Epididymal FBG INS Apelin?36 FFA(g) fat mass index(%) (mmol/L) (mIU/L) (ng/mL) (μmol/L)NC 10 513.42±41.00 0.75±0.11 5.06±0.47 9.35±2.28 0.53±0.07 264.11±12.59 HF 10 585.28±30.771) 1.11±0.961) 5.28±0.58 14.69±4.431) 0.63±0.051) 301.11±15.601)
利用建立的胰島素抵抗模型,本研究探討了一種新的脂肪因子——Apelin,借此探討其在胰島素抵抗中的變化。Apelin是Tatemoto等[2]發現的一種脂肪因子,Apelin由APLN基因編碼,人類的APLN基因位于染色體Xq25?26[5],它的基因產物是一種含有77個氨基酸的多肽原隨后裂解翻譯形成多種激活型包含長度為36、17、13和12的殘基[2]。不同長度的Apelin片段與受體的結合能力不同,因此發揮的生理作用也不盡相同。有研究認為,Apelin通過細胞膜上的兩種G蛋白(Gi?、Gq?)[6]、單磷酸腺苷活化蛋白激酶介導的信號通路[7]及磷脂酰肌醇3激酶/絲氨酸?蘇氨酸蛋白激酶[8]途徑來增加周圍組織的葡萄糖攝取并增加胰島素敏感性。目前對于糖尿病患者血漿Apelin水平的改變結論不一,有研究者[9,10]認為經治2型糖尿病患者血漿 Apelin水平升高;Erdem等[11]認為新診斷2型糖尿病患者血漿Apelin水平下降。本研究結果顯示HF組大鼠血清Apelin水平均明顯高于NC組(P<0.01)。相關性分析顯示血清Apelin與基礎胰島素、FFA、附睪脂肪質量指數均呈正相關。提示在胰島素抵抗狀態下已有Apelin的代償性分泌增加,表明Apelin可能與胰島素抵抗相關,通過復雜機制增加葡萄糖攝取及胰島素敏感性。
綜上所述,Apelin作為一種脂肪因子,可能通過復雜機制參與調節肥胖及胰島素抵抗等病理生理過程,肥胖的胰島素抵抗大鼠血清Apelin水平明顯升高。目前對于Apelin與胰島素抵抗、肥胖及2型糖尿病的關系尚存在爭議,需要進行更多的探討和研究。
[1]Trayhum P,Beattie JH.Physiological role of adipose tissues:white adipose tissues as an endocrine and secretory organ[J].Proc Nutr Soc,2001,60(3):329-339.
[2]Tatemoto K,Hosoya M,Habata Y,et al.Isolation and characteriza?tion of a novel endogenous peptide ligand for the human APJ recep?tor[J].Biochem Biophysi Res Commun,1998,251(2):471-476.
[3]Yue P,Jin H,Aillaud M,et al.Apelin is necessary for the mainte?nance of insulin sensitivity[J].Am J Physiol Endocrinol Metab,2010,298(1):E59-67.
[4]白淑亭,趙曉娟,王帆.Curcumin對胰島素抵抗大鼠抵抗素表達的影響[J].中華內分泌代謝雜志,2013,29:618-620.
[5]廖二元.內分泌代謝病學[M].3版.北京:人民衛生出版社,2012:1213-1281.
[6]Lee DK,Cheng R,Nguyen T,et al.Characterization of apelin,the li?gand for the APJ receptor[J].J Neurochem,2000,74(1):34-41.
[7]Yue P,Jin H,Xu S,et al.Apelin decreases lipolysis via G(q),G(i),and AMPK?dependent mechanisms[J].Endocrinology,2011,152(1):59-68.
[8]Attané C,Foussal C,Le Gonidec S,et al.Apelin treatment increases complete fatty acid oxidation,mitochondrial oxidative capacity,and biogenesis in muscle of insulin?resistant mice[J].Diabetes,2012,61(2):310-320.
[9]Zhu S,Sun F,Li W,et al.Apelin stimulates glucose uptake through the PI3K/Akt pathway and improves insulin resistance in 3T3?L1 ad?ipocytes[J].Mol Cell Biochem,2011,353(1?2):305-313.
[10]Li L,Yang G,Li Q,et al.Changes and relations of circulating visfa?tin,apelin,and resistin levels in normal,impaired glucose toler?ance,and type 2 diabetic subjects[J].Exp Clin Endocrinol Diabe?tes,2006,114(10):544-548.
[11]Erdem G,Dogru T,Tasci I,et al.Low plasma apelin levels in new?ly diagnosed type 2 diabetes mellitus[J].Exp Clin Endocrinol Dia?betes,2008,116(5):289-292.

