哈茨木霉LTR-2對椒樣薄荷耐鹽生理特性的影響
李哲,郭凱,吳曉青,陳泉,李紀順,楊合同,2*
(1.山東省科學院生物技術研究中心,山東省應用微生物重點實驗室,山東濟南250014;2.山東理工大學生命科學學院,山東淄博250049)
土壤鹽漬化是影響植物生長的主要逆境因素之一。NaCl是鹽漬化土壤中最主要的成分,對植物造成的傷害是多方面的。NaCl脅迫下,植物會出現營養失衡和滲透功能受損,活性氧過量產生導致膜完整性的破壞,進而引起光合電子傳遞系統失活、激素平衡破壞、生物量積累下降、蛋白質變性、核酸斷裂,甚至細胞死亡[1-2]。植物通過限制鹽分的過量吸收和調節抗氧化系統等途徑來減輕或抵御NaCl脅迫對細胞的傷害[3-4]。
木霉菌(Trichoderma spp.)作為生防菌株已得到廣泛認可,其對植物病原真菌的拮抗機制包含競爭作用、重寄生作用及抗生作用等。近年來越來越多的報道指出,木霉菌還能提高宿主植物耐受非生物脅迫的能力[5]。如哈茨木霉(Trichoderma harzianum)1295-22能夠提高氧化脅迫下甜玉米種子活力[6]。哈茨木霉DIS 219b定殖可可樹苗后,增加了幼苗生長、改變了基因表達,并在分子、生理和表型水平上增強了葉片對干旱脅迫的抗性[7]。對生長在金屬污染土壤的樹苗接種哈茨木霉T22,植物干重明顯增加[8]。Qi等[9]研究發現,棘孢木霉(Trichoderma asperellum)Q1對于200 mmol/L NaCl脅迫下的黃瓜幼苗具有明顯的促生作用。Hermosa[10]等將哈茨木霉的Thkel1基因轉到擬南芥中表達,增強了擬南芥對鹽脅迫和滲透脅迫的耐受力。哈茨木霉LTR-2由本實驗室從蔬菜植物根系土壤中篩選獲得,對多種植物病原真菌具有強烈的拮抗作用,取得了良好的社會經濟效益[11~14]。課題組最近的研究發現,LTR-2菌株具有較強的NaCl耐受性,且利用LTR-2孢子液處理椒樣薄荷植株能夠緩解NaCl脅迫對其根系發育的抑制作用,而且LTR-2的這種緩解NaCl脅迫的作用可能是通過促進一氧化氮的產生來實現的[15]。
椒樣薄荷(Mentha piperita L.,peppermint)為唇形科薄荷屬多年生草本植物,是天然香料,香氣純正,清爽宜人,廣泛用于日用化妝品、醫藥和糖果食品,具有巨大的經濟價值[16-17]。本實驗室在鹽漬化土壤經多年馴化篩選出了抗鹽椒樣薄荷品系——科院1號,適合在黃河三角洲地區鹽漬土壤上大規模推廣種植。課題組還首次開展了椒樣薄荷響應NaCl脅迫的生理特性的研究,發現其能夠耐受約150 mmol/L NaCl的脅迫,在該濃度下,椒樣薄荷植株能正常生長[18]。
目前國內外對椒樣薄荷等芳香植物的研究與開發主要聚焦于精油組分的分析和提取,而對其耐鹽特性研究較少。國內外對木霉菌增強植物耐鹽性及其作用機理方面也尚缺乏系統研究。本實驗以椒樣薄荷為試材,通過木霉菌接種實驗,對NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷耐鹽生理特性的影響進行了研究,探討了LTR-2接種苗耐受NaCl脅迫的生理生化基礎,旨在為椒樣薄荷在鹽堿地區的引種及木霉菌劑的開發應用提供理論和實驗依據。
1 材料與方法
1.1 實驗材料與儀器
實驗所用椒樣薄荷為本實驗室在鹽漬化土壤多年馴化篩選出的抗鹽品系 (科院1號)。在人工氣候室內于光暗周期為10/14 h,晝夜溫度為26/20℃,空氣相對濕度為50% ~70%的條件下,大量培養椒樣薄荷植株。選取生長期(10葉期)一致的植株,從植株頂端選擇大小相近的一對葉,連同莖(約4 cm)切割后移入Hoagland營養液中培養至生根 (根長至0.8 ±0.2 cm)。
哈茨木霉LTR-2為本實驗室篩選保存的品種。將LTR-2于PDA平板上涂布分生孢子,28℃培養5 d至木霉產生大量的綠色分生孢子。用滅菌生理鹽水洗滌,制成分生孢子懸浮液,其含量為109cfu/mL。
1.2 實驗處理
向鋪有兩層濾紙的燒杯中,分別加入1 mL濃度為105個/mL的木霉孢子懸液。將打孔后的泡沫板放置在燒杯中,移入生長良好、大小一致的椒樣薄荷植株,由泡沫板支撐,使其不定根與濾紙完全接觸,共培養24 h。隨后加入含200 mmol/L NaCl的Hoagland營養液,其后視為處理起始時間。每天分別補充2 mL營養液。
1.3 椒樣薄荷植株生長狀況的測定
分別取不同處理后的椒樣薄荷植株地上部,利用電子天平(FA1004N,上海精密科學儀器有限公司)稱量鮮重。然后選取椒樣薄荷的葉片 (從下向上數第3對葉),利用LI-COR LI-3100C葉片面積測量儀(LICOR,美國)來測定葉片面積。
1.4 Pn 值測量
分別取不同處理后的椒樣薄荷葉片,用便攜式LI6400(LI-COR,美國)光合速率測定儀來測量Pn值。LI6400裝有6400-15葉室 (直徑1.0 cm),使用人工光源,光照強度為250 μmol photons·m-2·s-1的飽和光。內置濃度為500 mg/m3CO2注入系統控制葉室。
1.5 葉綠素熒光參數的檢測
采用Imaging-PAM便攜式葉綠素熒光儀(Walz,德國),測定不同實驗組椒樣薄荷葉片的葉綠素熒光參數。測定前,將葉片放置到暗適應夾中適應25~30 min。測定時,將葉片放置到樣品室,打開檢測光,測定初始熒光;然后照射飽和脈沖光,每2.5 s一個脈沖,測定熒光參數Fv/Fm。
1.6 葉綠素含量的檢測
按張憲政的方法[19],取一定量葉片,置于刻度試管中,加10 mL丙酮∶乙醇提取液(V∶V=1∶1),黑暗處理過夜,利用酶標儀Infinite 200(Tecan,瑞典)分別測定A645和A663。按下列公式計算葉綠素含量:
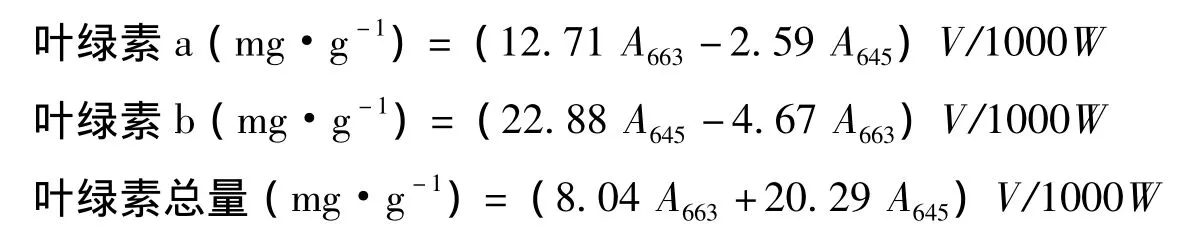
式中,V為提取液體積,單位為mL;W為材料重,單位為g。
1.7 H2O2組織染色
采用二氨基苯胺(3,3-diaminobenzidine,DAB)染色的方法,DAB能夠與H2O2反應生成棕紅色聚合物[20]。配制100 mL 1 mg/mL的DAB溶液,取經不同處理的椒樣薄荷葉片,用打空器鉆取數個葉圓片,放入小燒杯中,加入適量DAB溶液,真空滲入10 min,暗下放置8 h以上,期間要經常振蕩。拿出培養皿,照光約1 h,至紅棕色斑點出現,用蒸餾水沖洗葉圓片,加入適量脫色液(75%乙醇+5%甘油),在80℃水浴中進行脫色,至葉片不含葉綠素。脫色后的葉片用相機拍照。
1.8 H2O2含量的定量檢測
利用定量檢測試劑盒進行檢測(浙江碧云天生物科技公司)。本試劑盒利用H2O2氧化二價鐵離子產生三價鐵離子,然后和xylenol orange在特定的溶液中形成紫色的產物(A560),從而實現對H2O2濃度的測定。具體實驗操作依照試劑盒說明書進行。
1.9 MDA含量與抗氧化能力的檢測
MDA含量測定采用Zhang等[21]的方法,總抗氧化能力采用FRAP法檢測[22],過氧化氫酶(CAT)和超氧化歧化物酶(SOD)活力的檢測分別采用Chance[22]和張憲政[19]的方法。
1.10 質膜和液泡膜H+-ATPase活性的檢測
利用蔗糖密度梯度離心法分別制備椒樣薄荷質膜微囊和液泡膜微囊,并利用考馬斯亮藍法[23]測定其蛋白含量,隨后利用分光光度法測定質膜和液泡膜H+-ATPase的水解活性。質膜H+-ATPase的水解活性用該酶水解ATP釋放的 Pi量表示,即在反應液中缺少與存在0.1 mmol/L正釩酸鈉時所釋放的Pi量之差[23]。液泡膜H+-ATPase的水解活性用保溫介質中有或無50 mmol/L KNO3時所釋放的Pi量的差值表示[24]。
1.11 Na+/H+逆向轉運蛋白 (Na+/H+antiporter)活性的檢測
應用蔗糖密度梯度離心法制備椒樣薄荷液泡膜微囊,并利用考馬斯亮藍法[23]測定液泡膜微囊的蛋白含量。向反應體系中依次加入1 μmol/L吖啶橙和40 μg液泡膜微囊,抽吸混勻,然后向其中添加5 mmol/L Tris-L-乳酸鉀,利用吖啶橙作為熒光探針,通過熒光分光光度計監控跨膜pH值梯度的變化,根據熒光強度的恢復程度判斷并表示Na+/H+逆向轉運蛋白的活性。熒光監測參數為:激發光波長495 nm,發射光波長530 nm[25]。
1.12 數據處理
數據均用SPSS和Origin統計軟件進行分析和制圖,計算各處理性狀的平均數、標準差,并進行顯著性分析。
2 結果與分析
2.1 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷生長狀況的影響
植物生長狀態和生物量是植物對鹽脅迫反應的綜合體現,是植物耐鹽性的直接指標[2]。實驗結果顯示,在不加NaCl脅迫的情況下,經LTR-2處理的椒樣薄荷比未經LTR-2處理的椒樣薄荷的鮮重以及葉片面積略有增長(圖1)。在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷的鮮重以及葉片面積呈現出明顯的下降,處理12 d后,其鮮重以及葉片面積分別降至了同期對照的62.1% ±3.1%和60.3% ±2.6%(圖1B,C)。而經LTR-2處理的椒樣薄荷植株,200 mmol/L NaCl處理造成的鮮重以及葉片面積的下降得到了明顯的緩解,處理12 d后,其鮮重以及葉片面積仍有明顯的增長,分別為同期對照的88.5% ±4.3%和85.1% ± 5.1%,比同期的LTR-2未處理組高29.8% ± 3.3%和29.3% ± 2.9%(圖1B,C)。
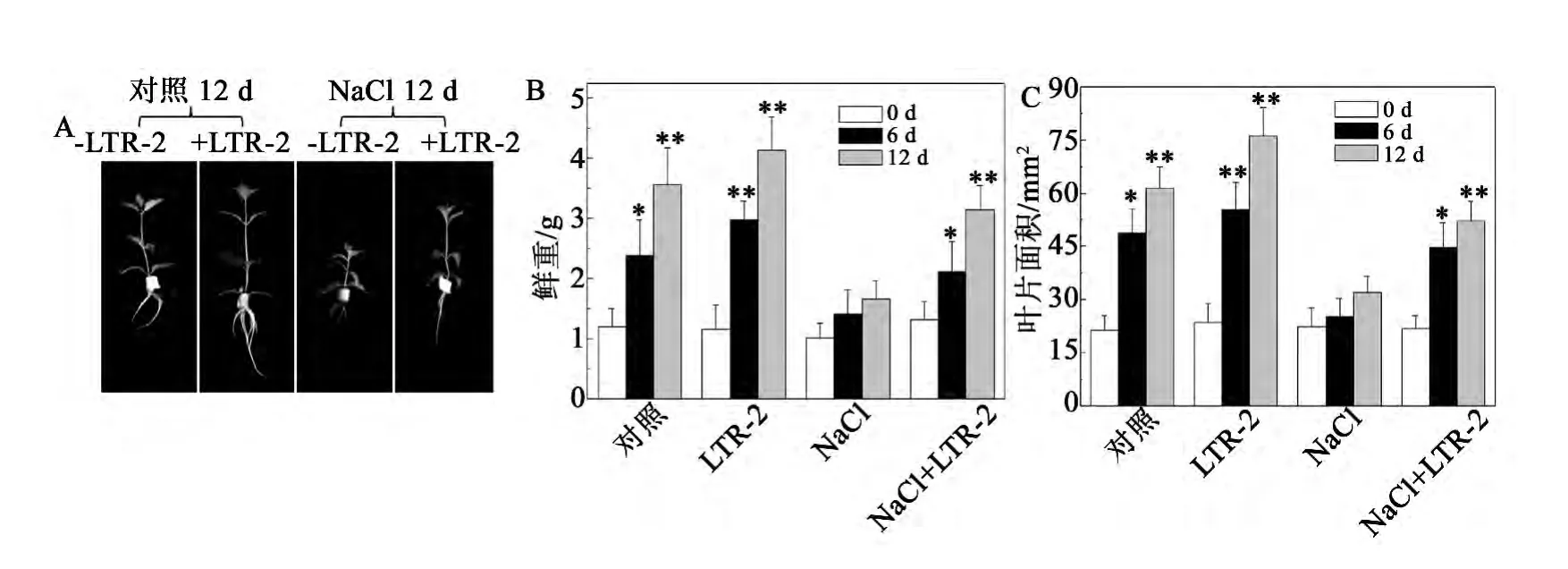
圖1 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷生長的影響Fig.1 Impact of LTR-2 on the growth of peppermint under NaCl stress
2.2 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷光合活性的影響
NaCl脅迫對植物生長和代謝的影響是多方面的,尤以對光合作用的影響最為突出[26]。如圖2所示,在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷葉片的葉綠素含量和凈光合速率呈現出明顯的下降,處理12 d后,其葉綠素含量和Pn值分別降至同期對照的56.5% ±4.1%和44.3% ±5.3%(圖2B,C)。而經LTR-2處理的椒樣薄荷植株的葉綠素含量和Pn值雖也有下降,但下降的程度明顯降低,200 mmol/L NaCl處理12 d后,分別為同期對照的70.2% ±7.1%和68.1% ±6.8%,比同期的 LTR-2未處理組高11.1% ± 1.2%和19.5% ± 1.9%(圖2B,C)。
PSII是光合系統中最敏感的組分,NaCl脅迫下,植物進行光合作用受到傷害的最初部位是與PSII緊密聯系的[26]。熒光參數Fv/Fm反映了PSII的最大量子產量,能夠反映PSII的光化學效率及活性。葉綠素熒光檢測實驗結果顯示,在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷葉片的Fv/Fm值出現明顯的下降,處理12 d后,降至了同期對照的81.9% ±6.6%(圖2D)。而經LTR-2處理的椒樣薄荷葉片的Fv/Fm值雖也有下降,但下降的程度明顯降低,200 mmol/L NaCl處理12 d后,為同期對照的92.4% ±2.1%,且比同期的LTR-2未處理組高11.5% ± 1.3%(圖2D)。
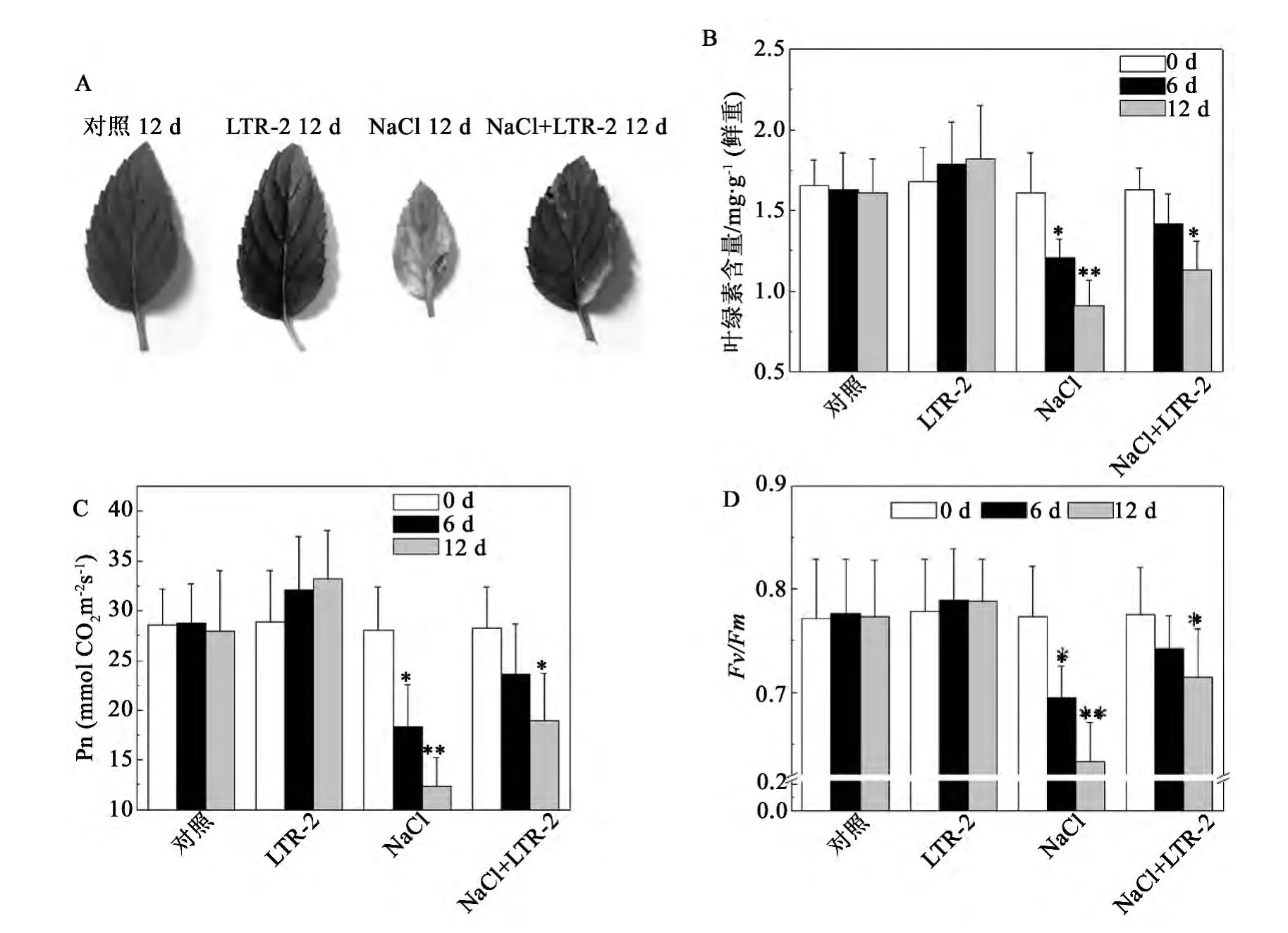
圖2 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷光合活性的影響Fig.2 Impact of LTR-2 on photosynthetic activity of peppermint under NaCl stress
2.3 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷抗氧化能力的影響
NaCl脅迫對植物的傷害很大程度是由于誘導產生活性氧 (reactive oxygen species,ROS),引起氧化脅迫,破壞生物膜,導致膜脂質過氧化造成的[3]。我們利用H2O2定量檢測試劑盒測定了NaCl脅迫誘導的椒樣薄荷細胞內H2O2含量的變化。實驗結果顯示,在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷細胞內H2O2的含量顯著升高,在處理12 d時,H2O2的含量為同期對照的5.3倍(圖3A,B)。而在經LTR-2處理的椒樣薄荷中,200 mmol/L NaCl處理造成的細胞內H2O2含量的增加得到了明顯的緩解,處理12 d后,H2O2含量為同期對照的3.1倍,比同期的LTR-2未處理組降低了42.4% ±5.5%(圖3A,B)。
MDA是膜脂過氧化的主要產物,其含量的變化在一定程度上反映了逆境脅迫對植物的傷害,其含量的多少代表了細胞膜脂過氧化的水平[20]。實驗結果顯示,在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷MDA的含量顯著升高,處理12 d后,MDA的含量為同期對照的1.9倍(圖3C)。而在經LTR-2處理的椒樣薄荷中,200 mmol/L NaCl處理造成的MDA含量的增加得到了明顯的緩解,處理12 d后,MDA含量為同期對照的1.5倍,比同期的LTR-2未處理組降低了48.7% ±6.7%(圖3C)。
植物減輕或抵御NaCl脅迫對細胞的傷害的途徑之一,是調節抗氧化系統來清除活性氧積累[3]。總抗氧化能力的檢測結果表明,在經LTR-2處理后,椒樣薄荷的總抗氧化能力顯著提高,在200 mmol/L NaCl處理6 d和12 d后,總抗氧化能力比同期對照分別增加了171.7%和167.1%,且比同期的LTR-2未處理組分別增加了15.7% ± 3.2% 和 46.3% ± 6.1%(圖 3D)。
隨后,我們也檢測了NaCl脅迫下LTR-2對椒樣薄荷中CAT和SOD活性變化的影響。實驗結果顯示,在200 mmol/L NaCl處理下,未經LTR-2處理的椒樣薄荷CAT和SOD活性呈現出先上升后下降的趨勢 (圖3E,F)。而在經LTR-2處理的椒樣薄荷中,CAT活性在200 mmol/L NaCl處理6 d和12 d后,分別為同期對照的2.4倍和2.1倍,且比同期的LTR-2未處理組分別增加了了35.3% ± 3.3% 和74.2% ± 5.1%(圖3E);SOD活性在200 mmol/L NaCl處理6 d和12 d后,分別為同期對照的1.7倍和1.6倍,且比同期的LTR-2未處理組分別增加了19.1% ± 2.7% 和50.6% ± 4.1%(圖3F)。
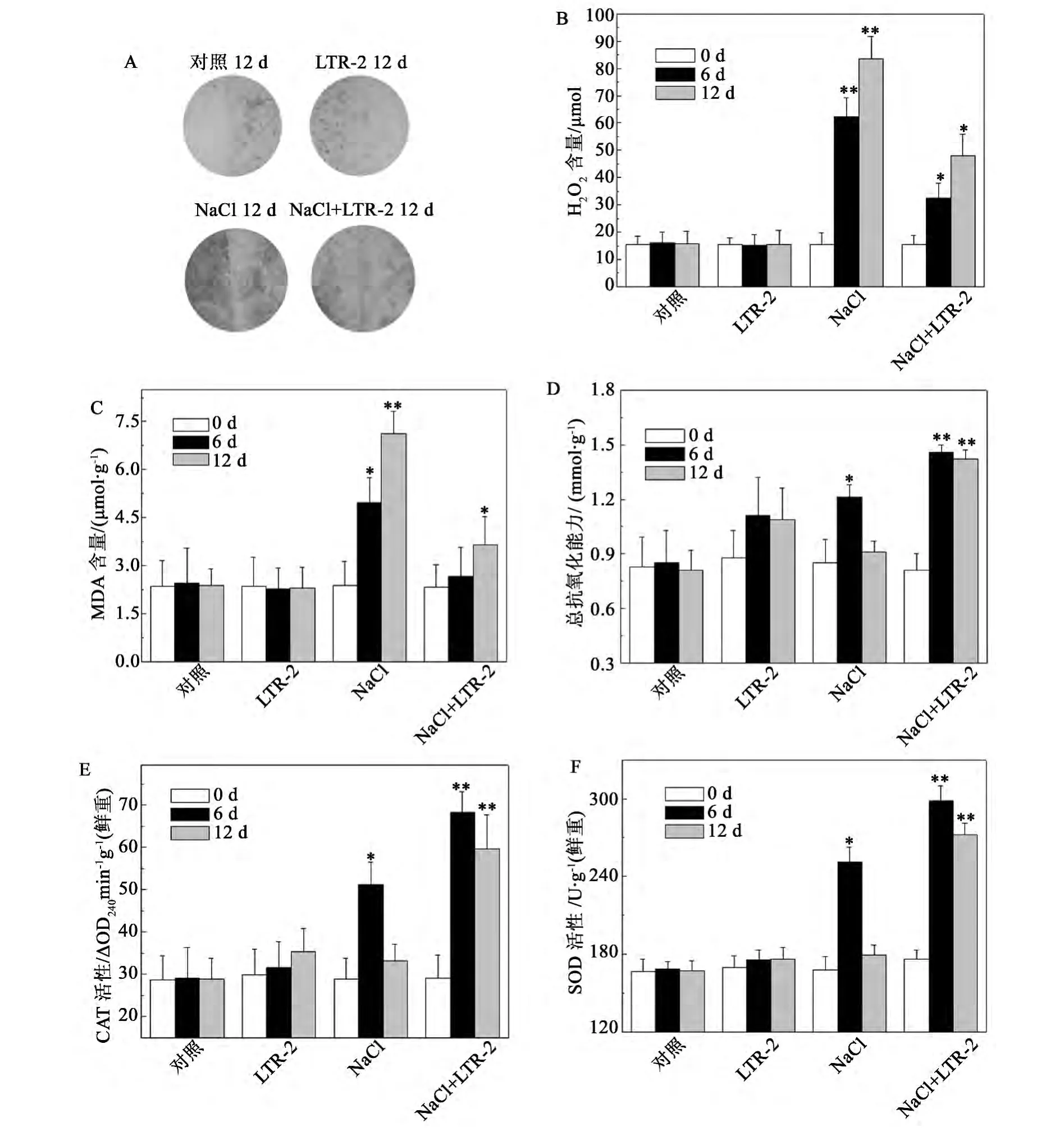
圖3 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷氧化損傷及抗氧化活性的影響Fig.3 Impact of LTR-2 on oxidative damage and antioxidant activity of peppermint under NaCl stress
2.4 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷離子轉運通道活性的影響
植物能夠通過調節鹽分的吸收和分布來抵御NaCl脅迫對細胞的傷害,細胞膜和液泡膜H+-ATPase以及Na+/H+逆向轉運蛋白等離子轉運通道在調節離子、溶質轉運,參與建立和維持細胞離子穩態中起著重要的作用,是植物耐鹽機制的重要組成部分[24-25]。活性檢測的實驗結果顯示,在未經LTR-2處理的椒樣薄荷中,200 mmol/L NaCl處理引起了細胞膜和液泡膜H+-ATPase以及Na+/H+逆向轉運蛋白活性的提高,處理6 d后,它們的活性分別為同期對照的2.5、3.7和5.8倍(圖4A,B,C)。而在經LTR-2處理的椒樣薄荷中,細胞膜和液泡膜H+-ATPase以及Na+/H+逆向轉運蛋白的活性更加顯著地提高,在200 mmol/L NaCl處理6 d,它們的活性分別為同期對照的3.8、5.7 和9.5 倍 (圖4A,B,C)。
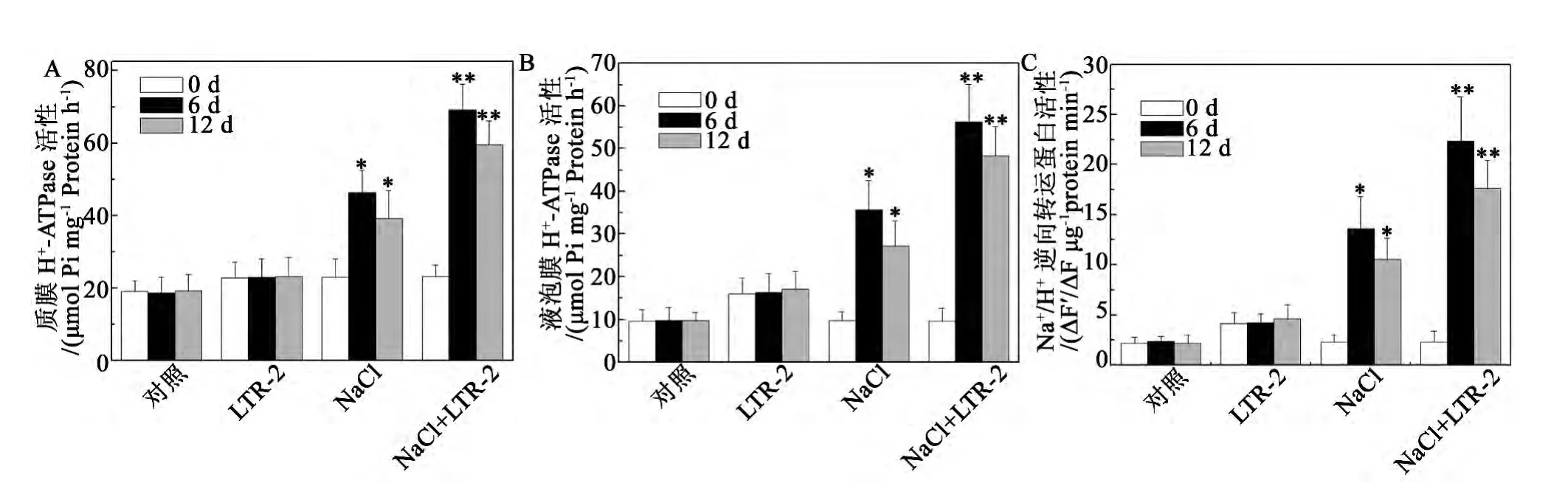
圖4 NaCl脅迫下哈茨木霉LTR-2對椒樣薄荷離子通道活性的影響。Fig.4 Impact of LTR-2 on ion channel activity of peppermint under NaCl stress
3 討論
最近一些研究表明,木霉菌能賦予宿主植物耐受非生物脅迫的能力,并在緩解強脅迫的環境壓力,如干旱、鹽堿、低溫以及重金屬污染等發面發揮了重要作用[6-10]。我們的研究結果表明,LTR-2有效緩解了NaCl脅迫誘導的椒樣薄荷生長抑制和光合損傷,增強了PSII的光化學效率及活性。
一般認為NaCl脅迫影響農林作物生長的主要原因是由高濃度Na+的滲透和離子脅迫綜合效應造成的[3-4],通過限制鹽分的過量吸收和調節抗氧化系統來清除活性氧積累等途徑能夠抵御NaCl脅迫對細胞的傷害[2-3]。
NaCl脅迫可以引起植物體內活性氧的過量產生,導致膜完整性的破壞,進而引起植物生長的抑制甚至死亡[1]。增強植物耐鹽性的重要途徑之一就是提高植物體內抗氧化系統的活性,增強抗氧化代謝水平[3]。之前的報道發現哈茨木霉1295-22能夠提高甜玉米種子抵抗氧化脅迫的能力[6],而哈茨木霉T22能夠通過減少植株衰老和脅迫過程中細胞內脂質過氧化物的含量來緩解氧化損傷[27]。Brotman等[28]的研究也指出木霉與植物根系定植后可以通過激活抗氧化系統來提高植物的耐鹽性。我們的研究結果表明,LTR-2通過提高椒樣薄荷體內抗氧化酶的活力來清除活性氧的積累,進而增強了椒樣薄荷的耐鹽性。
高鹽條件下由于鹽分吸收過多,會造成植物體內Na+過量積累,對細胞內的酶類和膜系統造成傷害,同時對其他離子的吸收產生拮抗作用,導致植物體內離子不平衡,從而引發生理生化代謝的紊亂[23]。細胞膜和液泡膜H+-ATPase以及Na+/H+逆向轉運蛋白在植物耐鹽中起著重要的作用,它們能夠促進Na+的外排和區室化[24-25]。有益微生物調節宿主微生物和植物體內的離子平衡的研究已有報道。Li等[29]發現鹽脅迫下Paxillus involutus strains MAJ和NAU能夠調節宿主微生物細胞中的K+/Na+平衡。Brotman等[28]的研究指出定植在植物根部的木霉菌株Trichoderma asperelloides T203能夠增強與離子平衡調節相關基因的表達。我們的研究結果表明LTR-2能夠提高椒樣薄荷細胞膜和液泡膜H+-ATPase以及Na+/H+逆向轉運蛋白等離子轉運通道的活性,進而調節鹽分的吸收和分布,減輕離子毒害。
總之,本文初步探討了LTR-2接種的椒樣薄荷耐受NaCl脅迫的生理生化基礎,為椒樣薄荷在鹽堿地區的引種及木霉菌劑的開發應用提供了理論和實驗依據。
[1]KATSUHARA M,KAWASAKI T.Salt stress induced nuclear and DNA degradation in meristematic cells of barley roots[J].Plant& Cell Physiology,1996,37(2):169-173.
[2]PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:A review [J].Ecotoxicology and Environmental safety,2005,60(3):324-349.
[3]GOSSETT D R,MILLHOLLON E P,LUCAS M C.Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton[J].Crop Science,1994,34:706-714.
[4]ZHENG Q S,LIU L,LIU Y L,et al.Effects of salt and water stresses on osmotic adjustment and osmotic accumulation in a loevera seedling[J].Journal of Plant Physiology and Molecular Biology,2003,29(6):585-588.
[5]MASTOURI F,BJ?RKMAN T,HARMAN G E.Seed treatment with Trichoderma harzianum alleviates biotic,abiotic,and physiological stresses in germinating seeds and seedlings[J].Biological Control,2010,100:1213-1221.
[6]BJ?RKMAN T,BLANCHARD L M,HARMAN G E.Growth enhancement of shrunken-2(sh2)sweet corn by Trichoderma harzianum 1295-22:effect of environmental stress[J].Journal of American Society for Horticultural Science,1998,123(1):35-40.
[7]BAE H,SICHER R C,KIM M S.The beneficial endophyte Trichoderma hamatum isolate DIS 219b promotes growth and delays the onset of the drought response in Theobroma cacao[J].Journal of Experimental Botany,2009,60(11):3279-3295.
[8]ADAMS P,DE-LEIJ F A A M.LYNCH J M.Trichoderma harzianum Rifai 1295-22 mediates growth promotion of Crack Willow(Salix fragilis)Saplings in both clean and metal-contaminated soil[J].Microbial Ecology,2007,54:306-313.
[9]QI W Z,ZHAO L.Study of the siderophore-producing Trichoderma asperellum Q1 on cucumber growth promotion under salt stress[J].Journal of Basic Microbiology,2013,53(4):355-364.
[10]HERMOSA R,BOTELLA L,KECK E,et al.The overexpression in Arabidopsis thaliana of a Trichoderma harzianum gene that modulates glucosidase activity,and enhances tolerance to salt and osmotic stresses[J].Journal of Plant Physiology,2011,168(11):1295-1302.
[11]楊合同,唐文華,李紀順,等.綠色木霉LTR-2菌株的紫外線誘變改良[J].中國生物防治,2004,20(3):182-186.
[12]楊合同,唐文華,RYOER M,et al.木霉對棉花枯萎病菌和黃萎病菌的作用機理[J].山東科學,2005,18(3):9-15.
[13]陳凱,楊合同,李紀順,等.綠色木霉菌LTR-2孢子提取物的抑菌活性及化學成分分析[J].微生物學通報,2007,34(3):455-458.
[14]楊合同,唐文華,宋家華.綠色木霉菌LTR-2對小麥紋枯病菌的作用機制[M]//植物病害研究與防治.北京:中國農業科技出版社,1998:504-507.
[15]曲樂.外源NO、哈茨木霉LTR-2對NaCl脅迫下椒樣薄荷根系生長及氧化損傷的影響[D].淄博:山東理工大學,2012.
[16]陳小軍.椒樣薄荷高產栽培技術[J].農村科技,2008(7):72-73.
[17]姜殿勤,姜濱,張儉衛.野薄荷實用價值及人工栽培[J].特種經濟動植物,2008(1):36-37.
[18]張俠,宋莉璐,任艷,等.椒樣薄荷對NaCl脅迫的生理響應[J].安徽農業科學,2009,37(13):5967-5969.
[19]張憲政.植物生理學實驗技術[M].沈陽:遼寧科學技術出版社,1989.
[20]張麗麗,馬殿榮,林志強,等.耐鹽雜草稻幼苗對NaCl脅迫響應及其生理基礎[J].華北農學報,2010,25(4):123-129.
[21]ZHANG X,ZHOU S X,FU Y C,et al.Identification of a drought tolerant introgression line derived from Dongxiang common wild rice(O.rufipogon Griff.)[J].Plant Molecular Biology,2006,62(1/2):247-259.
[22]CHANCE B,MAEHLY A C.Assays of catalase and peroxidase[M]//Methods of Enzymology New York:Academic Press,1995:55,764-775.
[23]SUN J,CHEN S L,DAI S X,et al.NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and saltsensitive Poplar Species[J].Plant Physiology,2009,149:1141 –1153.
[24]QIU N W,CHEN M,GUO J R,et al.Coordinate up-regulation of V-H+-ATPase and vacuolar Na+/H+antiporter as a response to NaCl treatment in a C3 halophyte Suaeda salsa[J].Plant Science,2007,172:1218-1225.
[25]OLIAS R,ELJAKAOUI Z,LI J,et al.The plasma membrane Na+/H+antiporter SOS1 is essential for salt tolerance in tomato and affects the partitioning of Na+between plant organs[J].Plant Cell and Environment,2009,32(1):904-916.
[26]LIU J,SHI D C.Photosynthesis,chlorophyll fluorescence,inorganic ion and organic acid accumulations of sunflower in responses to salt and salt-alkaline mixed stress[J].Photosynthetica,2010,48(1):127-134.
[27]MASTOURI F,BJORKMAN T,HARMAN G E.Seed treatment with Trichoderma harzuanum alleviates biotic,abiotic,and physiological stresses in germinating seeds and seedlings[J].Biological Control,2010,100(11):1231-1221.
[28]BROTMAN Y,LANDAU U,CUADROS-INOSTROZA A,et al.Trichoderma-plant root colonization:escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance[J].PLos Pathogens,2013,9(3):e1003221.doi:10.1371/journal.ppat.1003221.
[29]LI J,BAO S Q,ZHANG Y H,et al.Paxillus involutus strains MAJ and NAU mediate K+/Na+homeostasis in Ectomycorrhizal Populus × canescens under sodium chloride stress[J].Plant Physiology,2012,159(4):1771-1786.

