透明質酸對BALB/c小鼠激光損傷后皮膚屏障功能修復的研究
徐良恒 顧華 郭美華 劉海洋 劉付華 涂穎 龐勤 何黎
透明質酸對BALB/c小鼠激光損傷后皮膚屏障功能修復的研究
徐良恒 顧華 郭美華 劉海洋 劉付華 涂穎 龐勤 何黎
目的探討透明質酸敷料促進BALB/c小鼠皮膚激光損傷后皮膚屏障修復的作用。方法36只清潔級雌性BALB/c小鼠均分為3組,每只小鼠用脫毛膏兩側背部脫毛后,用Q開關1064激光機,頻率5 Hz,光斑3 mm,能量6 J的激光照射脫毛區后,每組分別外用基質、基質+膠原蛋白、基質+透明質酸于小鼠一側背部,另一側不做處理(陰性對照)。分別于6 h,24 h,7 d,21 d測試每只小鼠背部皮膚生理功能,并取每組3只小鼠皮損處皮膚做增殖細胞核抗原染色。結果與基質組和陰性對照比較,于第7天,基質+膠原蛋白組,基質+透明質酸組經表皮失水量值差異有統計學意義(P<0.05),角質層含水量差異有統計學意義(P<0.05),增殖細胞核抗原表達較強(P<0.05)。24 h、1 d、21 d組間經表皮失水量、角質層含水量及增殖細胞核抗原表達強度差異無統計學意義(P>0.05),第21天各組與造模前比較,差異無統計學意義(P>0.05)。各組小鼠皮膚屏障功能恢復正常。結論透明質酸敷料能促進BALB/c小鼠激光術后皮膚屏障功能修復,與膠原蛋白敷料作用相當。
激光;透明質酸;敷料,水膠體;皮膚,屏障;動物實驗
隨著醫學激光技術的發展,激光被大量運用于醫學領域,過去許多難治性的損容性皮膚病得到了很好的治療,但在治療過程中,激光的熱效應及其他相關生物學效應會導致皮膚皮脂膜、皮膚“磚墻結構”等損害,不同程度地破壞皮膚的正常結構,導致皮膚屏障功能破壞[1]。激光術后常用冰敷術區降低皮膚水腫及不適,莫匹羅星軟膏等外搽預防感染,但缺少一種能促進激光術后皮膚屏障恢復的產品。因此,本實驗旨在觀察透明質酸敷料對BALB/c小鼠激光術后皮膚屏障的修復效果,為臨床應用提供參考依據。
材料與方法
一、試劑與儀器
儀器:美國HoYa-ConBio公司型號Medlite C6的激光儀,系Q開關1064 nm激光機。增殖細胞核抗原抗體(ab18197,1∶800),偶聯辣根過氧化物酶的二抗及DAB顯色劑(EnVision TM system)均購自丹麥Dako公司。
二、動物分組
清潔級雌性BALB/c小鼠40只,6周齡,平均體重(20±2)g,購自北京衛通利華實驗動物技術有限公司,動物合格證號scxk(京)2012-0001。小鼠用人用脫毛膏兩側背部脫毛,約2 cm×2 cm區域。48 h后,取4只小鼠分別在脫毛處用Q開關1064激光機,頻率5 Hz,光斑3 mm,能量分別為4 J、5 J、6 J、7 J的激光照射脫毛區。6 h后觀察小鼠皮損處發紅,水腫,結痂情況,并處死小鼠取皮損處皮膚做HE染色,選取皮膚外觀有發紅,水腫,表皮及真皮淺層較多炎癥細胞浸潤的能量6 J作為造模能量。用6 J的能量在脫毛48 h后的36只小鼠兩側背部造成激光術后皮膚模型,將小鼠分為基質組,基質+膠原蛋白(相對分子質量 <1 000,濃度為2%)組,基質+透明質酸(相對分子質量1 300 000,濃度0.2%)組,每組12只。
三、治療
激光術后敷料(膏劑)均由昆明滇虹藥業有限公司生產,滇妝生衛字(2011)0005號。每組小鼠選擇一側背部外用對應敷料,每只每次100 μl,一天兩次,另一側背部則不做處理(陰性對照)。造模后每周脫毛1次,于造模6 h,1 d,7 d,21 d每組處死3只小鼠并分別取處理側及對照側背部皮損。
四、方法
1.無創性皮膚測試:分別于造模前,造模后,造模6 h,1 d,7 d,21 d(測試前一天脫毛)測試小鼠兩側背部皮膚經表皮失水量(TEWL)及表皮含水量。所有檢測均在室溫為23~25℃,濕度為50%~60%的室內進行,每次在同一部位測量3次,取平均值。用TewameterTM儀(德國Courega+Khazaka公司)測量表皮 TEWL 值(g·h-1·cm-2),Moisture checker儀(日本Scalar公司)測量表皮含水量。
2.增殖細胞核抗原表達檢測:4%甲醛固定,石蠟包埋,切片后脫蠟,用3%過氧化氫室溫孵育10 min后,用0.01 mol/L枸櫞酸鈉抗原修復液,高壓法抗原修復5 min后,用5%封閉用綿羊血清封閉30 min。加一抗,4℃過夜。加二抗,37℃孵育30 min。各步驟間均以PBS漂洗3次,每次5 min,DAB顯色后脫水,透明、封片。光鏡下觀察增殖細胞核抗原陽性表達率。陽性物質呈棕黃色顆粒狀,主要位于細胞核,參考文獻[2-3]方法:觀察基底層60個高倍視野(每個標本隨機觀察5個視野)。染色強度評分:0分為無色,1分為細胞染色呈淺黃色(輕度),2分為細胞染色呈黃色(中度),3分為細胞染色呈棕褐色(重度)。以陽性細胞百分率來判定,無陽性細胞表達計0,陽性細胞數為l%~25%計1分,陽性細胞數為26%~50%計2分,陽性細胞數為51%~75%計3分,陽性細胞數為75%~100%計4分。上面兩項相加為分級標準:陰性計0~1分,弱陽性(+)計2~3分,陽性(++)計4~5分,強陽性(+++)計6~7分。由病理科醫師連續讀片。
3.統計方法:無創性皮膚測試結果用單因素方差分析ANOVA;增殖細胞核抗原的表達用秩和檢驗及χ2檢驗,相關分析用Spearman等級相關分析法。P<0.05為差異有統計學意義。
結 果
一、無創性皮膚測試
6 h,1 d,7 d,21 d,每組小鼠做無創性皮膚生理功能測試,相同時間點每組間相互比較,基質組與陰性對照間,差異均無統計學意義(P>0.05),第7天,基質+膠原蛋白組與基質+透明質酸組間差異無統計學意義,兩組與基質組間差異統計學意義(P<0.05)。見表1,2。
二、增殖細胞核抗原
增殖細胞核抗原主要位于細胞核,皮膚陽性反應部位主要以基底層為主,細胞核染為棕黃色。比較每組相同時間點組間增殖細胞核抗原表達強弱。于第7天,基質+膠原蛋白組與基質+透明質酸組增殖細胞核抗原表達強度增強。見圖1。
討 論
敷料能與創面緊密粘連,為創面提供濕潤,低氧/無氧、微酸,酶學清創的愈合環境,與局部應用的藥物和機體內源性分子相作用,促進傷口愈合[4]。透明質酸(hyaluronic acid,HA)是一種廣泛分布于人和動物體內的大分子酸性黏多糖,能調節表皮角質形成細胞[5],促進創傷愈合、調控膠原合成、抗炎等作用[6],外用能調節傷口過度收縮,減少瘢痕形成[7],能在表皮形成水化膜,保持皮膚水分,加強和維持角質層吸水能力及屏障功能。在劉付華等[8]的臨床觀察證實,透明質酸修護生物膜具有恢復皮膚屏障的功能和良好的保濕作用。膠原蛋白有引導上皮細胞遷入缺損區的能力,還可誘導產生趨化因子如血小板生長因子和纖維連接蛋白等,從而對細胞的生長有趨化作用,與皮膚損傷的修復密切相關。膠原蛋白貼敷料提供了皮膚潮濕、微酸性的微環境,在皮膚科有廣泛的應用[9]。臨床也常將膠原蛋白貼敷料用于激光術后,促進創面愈合,恢復皮膚屏障功能,楊斌等[10]運用膠原蛋白貼敷料配合微晶磨疤機及激光、光子的治療取得較好的臨床效果。

表1 各組小鼠皮膚含水量(x±s)%

表2 各組小鼠皮膚經表皮失水量值(x±s)g·h-1·cm-2
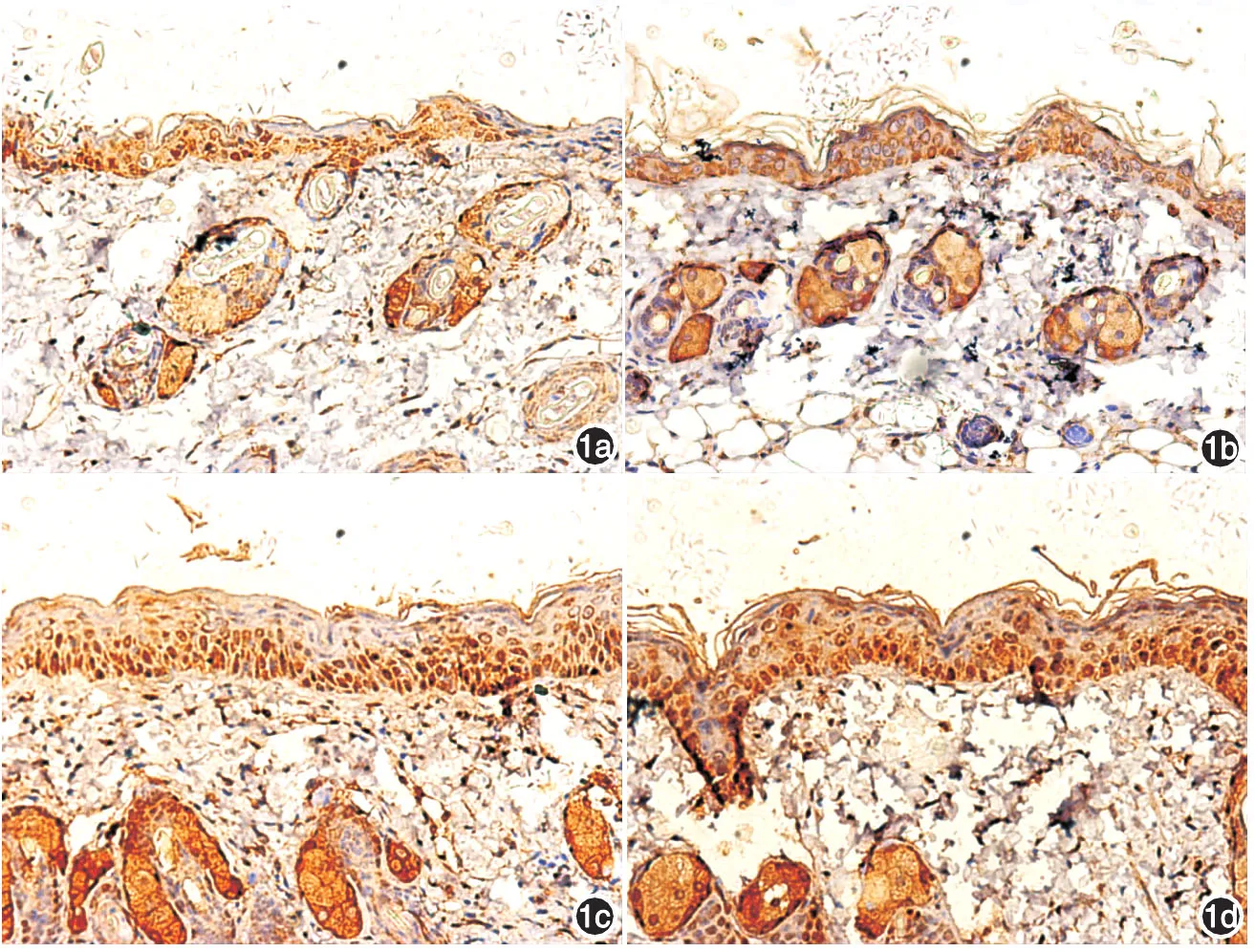
圖1 實驗第7天,小鼠皮膚增殖細胞核抗原染色(細胞核染色),基質+膠原蛋白組與基質+透明質酸組表皮較陰性對照與基質組厚,增殖細胞核抗原表達較兩對照組強(免疫組化×200) 1a:陰性對照組;1b:基質組;1c:基質+膠原蛋白;1d:基質+透明質酸
本實驗構建了激光術后真皮淺層損傷、皮膚屏障破壞的小鼠動物模型,分別觀察了外用敷料基質,基質+膠原蛋白,基質 +透明質酸對皮膚屏障修復情況。皮膚屏障保持皮膚的水分,維持正常的生理功能,激光術后皮膚屏障損傷。TEWL測定的是通過皮膚擴散入外界環境的水分,是反映皮膚屏障功能的一個重要參數,可反映出皮膚屏障損傷程度,其值越高表示皮膚屏障受損越嚴重,角質層含水量可反映皮膚屏障功能,兩指標用于評價皮膚屏障修復情況[11]。6 h、24 h各組間差異無統計學意義(P>0.05)。于第7天,基質+膠原蛋白組與基質+透明質酸組皮膚含水量較基質組與陰性對照高,TEWL值較其低,差異有統計學意義(P<0.05),而兩組間差異無統計學意義(P>0.05)。證明其能促進皮膚屏障功能修復,第21天,各組與造模前比較,角質層含水量及TEWL值差異無統計學意義(P>0.05),小鼠屏障功能恢復。增殖細胞核抗原[12]又稱細胞周期蛋白或周期素,是一種相對分子質量36 000、酸性、無組蛋白的細胞核多肽,是真核細胞DNA合成所必需的一種核蛋白,它的表達合成與增殖細胞的增殖周期有關,是DNA聚合酶的輔助蛋白,參與調節DNA的合成,是DNA復制過程中所必需的。增殖細胞核抗原可作為細胞增殖的特異性標記,反映細胞的增殖活性。第7天,外用透明質酸敷料組與膠原蛋白敷料組角質層較對照組厚,增殖細胞核抗原表達增強,證明其對皮膚屏障修復有促進作用。
本實驗通過構建BALB/c小鼠激光術后皮膚動物模型并外用透明質酸敷料與膠原蛋白敷料進行對比觀察,證實了透明質酸敷料能促進激光術后皮膚屏障恢復,作用與臨床廣泛使用的膠原蛋白敷料相當。
[1] 涂穎,何黎.激光治療對皮膚的損傷及護理[J].臨床皮膚科雜志,2008,37(8):548-550.
[2]Hannuksela-Svahn A,P??kk? P,Autio P,et al.Expression of p53 protein before and after PUVA treatment in psoriasis[J].Acta Derm Venereol,1999,79(3):195-199.
[3]Kawahira K.Immunohistochemical staining of proliferating cell nuclear antigen(PCNA)in malignant and nonmalignant skin diseases[J].Arch Dermatol Res,1999,291(7-8):413-418.
[4] 趙亮,李敏.創面生物敷料及人工皮膚的研究進展[J].福建師范大學學報(自然科學版),2011,27(1):120-124.
[5]Huang L,Gu H,Burd A.A reappraisal of the biological effects of hyaluronan on human dermal fibroblast[J].J Biomed Mater Res A,2009,90(4):1177-1185.
[6]涂穎,顧華,何黎.透明質酸在皮膚病發病機制中的研究進展[J].臨床皮膚科雜志,2012,41(3):192-194.
[7]Gu H,Huang L,Wong YP,et al.HA modulation of epidermal morphogenesisin an organotypic keratinocyte-fibroblastcoculture model[J].Exp Dermatol,2010,19(8):e336-e339.
[8] 劉付華,施為,烏日娜,等.透明質酸生物膜輔助治療干燥性濕疹的多中心對照研究[J].中華皮膚科雜志,2013,46(6):433-436.
[9] 孫瑋杰,周志剛,王百順.外用膠原蛋白敷料面膜及皮膚止癢脫敏膜治療面部激素依賴性皮炎臨床觀察[J].中華皮膚科雜志,2010,43(10):748.
[10] 楊斌,陳抗.膠原蛋白貼敷料在美容皮膚的臨床研究[J].中國熱帶醫學,2005,5(4):803-804.
[11] 鄒菥,楊成,何黎,等.面部痤瘡,濕疹,黃褐斑及日光皮炎皮膚屏障功能評價及其臨床意義[J].中華皮膚科雜志,2013,46(1):29-32.
[12]Barnouti ZP,Owtad P,Shen G,et al.The biological mechanisms of PCNA and BMP in TMJ adaptive remodeling[J].Angle Orthod,2011,81(1):91-99.
2013-07-18)
(本文編輯:吳曉初)
Restoring effect of hyaluronic acid on impaired skin barrier function in BALB/c mice after laser irradiation
Xu Liangheng*,Gu Hua,Guo Meihua,Liu Haiyang,Liu Fuhua,Tu Ying,Pang Qin,He Li.*First Affiliated Hospital of Kunming Medical University,Collaborative Innovation Center of Yunnan Province,Engineering and Technology Research Center of Yunnan Province,Kunming 650032,China
He Li,Email:heli2662@hotmail.com
ObjectiveTo evaluate the restoring effect of dressings containing hyaluronic acid on impaired skin barrier function in BALB/c mice after laser irradiation.MethodsThe back of 63 BALB/c female mice were shaved with depilatory cream followed by exposure to Q-switched 1064-laser(frequency,5 Hz;light spot,3 mm;energy,6 J).Then,the mice were randomly and equally divided into three groups to be topically treated with dressings containing vehicle,vehicle+collagen protein and vehicle+hyaluronan acid respectively twice a day for 21 days.The dressings were only applied at one side of the back of these mice,and the other side was left untreated to serve as a negative control.Skin physiological parameters were measured on the back of these mice at 6 hours,24 hours,7 days,and 21 days after the beginning of treatment,and 3 mice were sacrificed in each group at every time points.Skin tissue specimens were obtained from the back of sacrificed mice followed by immunohistochemistry for the detection of proliferating cell nuclear antigen(PCNA).ResultsOn the 7th day,the vehicle+collagen protein group and vehicle+hyaluronan acid group showed lower TEWL values((13.9±0.9)and(12.6±0.6)vs.(18.4±0.4)and(18.4 ± 0.5)g·h-1·cm-2,allP< 0.05),but increased water content in stratum corneum(33.6% ± 0.1%and 33.7%±0.1%vs.25.4%±0.2%and 26.5%±1.3%,allP<0.05)and PCNA expression compared with the vehicle group and negative control group(side).However,no significant difference was observed between these groups in any of the above parameters at 24 hours,1 day,or 21 days after the beginning of treatment(allP> 0.05).Additionally,all the parameters returned to the preirradiation levels on the 21stday in all the three groups(allP>0.05)with the recovery of skin barrier function.ConclusionsThe effects of dressings containing collagen protein and those containing hyaluronic acid are comparable on the restoration of impaired skin barrier function in BALB/c mice after laser irradiation.
Laser;Hyaluronic acid;Bandages,hydrocolloid;Skin,barrier;Animal experimentation
10.3760/cma.j.issn.0412-4030.2014.05.011
教育部2013年度“創新團隊發展計劃”(IRT13067);云南省衛生高層次人才培養計劃(L-201211)
650032昆明醫科大學第一附屬醫院、云南省協同創新中心、云南省工程技術研究中心(徐良恒、顧華、劉付華、涂穎、何黎);昆明醫科大學(郭美華);中國科學院昆明植物研究所(劉海洋);昆明薇諾娜皮膚醫療美容中心(龐勤)
何黎,Email:heli2662@hotmail.com

