1-MCP結合ClO2固體緩釋劑處理對番茄貯藏的保鮮效果*
余定浪,任柯霖,歐州,譚書明
1(貴州大學釀酒與食品工程學院,貴州貴陽,550025)(貴州省農畜產品貯藏與加工重點實驗室,貴州貴陽,550025)
番茄(tomato,Lycopersicum esculentum Mill)屬茄科番茄亞屬草本植物,營養豐富,味美可口,食用方法多樣,深受廣大消費者喜愛。番茄屬于呼吸躍變型漿果,采后果實對乙烯極為敏感,在貯藏期間易受疫病、軟腐病、潰瘍病等多種病害的影響或侵染,極易導軟化腐敗而失去商品價值,造成較大的損失[1-2],因此,番茄的貯藏與保鮮極為重要。
1-甲基環丙烯(1-MCP)是一種新型乙烯受體抑制劑,能與乙烯受體發生不可逆性的結合,阻斷乙烯與受體的結合,抑制其所誘導的與果實后熟有關的生理生化反應,從而延緩果蔬的成熟與衰老進程[3-4]。二氧化氯(ClO2)是一種新型高效廣譜、安全無毒的消毒劑,它殺菌能力強、無氣味殘留,能阻止阻止蛋氨酸生成乙烯,從而延緩果蔬衰老與腐爛[5-6]。1-MCP和ClO2已廣泛使用于果蔬貯藏保鮮領域,但兩者結合處理的研究還比較少。研究報道蟠桃[7]、葡萄[8]采用1-MCP結合ClO2處理表現出很好的保鮮效果。本實驗以番茄為材料,研究了在室溫和低溫貯藏條件下,1-MCP和ClO2固體緩釋劑不同處理方式對番茄貯藏效果的影響。
1 材料與方法
1.1 材料與試劑
番茄:品種“金剛”,采摘自遵義縣現代農業示范園區,采收成熟度綠熟期的果實,采收當天運抵實驗室,通風預冷后挑選色澤均勻、大小均一(單果重為100 g左右)、無機械損傷、無病蟲害的果實作為試驗材料。
1-甲基環丙烯(1-MCP):蘭州嘉誠生物技術有限公司出品,有效成分為4.5%。ClO2固載緩釋劑:由本課題組自制,主要成分為NaClO2、酒石酸、CaCl2及活性炭。咔唑、半乳糖醛酸、濃H2SO4、冰醋酸、乙酸鈉、多聚半乳糖醛酸、3,5-二硝基水楊酸、葡萄糖、乙醇等,均為分析純,實驗用水均為蒸餾水。
1.2 主要儀器
FHM-1硬度計,日本;M5IR復合式氣體檢測儀,BW科技公司,美國;RHB80手持折光儀,泰斯特儀器有限公司;TES-135色差計,臺灣泰仕;T6紫外分光光度計,北京普析通用儀器有限責任公司;TGL20M臺式高速冷凍離心機,長沙邁佳森儀器設備有限公司。
1.3 實驗方法
1.3.1 處理方法
將樣品隨機分為4組,分別進行以下4種處理:
第1組(對照CK):直接用紙箱包裝,每箱50個番茄果實。
第2組(1-MCP處理)參照陳印金等的方法[9]:先將其放入體積約為45 L的保鮮泡沫箱中(每箱50個番茄),同時將裝有0.001 2g 1-MCP粉劑的50 mL燒杯放入沫箱中,然后往燒杯內加入10 mL蒸餾水,迅速把泡沫箱蓋上密封,使箱內氣體濃度約為0.5 ul/L,處理20 h后,用紙箱進行包裝。
第3組(ClO2處理):用紙箱分裝后向箱內放入ClO2固體緩釋劑。
第4組(1-MCP+ClO2處理):按照第2組的方法先用1-MCP處理后用紙箱包裝,然后向紙箱內放入ClO2固體緩釋劑。
ClO2固體緩釋劑使用量:室溫為1 g/kg,低溫為2.5 g/kg。
以上紙箱包裝均為每箱50個番茄果實(約重5 kg),將以上處理過的番茄分為2批分別置于室溫[(20~25)℃]和低溫[(10±1)℃]條件下貯藏,每種處理重復3次。每5 d觀察統計番茄的轉色及腐爛發病情況,取樣做各生理生化指標分析。
1.3.2 測定項目與方法
果實硬度采用日本FHM-l型硬度計測定;可溶性固形物用手持式折光儀測定;果膠酶活性的測定采用比色法[10];果膠含量的測定采用咔唑比色法[11],呼吸強度采用CO2分析儀測定法[12]。腐爛率測定:
腐爛率/%=(無商業價值果數/抽檢果數)×100
轉色指數的測定參照榮瑞分等的方法[13]。
1.2.3 數據統計與分析
本實驗所有指標均在鮮重狀態下測定,試驗結果采用 Microsoft Excel軟件進行數據整理,經 SPSS 18.0統計軟件進行分析。文中圖表用Origin8.5軟件繪制。
2 結果與分析
2.1 不同處理對番茄轉色率的影響
番茄果實的成熟與衰老主要表現為果實的轉色及硬度的降低,隨著果實成熟,番茄果實逐漸失綠轉紅,并開始軟化[14]。由表1中可知,在室溫條件下,對照組和ClO2緩釋劑單獨處理組在貯藏5 d時,轉色指數分別達47%和45%,貯藏15 d時轉色指數均高于90%,果實基本完全轉紅;經過1-MCP處理的果實在貯藏前15 d轉色指數均顯著低于對照組和ClO2緩釋劑單獨處理組(P<0.01),20 d后,各組果的轉色指數無顯著差異。在低溫條件下,番茄轉色明顯受到抑制,前30 d各處理組顯著顯著低于對照組(P≤0.01);35 d時,對照組果實全部轉紅,各處理組轉色指數也達90%以上。
從表1中還可以看出,無論在常溫或低溫條件下,1-MCP處理能顯著性的延緩番茄在貯藏時色澤的變化,ClO2緩釋劑單獨處理對延緩番茄轉色在常溫下沒有明顯的作用。
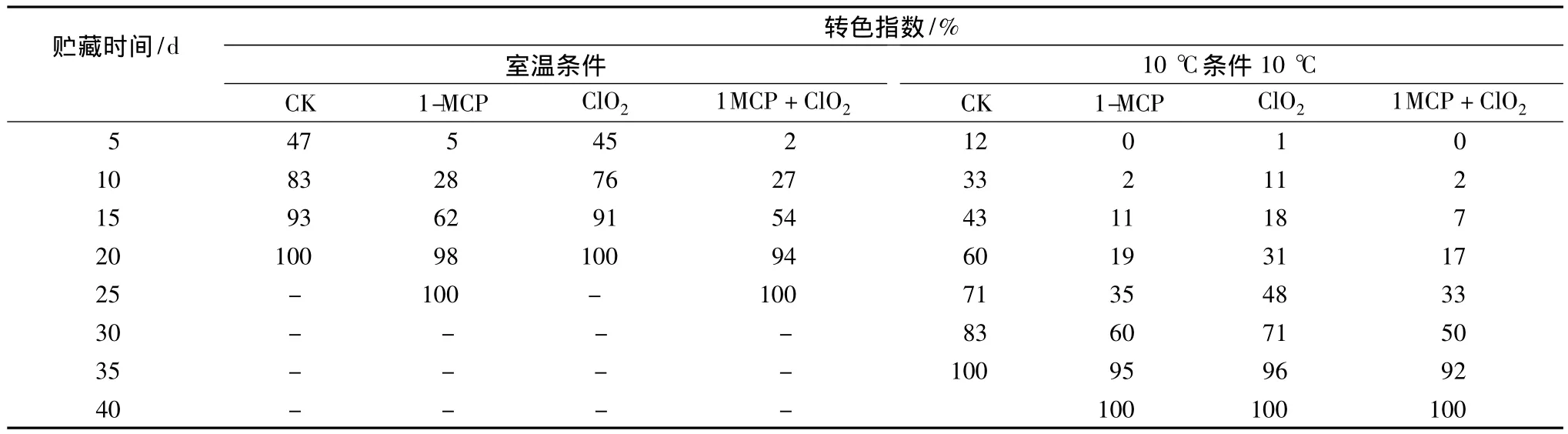
表1 不同貯藏條件下各處理對番茄轉色指數的影響Table 1 Effects of different inhibitors treatments on degreening index of tomato under two storage conditions
2.2 不同處理對番茄腐爛率的影響
貯藏過程中,番茄的腐爛主要是因為病原微生物的浸染,導致組織軟化腐敗。由表2可看出,溫度對番茄腐爛率有很大的影響,在室溫下,對照組在貯藏10 d后開始出現腐爛,1-MCP+ClO2處理在第20天時才出現腐爛現象,并且腐爛率低于1-MCP、ClO2緩釋劑單獨處理組,貯藏30 d其腐爛率僅為20%。在低溫下,對照組番茄20 d開始出現腐爛果,各處理組均在第25天時開始出現腐爛果,1-MCP+ClO2處理組在第45天時腐爛率為22%,僅占對照組的45.8%。在2個溫度條件下,整個貯藏過程中對照組的腐爛率顯著高于處理組(P<0.01);1-MCP+ClO2處理腐爛最少,其次是ClO2緩釋劑單獨處理,這可能是由于1-MCP能延緩番茄果實的衰老,增強果實的抗病性,再加上ClO2具有殺菌的作用,可防止病原菌對番茄果實的浸染,從而降低番茄的腐敗。
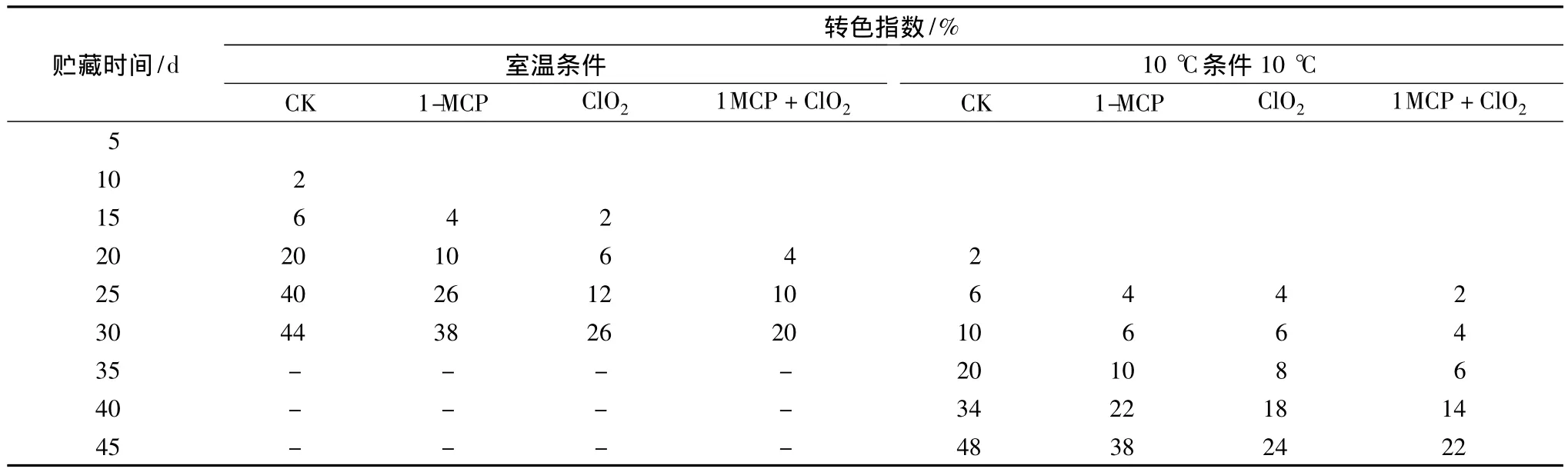
表2 不同貯藏條件下各處理對番茄腐爛率的影響Table 2 Effects of different inhibitors treatments on incidence of decay of tomato under two storage conditions
2.3 不同處理對番茄呼吸強度的影響
如圖1所示,在整個貯藏過程中,低溫條件下各組番茄果實的呼吸強度明顯低于室溫條件。不同處理之間存在明顯差異,3種處理均延緩番茄呼吸高峰的到來,并在一定程度上抑制了果實的呼吸。在室溫下,ClO2緩釋劑處理的果實在前5 d呼吸迅速加快,但第5天后開始下降,直到第15天時出現明顯的呼吸峰,這可能是由于ClO2緩釋劑在開始反應比較慢,產生的ClO2氣體量少,對番茄的呼吸抑制不明顯,但在5 d后緩釋劑體系反應迅速,產生大量ClO2氣體,抑制番茄呼吸。1-MCP對番茄的呼吸有著明顯的抑制作用,尤其是在貯藏前期。冷藏條件下,番茄果實的呼吸強度受到抑制,前期都呈降低的趨勢,對照組在第15天出現呼吸高峰,1-MCP、ClO2緩釋劑單獨處理組均在第20天出現高峰,1-MCP結合ClO2緩釋劑處理組在整個貯藏期內無明顯的呼吸高峰。
2.4 不同處理對番茄硬度的影響
由圖2可看出,2個溫度條件下貯藏的番茄果實硬度隨貯藏期的延長不斷下降,這是由于果實的后熟,其內部產生果膠酶,原果膠被水解生成可溶性果膠和果膠酸,細胞壁的纖維變得松散,果肉細胞分離,使果實逐漸變軟、硬度下降[15]。常溫貯藏對照組的硬度下降最快,貯藏20 d時僅為0.45 kg/cm2左右;經1-MCP+ClO2處理的番茄硬度下降最緩慢,貯藏30 d時大于0.49 kg/cm2。在低溫下貯藏前期,番茄果實硬度下降緩慢,且無明顯差異,直到第20天時,對照組果實硬度開始迅速降低,3個處理組到30 d時才開始出現明顯的下降趨勢,其中1-MCP+ClO2處理的番茄硬度下降最緩慢。
2.5 不同處理對番茄果膠酶活性的影響
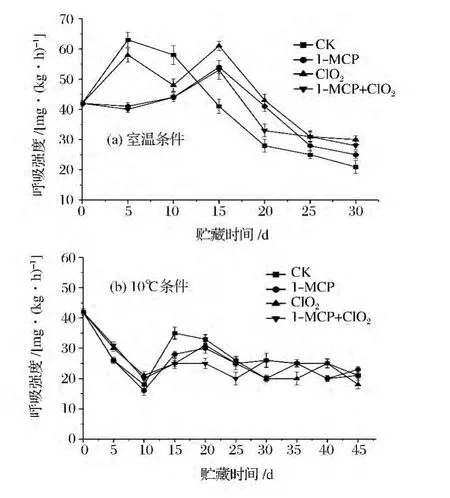
圖1 不同貯藏條件下各處理對番茄呼吸強度的影響Fig.1 Effects of different inhibitors treatments on respiration intensity of tomato under two storage conditions
從圖3可以看出,在2個溫度貯藏條件下,各組番茄果實的PG酶活性呈先上升后緩慢降低的趨勢,對照組PG酶活性的上升速度明顯高于處理組。在貯藏前期,3組處理均能明顯抑制PG酶活性的升高,其中1-MCP+ClO2處理對番茄PG酶活性的影響最明顯;在貯藏后期,各處理對番茄PG酶活性的影響均無明顯差異。
2.6 不同處理對番茄可溶性果膠、原果膠含量的影響
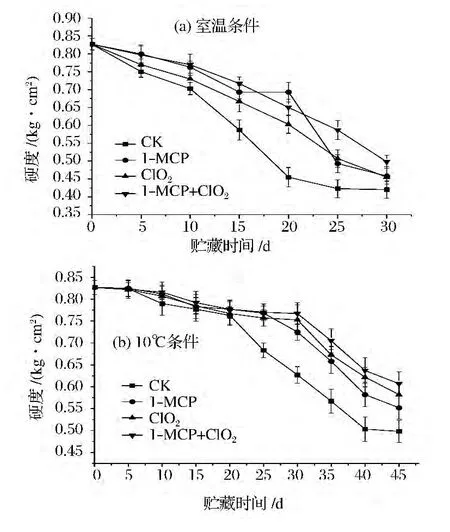
圖2 不同貯藏條件下各處理對番茄硬度的影響Fig.2 Effects of different inhibitors treatments on firmness of tomato under two storage conditions
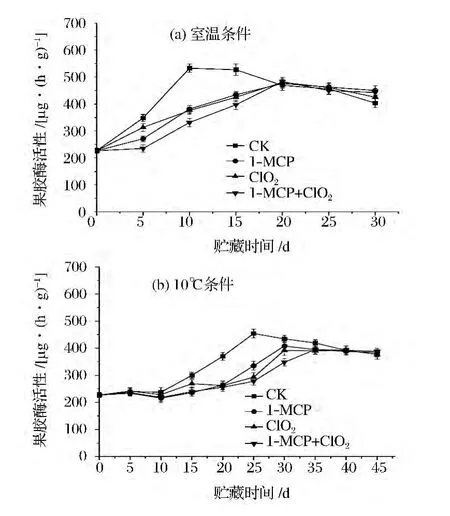
圖3 不同貯藏條件下各處理對番茄果膠酶(PG)活性的影響Fig.3 Effects of different inhibitors treatments on pectinase activity of tomato under two storage conditions
如圖4所示,在貯藏過程中各組番茄中可溶性果膠含量總體呈上升的趨勢,而原果膠逐漸減少。室溫下,3組處理番茄中的可溶性果膠含量上升幅度明顯低于對照組,且各處理間差異顯著(P<0.05),其中1-MCP+ClO2處理上升最慢,其次是1-MCP處理。在低溫下,貯藏前期各組果實的可溶性果膠含量上升比較緩慢,各組間無明顯差異,直到第20天后對照組開始迅速上升,顯著高于其他3個處理組(P<0.01),第25天后1-MCP處理組也開始迅速上升,ClO2、1-MCP+ClO2處理組在30 d后才開始有明顯的上升趨勢。
由圖4可知,在貯藏過程中,原果膠含量隨可溶性果膠含量的降低而逐漸下降,這是由于果實在貯藏過程中,細胞壁原有的大量原果膠(不溶性果膠),在果膠酶的作用下分解為水溶性果膠[16-17]。實驗結果表明,在貯藏過程中番茄水溶性果膠與原果膠的變化呈顯著性負相關(室溫:r=0.957,a=0.01;低溫:r=0.945,a=0.05),原果膠逐漸轉變為水溶性果膠,使果實細胞壁組織受到破壞,導致番茄組織軟化,硬度下降。

圖4 不同貯藏條件下各處理對番茄果膠含量影響Fig.4 Effects of different inhibitors treatments on content of pectin of tomato under two storage conditions
2.7 不同處理對番茄可溶性固形物的影響
由圖5可知,在不同溫度貯藏條件下,各組番茄可溶性固形物含量均呈先上升后緩慢下降的趨勢,這主要是由于采后番茄在后熟過程中組織內一些大分子物質的水解作用,使其含量在貯藏初期增加;但另一方面,隨著呼吸作用的不斷進行,并且沒有外界物質提供,可溶性固形物的消耗量大于產生量,使其在貯藏后期的含量逐漸降低[18]。貯藏前期對照組果實可溶性固形物含量的上升趨勢要比處理組明顯,差異達到極顯著(P<0.01),貯藏后期處理組的下降程度低于對照組,其中1-MCP+ClO2處理組的下降程度最小。
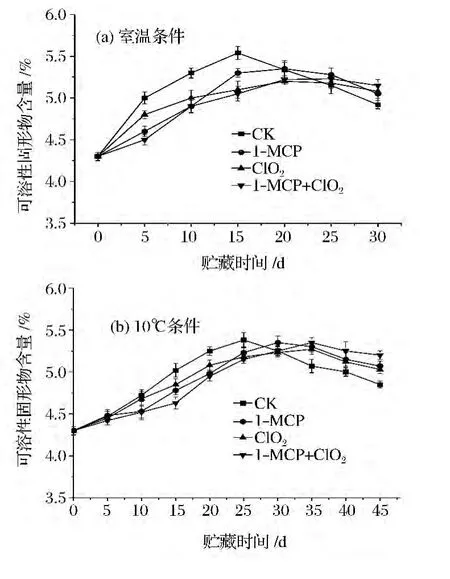
圖5 不同貯藏條件下各處理對番茄可溶性固形物含量的影響Fig.5 Effects of different inhibitors treatments on soluble solids content of tomato under two storage conditions
3 結論與討論
本試驗在室溫和低溫貯藏下用1-MCP和ClO2對綠熟期的番茄進行不同處理,結果表明無論是單獨處理還是結合處理均表現出了一定的保鮮效果,且兩者結合處理效果優于單獨處理;1-MCP+ClO2處理結合低溫貯藏更能有效地保持番茄的品質,延長貯藏期。
1-MCP可以競爭性地與乙烯受體蛋白質結合,阻止內源和外源乙烯與受體結合,阻斷乙烯的正常代謝過程,并抑制其誘導的與果實后熟相關的一系列生理生化反應,進而延緩果實衰老進程。但是1-MCP只有在呼吸躍變型果實躍變前進行處理才有效,對躍變期和越變后的果實作用很小或沒有作用,當內源乙烯催化果實達到一定的后熟階段后,1-MCP就失去了抑制乙烯的作用[19]。
然而ClO2固體緩釋劑在番茄貯藏過程中,緩慢釋放出ClO2氣體,它能有效地阻止果蔬組織內部蛋氨酸的分解,阻止乙烯的生產及破壞已產生的乙烯,并且有很強的殺菌能力,同時可以抑制腐敗菌的生成[6]。但是ClO2固體緩釋劑釋放ClO2氣體是一個緩慢的過程,初期貯藏環境中ClO2氣體積累量較少,因此前期對番茄的生理變化影響效果不明顯。
在本實驗中,番茄貯藏前先用1-MCP處理,在貯藏過程中放入ClO2固體緩釋劑,這樣充分利發揮了1-MCP和ClO2固體緩釋劑的保鮮作用,同時很好地彌補了兩者單獨使用時的不足。1-MCP和ClO2固體緩釋劑結合處理有效地抑制貯藏過程番茄果實的呼吸強度,推遲呼吸躍變的出現,延緩果實生理生化反應進程,進而延緩組織衰老;同時抑制病原菌的生長,從而減少果實的發病、腐爛,更好的保持果實的品質。因此采用1-MCP結合ClO2處理在果蔬貯運保鮮中,具有潛在的應用價值和廣闊的應用前景。
[1] 張子德.果熟貯運學[M].北京:中國輕工業出版社,2002.
[2] 程科,李潔,趙思明.西紅柿的貯藏特性研究[J].現代食品科技,2006,22(3):28-31.
[3] Arnold M Opiyo,YING Tie-Jin.Effect of 1-Methylcyclopropene post-harvest treatment on ripening process in cherry tomato fruit(Lycopersicon esculentum var.cerasi forme)[J].Journal of Plant Physiology and Molecular Biology,2005,31(1):27-33.
[4] 付琳,程順昌,魏寶東.1-MCP及其結構相似物處理對番茄采后貯藏效果的影響[J].食品與發酵工業,2012,38(1):195-198.
[5] 傅茂潤,杜金華.二氧化氯在食品保鮮中的應用[J].食品與發酵工業,2004,30(8):113-116.
[6] 傅茂潤.二氧化氯(ClO2)對果蔬的貯藏效果及其機理研究[D].青島:山東農業大學,2005,11.
[7] 肖麗梅;鐘梅等.1-甲基環丙烯和二氧化氯對新疆蟠桃保鮮效果的研究[J].食品科學,2009,30(12):276-280.
[8] 馮敘橋;關筱歆等.1-MCP結合ClO2處理對冰溫貯藏玫瑰香葡萄生理和品質的影響[J].食品工業科技,2012(17):333-337.
[9] 陳金印;劉康.1-MCP處理對秋番茄果實采后生理及貯藏效果的影響[J].食品科學,2008,29(10),598-603.
[10] 曹建康;趙玉梅等.果蔬采后生理生化實驗指導[M],北京:中國輕工業出版社,2007:87-90.
[11] 曹建康;趙玉梅.果蔬采后生理生化實驗指導[M],北京:中國輕工業出版社,2007:84-87.
[12] 張桂.果蔬采后呼吸強度的測定方法[J].理化檢驗-化學分冊.2005,41(8):596-597.
[13] 榮瑞分;佟世生;馮雙慶.水楊酸對采后芒果核番茄保鮮效果的初步研究[J].食品科學,2001,22(3)79-81.
[14] 齋騰隆.番茄生理基礎[M],上海:上海科學技術出版社,1981.
[15] 陳志遠,韓志平,張海霞.1-MCP在果蔬貯藏保鮮中的應用[J]. 黑龍江農業科學,2013(10):104-106.[16]Bett C,Waldron K W.Chapman and Hau[M].London:UK,1996:256.
[17] Dessalegne L,Wetter AC,Caligari PDS.Production of transgenic tomato expressing oxalate oxidase[J].AltaHorticurae,1997,447:457-458.
[18] 王海亭.中國番茄[M].黑龍江科學技術出版社,2001:171-178.
[19] 王玥.不同溫度、包裝及擠壓處理對采后番茄品質的影響[D].天津:天津大學,2010:6.

