不同儲藏條件下玉米中霉菌對黃曲霉毒素B1的影響*
李聽聽,陳偉,李廣富,盧中一,劉錦繡
(山東農業大學食品科學與工程學院,山東泰安,271018)
我國是儲糧大國,玉米是我國三大主要糧食品種之一,產量約為全國糧食總產量的1/4[1]。玉米屬于不耐儲品種,在儲藏期間會受到各種微生物特別是霉菌的危害,霉菌感染糧谷作物,能引起食物發生腐敗變質,尤其在高濕高溫的環境下,霉菌生長旺盛,同時其分泌的毒素對人體有很強的致癌作用,因此,防止真菌污染和真菌毒素是糧食儲藏過程中最關鍵的問題[2-3]。
在各類霉菌產生的毒素中,黃曲霉毒素B1最為常見,且毒性最大[4]。高效液相色譜法測定黃曲霉毒素B1是目前國內使用最多、最為權威的方法,具有高效、準確性好、靈敏度高、檢測限低等特點[5]。
早在20世紀50年代,Lichtwardt等對儲糧真菌進行了調查和分類,得出危害玉米的主要微生物是霉菌,發現灰綠曲霉和白曲霉是引起儲糧劣變主要真菌;隨后,Pitt和Magan等對儲糧真菌生長及產毒所需最低水分活度做了研究[6-7],表明小麥水分含量在13.0%以下,就可以阻止大部分微生物的生長;Ayerst等研究了主要儲糧真菌的生長條件[8],得出多數霉菌生長的最適溫度是25~30℃,繁殖所需最低含水量一般為13%~18%。
本實驗設定不同的相對濕度和水分含量,對儲藏玉米中的霉菌和黃曲霉毒素B1進行測定,并分析糧食儲藏過程中黃曲霉毒素B1與霉菌的關系,探討不同相對濕度儲藏環境下,優勢真霉菌活動差異性、黃曲霉毒素B1產量差異性及相關性。
1 材料與方法
1.1 儀器與試劑
1.1.1 玉米原料
岱玉D4收獲于2013年10月份,購買于泰安市農貿市場。
1.1.2 設備與儀器
Agilent 1260高效液相色譜儀,杭州瑞析科技技術有限公司;Agilent 1260熒光檢測器,杭州瑞析科技技術有限公司;BIBBY RE200旋轉蒸發儀,寧波金晟杰機電有限公司;IKA渦旋振蕩器,常州冠軍儀器制造有限公司;N-EVAPTM112氮吹儀,美國Organomation Associates公司;JFSD-70實驗室粉碎磨,上海市嘉定糧儀器廠;微型高速離心機,上海安亭科學儀器廠。
1.1.3 主要試劑
黃曲霉毒素B1標準溶液:美國02si;乙腈(色譜純):天津市凱通化學有限;甲醇、正己烷及氯仿(分析純):天津市凱通化學有限;三氟乙酸(分析純):宏欣精細化工;氯霉素:Solarbio。
1.2 實驗方法
1.2.1 玉米的水分調節[9]
將水分調節至 12.41%、14.30%、15.89%、17.62%、19.88% 五個梯度。將清理的玉米分5等份,每份約5 kg,置于塑料容器中,采用噴霧方法,加入不同量的無菌水,按其含水量計算調節至目標含水量所需的理論添加無菌水量,用噴霧器分3次將理論添加無菌水量的蒸餾水噴到糧食表面,邊噴邊攪拌,以保證著水的均勻。著水后的玉米放置塑料袋內,排出袋中空氣,密封于冰箱4℃冷藏保存,平衡24 h。
1.2.2 模擬儲藏
干燥器(180 mm)內放置不同飽和鹽溶液,以形成不同相對濕度的密閉環境件。分別以NaCl、KNO3和KCl的飽和鹽溶液配置在30℃形成75%、84%、92%不同的相對濕度。將稱取的玉米樣品500 g分別放在無菌透氣保鮮袋內,將保鮮袋放在裝有不同飽和鹽溶液的干燥器內,置于30℃恒溫培養箱中培養。
1.2.3 水分的測定
玉米樣品含水率的測定按照(GB5497-1985糧食、油料檢驗水分測定法)[10]執行。
1.2.4 玉米霉菌菌落計數及分離與鑒定
參照國標食品衛生微生物學檢驗霉菌和酵母計數(GB 4789.15-2010)[11]。玉米中霉菌的分離及鑒定參照(GB/T 4789.16)[12]、中國真菌志第五卷“曲霉屬及相關有性型”和(齊祖同,1997)執行[13]。
1.2.5 玉米黃曲霉毒素B1的提取和凈化
本實驗參照謝剛[14]等人的方法并加以改進。將儲藏35 d玉米樣品粉碎后取5 g于150 mL的錐形瓶中分別加入25 mL的甲醇水(55∶45),用保鮮膜封口,放在超聲波清洗器中超聲20 min后取出,將溶液全部倒入離心管中,離心5 min(轉速為3 500 r/min)。離心結束后,取上層清液4 mL于另一離心管中,加入4 mL CHCl3,渦旋后靜置分層,然后用移液槍吸取下層液體于試管中,再加4 mL CHCl3重復上述操作,合并CHCl38 mL,60℃水浴氮吹干,注意避免液體鼓泡、飛濺。
1.2.6 玉米黃曲霉毒素B1的衍生
向剩余物中加入200 μL正己烷和100 μL三氟乙酸,塞上塞子,放在40℃的水浴鍋中衍生20 min,60℃水浴氮吹干,用15%的乙腈定容至1 mL,置于注射器中,用0.22 μm的濾膜過濾于進樣瓶中,供測定用[4]。
1.2.7 標準工作液的衍生
吸取黃曲霉毒素標準溶液200 μL,在60℃水浴下氮氣吹干,衍生化方法同1.2.6。
1.2.8 液相色譜條件
色譜柱:Diamonsil C18(2)(250 mm×4.6 mm i.d,5 μm 粒度)。流動相∶乙腈∶水(15∶85);流速:1 mL/min;進樣量:20 μL;柱溫:30℃。熒光檢測器:激發波長360 nm,發射波長440 nm。注:宜在色譜柱前加保護柱(或預柱),以延長色譜柱使用壽命。
1.2.9 黃曲霉毒素B1的換算公式
y=(0.402 9x-0.564 7)×25/4/5
式中:y,每kg玉米中所含黃曲霉毒素B1的量,μg/kg;x,峰面積;25,制備的毒素提取液的總量是25 mL;4,從25 mL中取了4 mL進行檢測;5,樣品中玉米的質量(5 g)。
1.3 數據統計方法
數據處理和分析采用SAS v9.0軟件。
2 結果與分析
2.1 儲藏期間玉米水分變化
在溫度30℃,相對濕度75%的環境中(如圖1),玉米前14 d儲藏過程中,5個水分梯度呈現上升趨勢。可能是由于在低的相對濕度環境下,玉米解吸率大于回收率。隨著儲藏時間延長,玉米微生物開始大量繁殖,尤其是霉菌,大量分解著玉米中的淀粉等有機質產生大量水分,通過濕熱交換,玉米中的水分大量揮發,因此余下21 d的儲藏時間內,小麥水分會呈現微下降趨勢[15]。
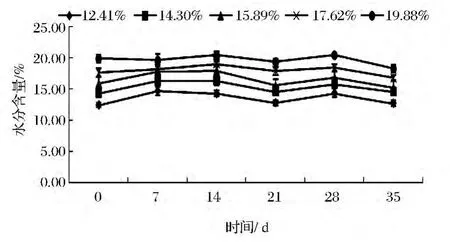
圖1 RH 75%的環境中玉米水分含量的變化Fig.1 The corn moisture changes under relative humidity 75%environment
在溫度30℃,相對濕度84%和92%的環境(如圖2、圖3),玉米在整個35 d的儲藏時間,兩個環境下含水量不同的玉米整體呈現上升趨勢,且環境濕度較高的RH 92%的玉米水分上升趨勢較明顯。這是因為中、高濕度環境下的基質食的解吸率小于回收率,直至基質含量與環境濕度相平衡為止[16]。經單因素方差分析,低、中、高三個環境下不同含水量的玉米,在儲藏35 d的過程中,水分含量無顯著性差異(P>0.05)。
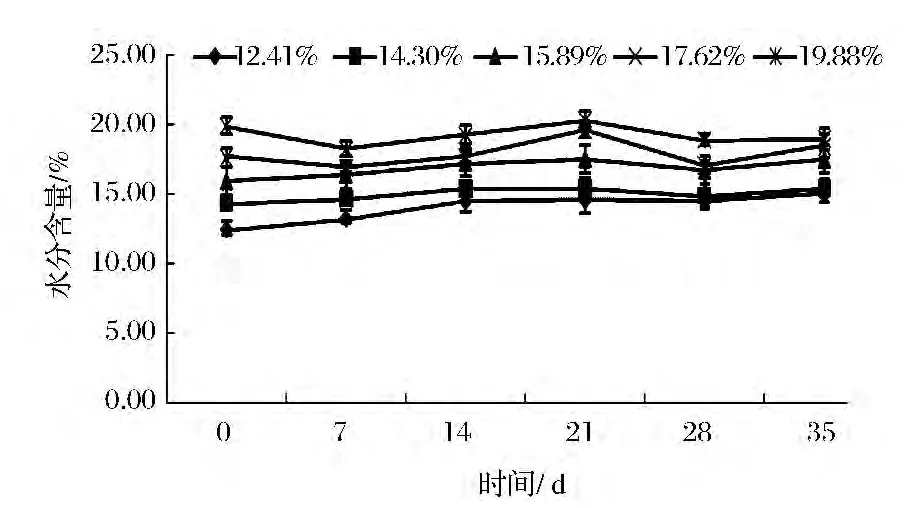
圖2 RH 84%的環境中玉米水分含量的變化Fig.2 The corn moisture changes under relative humidity 84%environment
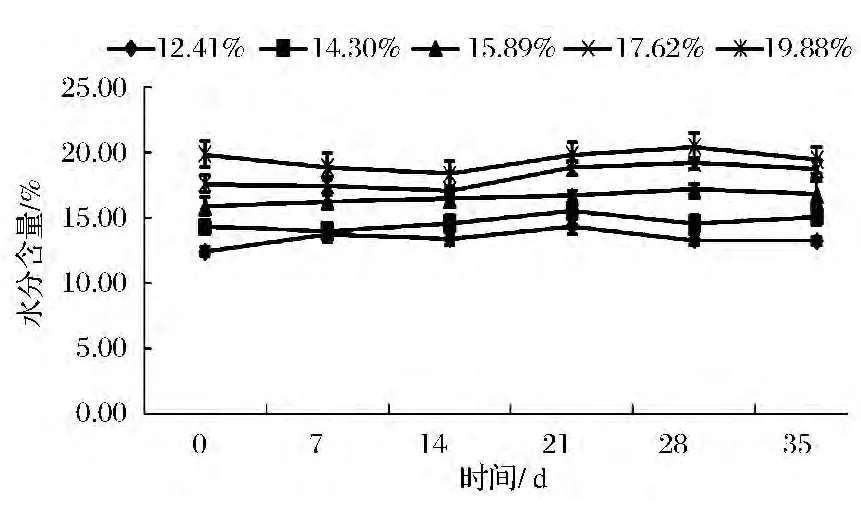
圖3 RH 92%的環境中玉米水分含量的變化Fig.3 The corn moisture changes under relative humidity 92%environment
2.2 黃曲霉毒素B1標準曲線方程
黃曲霉毒素B1濃度與峰面積呈現良好的線性回歸方程y=0.402 9x-0.564 7,相關系數0.999 5。其中,y:濃度(mg/mL);x:峰面積。
2.3 不同儲藏環境下霉菌、木霉、黑曲霉、黃曲霉與黃曲霉毒素B1的量間關系
從表1可以看出在溫度30℃,相對濕度75%的環境中霉菌和木霉的總量隨玉米中水分含量的增加而呈現上升趨勢,而此環境中黑曲霉、黃曲霉的量及黃曲霉毒素B1積累量隨水分增加均呈現先增加后下降的趨勢,兩種菌均在初始含水量為15.89%處取得最大菌落數,且黃曲霉毒素B1在水分含量處有最大毒素積累量,是初始毒素量的29.88倍。當玉米中的水分含量超出15.89%,通過營養競爭,整個儲藏過程中木霉成為第一優勢菌,使得黃曲霉的數量大量銳減,從菌源就抑制了AFTB1量。在相對濕度75%的環境下,玉米的黃曲霉毒素的B1量隨黃曲霉的增多而增多,且最佳的產毒基質為初始含水量15.89%。
在溫度30℃相對濕度84%的環境不同含水量的玉米經過35 d的儲藏后(如表2),隨著玉米初始含水量增加,玉米的霉菌總量、黑曲霉、木霉、黃曲霉總量及黃曲霉毒素B1的積累量均有相同的變化趨勢,都在初始含水量14.30%取得最大值,且AFTB1的量是初始值的11.25倍。當玉米含水量大于14.30%時,雖然黃曲霉數量隨水分含量增加,但木霉量增加幅度更大,而AFTB1確呈減少趨勢,這可能因為木霉不僅通過營養競爭抑制黃曲霉數量,還能夠降解或吸附 AFB1[17]。
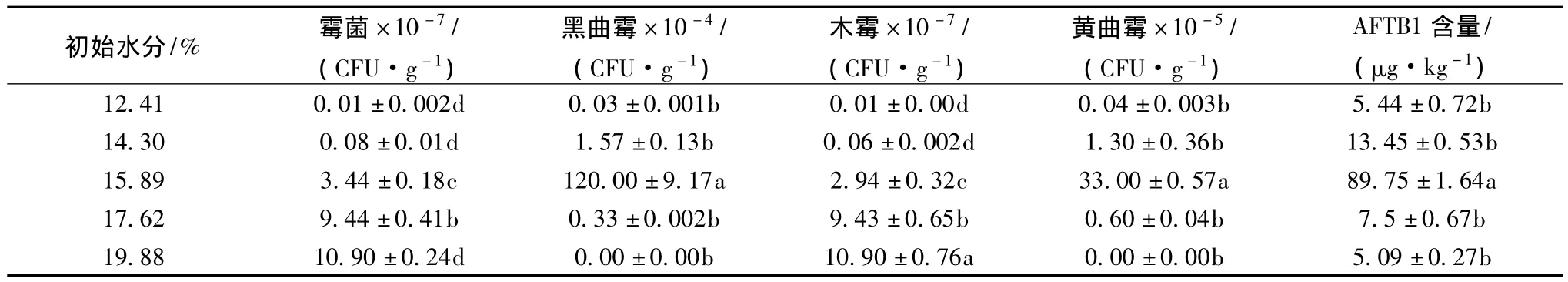
表1 RH 75%水分含量霉菌、木霉、黑曲霉、黃曲霉與AFTB1的量Table 1 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 75%environment
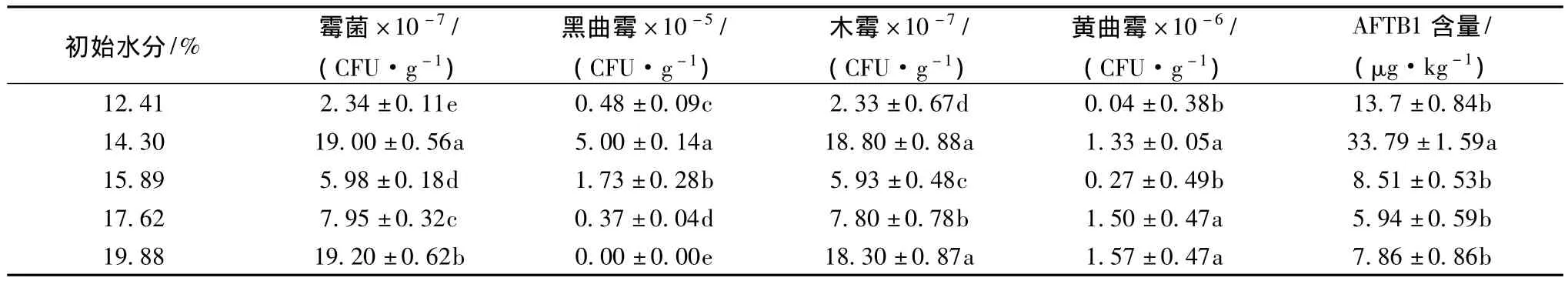
表2 RH 84%水分含量霉菌、木霉、黑曲霉、黃曲霉與AFTB1的量Table 2 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 84%environment
在相對濕度92%,溫度30℃的環境中(如表3),經過35 d的儲藏五組不同水分含量的玉米霉變比較嚴重,說明高濕環境更適合霉菌的生長,并且初始水分含量較大的17.62%、19.88%的兩組玉米中黃曲霉的量明顯高于初始含水量為15.89%的玉米,但是黃曲霉毒素B1的量卻遠遠小于初始含水量為15.89%的玉米。這可能因為,黑曲霉[18-19]和木霉[20]均能通過細胞壁吸附、產生某種降解AFTB1的物質和營養競爭作用等多種方式抑制了黃曲霉生長、產毒及增強了玉米上毒素的降解能力;也有可能,此環境條件不適合黃曲霉產毒。再者也進一步說明了,并不是黃曲霉的數量越多,產生毒素的量就越多,黃曲霉產毒是多種因素共同作用的結果。經單因素方差分析,各環境條件下不同含水量玉米,儲藏35 d后,微生物各指標與黃曲霉毒素B1均有顯著性差異(P <0.05)。
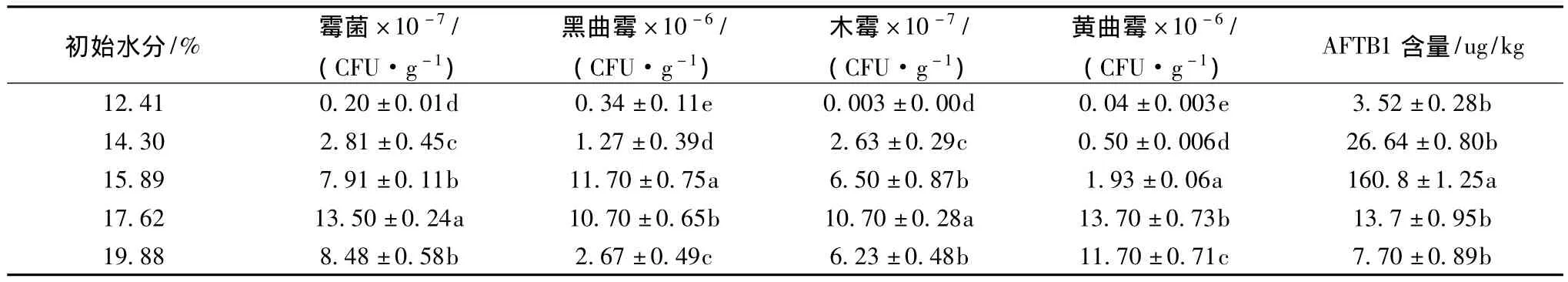
表3 RH 92%水分含量霉菌、木霉、黑曲霉、黃曲霉與AFTB1的量Table 3 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 92%environmen
2.4 相關性分析
相關性分析表明,經溫度30℃,相對濕度75%環境儲藏35 d的玉米,玉米上黃曲霉和黑曲霉總數均與黃曲霉毒素B1呈極顯著正相關性(P<0.001,k≥0.997);霉菌總數和木霉總數與黃曲霉毒素B1呈負相關性。在溫度30℃相對濕度84%環境下儲藏35 d的玉米,其黑曲霉總數與黃曲霉毒素B1呈顯著正相關性(P<0.05,k=0.921);霉菌總數、黃曲霉總數和木霉總數均與黃曲霉毒素B1呈正相關性,而玉米上的水分含量與黃曲霉毒素B1積累量呈明顯負相關性。經溫度30℃相對濕度92%環境下儲藏35 d后的玉米,其上黃曲霉總數和水分含量與黃曲霉毒素B1的積累量呈負相關性;霉菌總數、木霉總數和黑曲霉總數與黃曲霉毒素呈正相關性。
綜上3個不同的儲藏環境相關性的分析,在中、高濕度的環境,玉米上的黃曲霉毒素B1與黃曲霉間的相關性越來越不明顯,即受其他霉菌的影響越來越顯著。
3 結論
(1)不同儲藏環境下,玉米中霉菌的生長受環境濕度和玉米本身水分含量的雙重影響,隨著環境濕度和水分含量的增加,霉菌的數量也增加,但玉米本身水分含量對霉菌生長影響更顯著;玉米含水量變化不僅與玉米儲藏環境有關,還與微生物的量有一定的關系,玉米含水量最終表現形式是環境因素和生物因素綜合作用的結果。
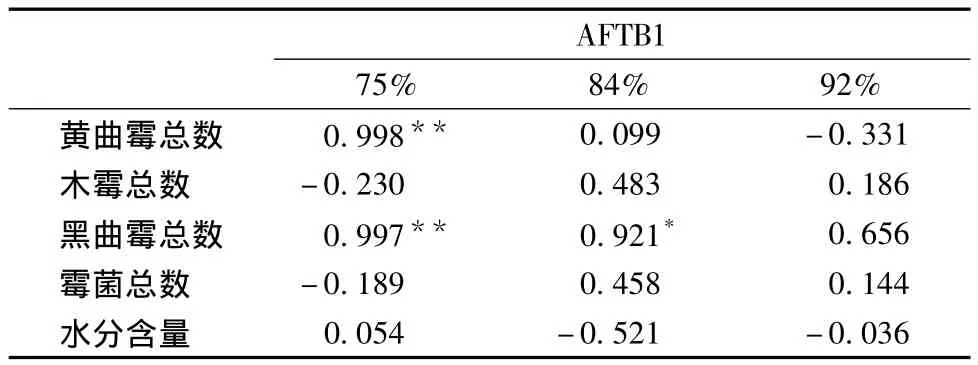
表4 AFTB1與黃曲霉、木霉、黑曲霉、霉菌及水分間相關性Table 4 The correlation among the aspergillusflavus、trichodermaviride、aspergillus Niger、mould、moisture andaflatoxin B1
(2)溫度30℃,相對濕度75%、84%、92%的條件下,玉米中最適黃曲霉的產毒的初始含水量分別是15.89%、14.30%、15.89%;整個儲藏過程中,木霉和黑曲霉都是優勢菌,通過協同抑制黃曲霉的生長并降解了部分黃曲霉毒素B1。
(3)相關性分析表明,在溫度30℃,相對濕度75%環境下,玉米上黃曲霉和黑曲霉總數均與黃曲霉毒素B1呈極顯著正相關性(P<0.001,k≥0.997),玉米上的木霉總數和霉菌總數與黃曲霉毒素B1量呈負相關;在溫度30℃相對濕度84%環境下,玉米上黑曲霉總數與黃曲霉毒素B1呈顯著正相關性(P<0.05,k=0.921);在溫度30℃,相對濕度92%環境下,玉米上黃曲霉數量和水分含量與AFTB1呈負相關性;在中、高濕度的環境,玉米上的黃曲霉毒素B1與黃曲霉間的相關性越來越不明顯,即受其他霉菌的影響越來越顯著。
[1] 劉笑然.中國玉米主產近況及近期走勢分析[J].飼料廣角,2001,17(17):8-13.
[2] 劉峰良,趙志輝,謝晶.谷物中真菌毒素的研究進展[J].廣東農業科學,2012,39(19):115-119.
[3] 蔡靜平,黃淑霞,張曉云,等.儀器法快速檢測儲糧霉菌的可靠性研究[J].糧食儲藏,2003,32(4):33-36.
[4] GB/T5009.23-2006.食品中黃曲霉毒素 B1、B2、G1、G2的測定[S].
[5] 劉嵐.糧油食品中黃曲霉毒素檢測方法[J].農產品加工·學刊,2010,9(4):66-67.
[6] Pitt J I,Christian J H.Water relations in xerophilic fungi isolated from prunes[J].Applied Microbiology,1968,16(12):1 853-1 858.
[7] Magan N,Lacey J.The effect of temperature and pH on water relations of field and storage fungi[J].Transactions of the British Mycological Society,1984,82(1):71-81.
[8] Ayerst G.The effects of moisture and temperature on growth and spore germination in some fungi[J].Journal of Stored Products Research,1969,5(6):127-141.
[9] 黃淑霞,蔡靜平,田海娟.主要糧食品種儲藏期間霉菌活動特性研究[J].中國糧油學報,2010,25(1):99-102.
[10] GB5497-1985.糧食、油料檢驗水分測定法[S].
[11] GB 4789.15-2010.食品安全國家標準食品微生物學檢驗霉菌和酵母計數[S].
[12] GB/T 4789.16-2003.食品衛生微生物學檢驗常見產毒霉菌的鑒定[S].
[13] 齊祖同.中國真菌志第五卷曲霉屬及相關有性型[M].上海:科學出版社,1997:76-80.
[14] 謝剛,王松雪,張艷.超高效液相色譜法快速檢測糧食中黃曲霉毒素的含量[J].分析化學,2013,41(2):223-228.
[15] 束旭強.糧食儲藏期間水分變化的探討[J].糧油倉儲科技通訊,2004,20(5):52-54.
[16] 魏金濤,齊德生.飼料水分活度及其對霉菌生長和產毒的影響[J].飼料工業,2005,26(19):53-55.
[17] Petchkongkaew A,Tailandier P,Gasaluck P,et al.Isolation of Bacillus spp.from Thai fermented soybean(Thuanao):screening foraflatoxin B1 and ochratoxin A detoxification[J].Journal of Applied Microbiology,2008,104(5):1 495-1 502.
[18] 李冰,董征英,常維山.黑曲霉對黃曲霉毒素B1的降解與應用研究[J].飼料博覽,2012,25(11):6-10.
[19] 徐丹,秀蘭,永仙,等.黑曲霉對黃曲霉生長、產毒及黃曲霉毒素B1的影響[J].中國微生態學雜志,2011,23(6):490-496.
[20] 宋曉妍,孫彩云,陳秀蘭,等.木霉生防作用機制的研究進展[J].中國農業科技導報,2006,8(6):20-25.

