南極假絲酵母脂肪酶B在畢赤酵母中的分泌型表達及酶學性質初探
李 迅, 鄧若冰, 王 飛*
(1.南京林業大學化學工程學院,江蘇南京210037;2.江蘇省生物質綠色燃料與化學品重點實驗室,江蘇南京210037)
隨著傳統化學合成工藝帶來的負面影響越來越受到人們重視,人類迫切需要找到綠色工藝來取代現有的工藝,以減少對環境的破壞.以生物酶類為催化劑的合成工藝可以很好地克服化學工藝的高能耗及高污染的缺陷,同時還具有選擇性專一等特點,目前已應用于有機合成、手性化合物拆分和醫藥中間體等領域.脂肪酶(Lipase,EC 3.1.1.3),也稱羧酸酯酶(carboxylesterases),它催化長鏈脂酰甘油水解為甘油、游離脂肪酸和單、雙甘油酯[1].
南極假絲酵母脂肪酶B(CALB),是一種優良的脂肪酶,CALB為催化劑的合成工藝具有低能耗、無污染、轉化率高、選擇性專一等優點,CALB沒有界面活性[2],有極強的立體選擇性,且具有廣譜的底物接受性,對非水溶性和水溶性物質都有很強的催化活性[3-5],因此具有很高的潛在工業價值,廣泛應用于有機合成、手性化合物拆分和醫藥中間體等領域[6-10].但商業化的CALB價格昂貴,如諾維信公司生產的Novozyme 435價格在300元/g左右,限制了其在工業化大規模生產中的應用.目前,CALB基因已成功被克隆,并在米曲霉(Aspergillus oryae)[11]、大腸桿菌(Escherichia coli)[12]、畢赤酵母(Pichia pastoris)[13]、釀酒酵母 (Saccharomyces cerevisiae)[14]等宿主菌中實現表達,但 CALB在大腸桿菌中表達無法正確后修飾,其大多為包涵體[12],而在釀酒酵母中容易過度糖基化而影響CALB活力[15].而巴斯德畢赤酵母表達系統除了菌體生長速度快,表達量高,遺傳穩定性好,分泌效率高等特點,而且自身分泌的蛋白較少,減少了分離純化的成本[16],本研究將 CALB基因克隆至載體pPICZ A和pGAPZ A中,轉至KM71H中,篩選獲得高效表達CALB的酵母工程菌株,并對重組酶的酶學性質進行初步分析.
1 材料與方法
1.1 材料
1.1.1 菌株和質粒 南極假絲酵母(C.antarctica,NRRL No.Y-7954)來源于美國農業研究菌種保藏中心.大腸桿菌(E.coli)DH5,畢赤酵母(P.pastoris)KM71H和質粒pPICZαA和pGAPZαA購自Invitrogen(Carlsbad,California,USA)公司.引物由上海生工生物工程有限公司合成.
1.1.2 試劑與儀器 對硝基苯酚辛酸酯(pNPO,4-nitrophenyl octanoate),RNase A,氨芐青霉素(Amp)購自Sigma公司;Ex-Taq聚合酶,DNA ATailing試劑盒,限制性內切酶等購自TaKaRa公司;PCR純化、低分子量標準蛋白質和提質粒試劑盒購自BIOMIGA公司;Yeast extract,Peptone購自 Oxoid公司.其余生化試劑和藥品均為分析純.
1.1.3 培養基 LB培養基、YPD和YPDS培養基等參考Invitrogen公司的畢赤酵母表達手冊.
1.2 方法
1.2.1 載體構建及酵母電轉化 抽提南極假絲酵母的基因組DNA,以此為PCR模板,參照GeneBank上發表的南極假絲酵母脂肪酶B基因序列(Gene-Bank登錄號:Z30645)設計兩端特異性引物,上游引物:5'-CCCGAATTCGCCACTCCTTTGGTGAAGC-3’(斜線為EcoRI酶切位點);下游引物:5'-CCCGGTACCTCAGGGGGTGACGATGCCGGAGCAG-3’(斜線為KpnI酶切位點).(采用PCR方法擴增獲得目的基因calb)PCR產物經EcoRI和KpnI雙酶切后連入pPICZαA和pGAPZαA,獲得重組載體 pPICZαA-CALB 和 pGAPZαA-CALB.重組質粒經Sac I線性化后電激整合入畢赤酵母KM71H細胞基因組中,涂布含抗生素Zeocin 100 μg/mL的YPDS平板,30℃培養48 h后,挑取單菌落于YPD培養基中進行培養.
1.2.2 CALB重組工程菌的篩選和表達 挑取單菌落接種于含體積分數5%三辛酸甘油酯的YNB為基礎培養基的平板上,30℃培養箱中培養3 d以上,并每天補充100 μL甲醇至平板蓋上,觀察并選取水解圈較大的重組子接種于YPD培養基中培養,用于后續進一步誘導表達.
以pPICZ A為表達載體的畢赤酵母工程菌表達過程如下:用滅菌的竹簽挑取單菌落接種于含25 mL BMGY培養基的250 mL搖瓶中,30℃、200 r/min培養至OD600為2~6,約24 h,嚴格無菌操作.在8 000 r/min下離心5 min,棄上清,將菌轉入新鮮的BMMY培養基中,至OD600約為1.0,嚴格無菌操作,30℃、200 r/min恒溫搖床培養96 h,每24 h添加一次甲醇至終體積分數為0.5%.12 000 r/min離心5 min,發酵液上清液即為粗酶液.
以pGAPZαA為表達載體的畢赤酵母工程菌表達過程如下:挑取鑒定正確的陽性單菌落至含有50 mL YPD液體培養基的250 mL錐形瓶中,在30℃和 250 r/min的條件下振蕩培養 96 h,12 000 r/min離心5 min,發酵液上清即為粗酶液.
1.2.3 CALB的高密度發酵 將篩選得到的高產脂肪酶基因工程菌挑取單菌落接種于BMGY培養基中搖瓶培養,再轉接至大瓶BMGY培養基中培養,并作為發酵罐種子液.將種子液接種于發酵罐中,控制溶氧值DO為35%,自動流加氨水維持pH值為8.0,發酵24 h左右基礎培養基碳源耗盡,DO迅速上升至90%,此時以40%的流速恒速補加甘油,直到工程菌OD600達到200,停止補加甘油.待甘油停加2 h后,開始進入甲醇誘導階段,5 mL/h的速度流加甲醇,每小時以10%遞增速度補加甲醇,直到10 mL/h的速度,維持此流加速度.培養至84 h.
1.2.4 測定方法 以pNPO為底物的分光光度法測定脂肪酶酶活.取100 μL適宜質量濃度的酶液(質量濃度控制在所測吸光度為0.1~1之間)和850 μL 的0.05 mol/L Tris·HCl(pH7.5)緩沖液混合,空白樣則用緩沖液代替酶液的體積,預熱5 min,加入50 μL 13.5 mmol/L pNPO 作為底物,在40℃準確反應5 min后,立即加入100 μL異丙醇終止反應.將反應液13 000 r/min離心5 min,取上清,在410 nm處測吸光值.一個酶活單位(U)定義為在pH7.5、40℃條件下,每分鐘釋放1 mol對硝基苯酚(pNP)所需要的酶量.蛋白質量濃度的測定方法采用 Bradford 法[17].
1.3 酶學性質測定
1.3.1 最適溫度和溫度穩定性 分別在20、30、40、50、60和70℃下測定pNPO酶活,以確定重組CALB的最適反應溫度.將適宜質量濃度酶液分別放在30、40、55和60℃下保溫2 h測定 pNPO酶活,依次在 20、40、60、80、100 和120 min 取樣,以確定重組 CALB的溫度穩定性.將所取酶樣按照1.2.4方法測定 pNPO酶活,酶活測定條件均為pH8.0和40℃,每個樣品重復3次.
1.3.2 最適pH值和pH穩定性 分別在pH值為5~10的0.05 mol/L Tris-HCl緩沖液下測定pNPO酶活,以確定CALB的最適反應pH值.將酶液分別在不同pH的0.1 mol/L緩沖液(pH6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5 和 10.0)中 16 ℃條件下放置1 h后,在40℃,pH8.0的條件下按照1.2.4方法測定pNPO酶活,以測定CALB的pH穩定性,每個樣品重復3次.
1.3.3 金屬離子和表面活性劑對重組脂肪酶的影響將酶與不同的金屬離子(Cu2+、Zn2+、Ca2+、Mg2+、Mn2+、Ni+、Ba2+和 Co2+,5 mmol/L;體積分數0.1%SDS和0.05%Triton-X100)混合后常溫放置1 h,然后取樣在pH8.0值為和40℃條件下按照1.2.4方法測定pNPO酶活,對照樣不加添加劑,其他條件相同,每個樣品重復3次.
2 結果與分析
2.1 重組載體的構建 以南極假絲酵母NRRL Y-7954基因組DNA為模板,PCR擴增得到CALB成熟肽編碼序列,PCR產物經EcoR I和Kpn I雙酶切后連入 pPICZ A和 pGAPZ A,獲得重組載體pPICZ A-CALB和pGAPZ A-CALB.重組質粒經雙酶切(EcoR I和Kpn I)鑒定正確(圖1)后轉入畢赤酵母KM71H中表達.
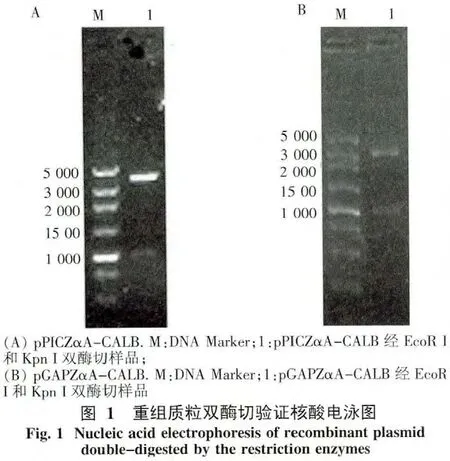
2.2 啟動子對重組CALB表達的影響 對比不同質粒pPICZαA(啟動子為 AOX)和 pGAPZαA(啟動子為GAP)對CALB基因在畢赤酵母中表達的影響,結果顯示,以AOX啟動子型的重組菌較GAP啟動子型的重組菌具有更高的表達量和酶活,pPICZαA-CALB+KM71H重組菌培養4 d后酶活達11.11 U/mL,蛋白質量濃度為0.45 mg/mL,較原始菌中脂肪酶酶活(2.56 U/mL)高四倍多.而pGAPZαA-CALB+KM71H重組菌培養4 d后酶活僅為0.52 U/mL,蛋白質量濃度為0.020 mg/mL因此,選擇AOX啟動子型的重組菌(pPICZαA-CALB+KM71H重組菌)進行后續的研究(見圖2).

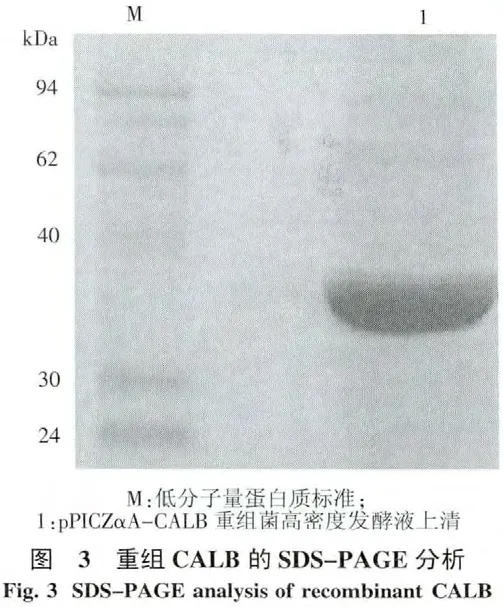
2.3 CALB的篩選和高密度發酵 挑選三丁酸甘油脂平板中有較大水解圈的重組菌,將菌體保存于-80℃含有體積分數15%甘油的YPD管中,并對這些重組菌進行搖瓶發酵,測定脂肪酶活力,其中pPICZαA-CALB重組菌產脂肪酶酶活最高為42.90 U/mL,蛋白質質量濃度為0.51 mg/mL,比酶活為83.79 U/mg,較未篩選之前(見2.2)有大幅提高,并且酶活高于相關文獻報道[15,18].選擇該菌株進行高密度發酵,培養至84 h,發酵液酶活可達179.19 U/mL,蛋白質質量濃度為1.36 mg/mL,SDS-PAGE蛋白電泳分析如圖3,顯示重組蛋白亞基為37 kDa,且目的蛋白的條帶相對單一,可進行下一步脂肪酶酶學定性.
2.4 酶學性質測定
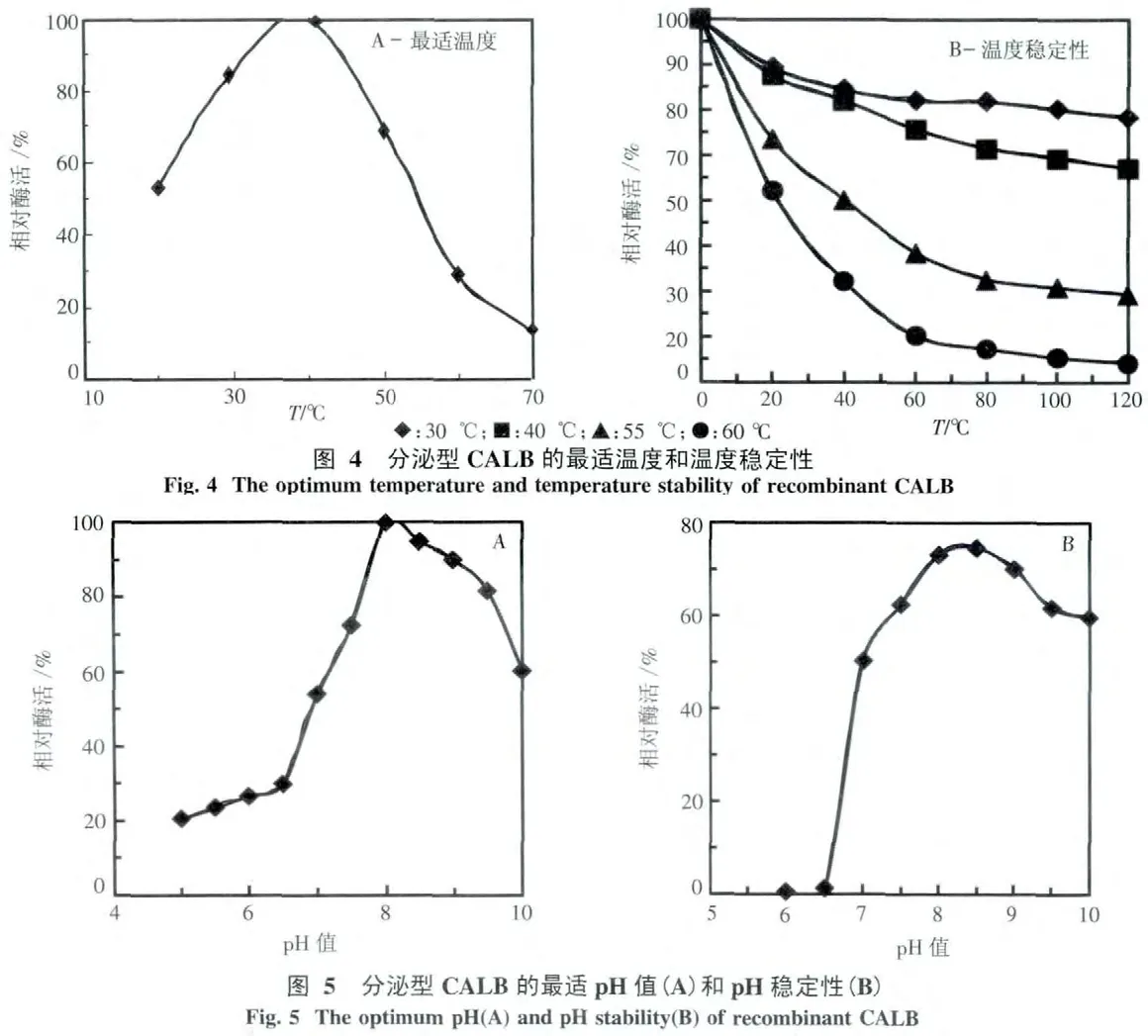
2.4.1 最適溫度和溫度穩定性 如圖4(A)所示,CALB在40℃時酶活達到最大.在30~40℃范圍內,保溫60 min,重組CALB酶活都能保持70%以上,在55℃時,CALB酶活降低較快,保溫60 min后殘余CALB酶活為未保溫樣品的48.5%.可認為,該酶在在30~55℃范圍內,能保持較高的反應活性,也有較好的溫度穩定性.
2.4.2 最適pH值和pH穩定性 如圖5所示,CALB在弱堿環境具有較好的活性,在pH值為8.0時,活性最高.在酸性條件下,酶活都低于最高酶活的30%.CALB的pH穩定性結果如圖5(B)所示.在pH7.5~9.5之間的緩沖液中處理1 h后仍保持60%以上的水解活力,pH8.5時酶的穩定性最大,之后酶的穩定性呈下降趨勢.該酶在酸性條件下穩定性較差,在pH為6.5以下保溫1 h后基本測不到酶活.由此表明,CALB在弱堿性條件下具有較好的穩定性.
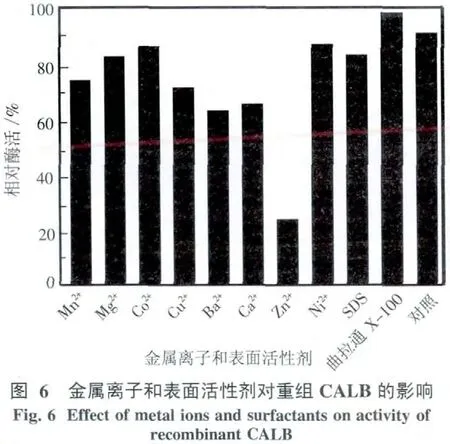
2.4.3 金屬離子和表面活性劑的影響 不同的金屬離子和表面活性劑對重組CALB的影響結果如圖6所示,發現Zn2+對CALB的抑制作用最強,CALB酶活為未加金屬離子樣品的26.1%.Mg2+、Ni+、Co2+對酶活幾乎沒有影響;在 Ca2+、Mn2+、Cu2+、Ba2+的作用下,脂肪酶的酶活都有較多的下降.非離子表明活性劑 Triton X-100(體積分數0.05%)可提高CALB的活性,而陰離子表面活性劑SDS(體積分數0.1%)對CALB的活性略有抑制作用.
3 結論
但由于CALB的高成本難以實現工業應用,本研究克隆CALB基因至畢赤酵母中進行分泌型表達,通過活性平板篩選和高密度發酵,無需經過純化步驟即得到較高純度的重組CALB,較高純度的重組CALB比酶活達到131.8 U/mg.重組CALB最適反應溫度為40℃,最適pH值為8.0,重組CALB在55℃范圍內保溫1 h,仍能保持48.5%的活力,重組的CALB在pH7.5~9.5之間的溶液中比較穩定,發現Zn2+對CALB有強烈的抑制作用;Mg2+、Ni+和Co2+對酶活幾乎沒有影響;非離子表明活性劑Triton X-100可提高CALB的活性,而陰離子表面活性劑SDS對CALB的活性略有抑制作用.此結果與孫金鵬等[13]的研究結果差異較大,分析是和酶活測定方法不同有關,也可能和CALB基因來源的菌株不同有關.后續研究會利用大孔樹脂等材料對CALB進行固定化研究,有望進一步降低CALB的使用成本.
[1]粟慧君,馬駿,蔡莉,等.合成有機載體固定化豬胰脂肪酶性質研究[J].四川師范大學學報:自然科學版,2008,31(5):586-589.
[2]Uppenberg J,Hansen M T,Patkar S,et al.The sequence,crystal structure determination and refinement of two crystal forms of lipase B from Candida antarctica[J].Structure,1994,2:293-308.
[3]Kirk O,Christensen M W.Lipases from Candida antarctica:unique biocatalysts from a unique origin[J].Organic Process Research & Development,2002,6(4):446-451.
[4]Senanayake S P J N,Shahidi F.Incorporation of docosahexaenoic acid(DHA)into evening primrose(Oenothera biennis L)oil via lipase-catalyzed transesterification[J].Food Chemistry,2004,85(4):489-496.
[5]Sivalingam G,Chattopadhyay S,Madras G.Enzymatic degradation of poly(ε -caprolactone),poly(vinylacetate)and their blends by lipases[J].Chemical Engineering Science,2003,58(13):2911-2919.
[6]Rodriguez J M,Roura E,Contreras E.Biosynthesis of ethylbutyrate using immobilized lipase:a statistical approach[J].Process Biochemistry,2005,40(1):63-68.
[7]Monteiro C M,Lourenco N M,Afonsoo C A.Separation of secondary alcohols via enzymatic kinetic resolution using fatty esters as reusable acylating agents[J].Tetrahedron:Asymmetry,2010,21:952-956.
[8]De Gonzalo G,Brieva R,Sánchez V M,et al.Enzymatic resolution of trans-4-(4'-fluorophenyl)-3-hydroxymethylpiperidines,key intermediates in the synthesis of(-)-paroxetine[J].J Organic Chem,2001,66(26):8947-8953.
[9]Barbosa O,Ortiz C,Torres R,et al.Effect of the immobilization protocol on the properties of lipase B from Candida Antarctica in organic media:Enantiospecific production of atenolol acetate[J].J Mol Catalysis B:Enzymatic,2011,71(3/4):124-132.
[10]Jun C,BW J,Joo J C,et al.Thermostabilization of Candida antarctica lipase B by double immobilization:Adsorption on a macroporous polyacrylate carrier and R1silaffin-mediated biosilicification[J].Proc Biochem,2013,48(8):1181-1187.
[11]Hoegh I,Patkar S,Halkier T,et al.Two lipases from Candida antarctica:cloning and expression in Aspergillus oryzae[J].Canadian J Botany,1995,73(S1):869-875.
[12]Liu D,Schmid R D,Rusnak M.Functional expression of Candida antarctica lipase B in the Escherichia coli cytoplasm-a screening system for a frequently used biocatalyst[J].Applied Microbiology and Biotechnology,2006,72:1024-1032.
[13]孫金鵬,錢圣一,敬科舉,等.南極假絲酵母脂肪酶B在畢赤酵母的表達及酶學性質研究[J].廈門大學學報:自然科學版,2011,50(4):765-771.
[14]Han S Y,Pan Z Y,Huang D F,et al.Highly efficient synthesis of ethyl hexanoate catalyzed by CALB-displaying Saccharomyces cerevisiae whole-cells in non-aqueous phase[J].J Molecular Catalysis B:Enzymatic,2009,59(1/3):168-172.
[15] Kato M,Fuchimoto J,Tanino T,et al.Preparation of a whole-cell biocatalyst of mutated Candida antarctica lipase B(mCALB)by a yeast molecular display system and its practical properties[J].Appl Microbiology Biotechnology,2007,75(3):549-555.
[16]Sue M P,Mariana L F,Brian M N,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[17]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-Dye binding[J].Analytical Biochemistry,1976,72:248-254.
[18]李燕妮,衣婷婷,李龍森.南極假絲酵母脂肪酶在15 L發酵罐中培養條件的研究[J].化學與生物工程,2007,24(7):43-48.

