內嗎啡肽在大鼠視網膜上的表達
張樂石 李志方 劉力學 薛偉寧 樊雙義
基礎研究論著
內嗎啡肽在大鼠視網膜上的表達
張樂石 李志方 劉力學 薛偉寧 樊雙義
目的 探討內嗎啡肽在視網膜的分布,內嗎啡肽和μ阿片受體在視網膜的共存關系。方法 成年雄性SD大鼠12只,分為2組,一組為正常對照組(n=6),另一組建立高眼壓模型(高眼壓模型組,n=6)。運用免疫組織化學方法觀察內嗎啡肽1(EM-1)、內嗎啡肽2(EM-2)和μ阿片受體在視網膜中的分布和共存,并利用高眼壓模型觀察高眼壓對EM-2在視網膜表達的影響。結果視網膜無EM-1分布;EM-2主要分布于視網膜節細胞層;EM-2與NeuN、μ阿片受體在視網膜節細胞層共存;高眼壓模型大鼠視網膜節細胞層內單位面積表達EM-2的細胞數明顯少于正常大鼠(0.8± 0.1個/mm3vs.4.6±0.8個/mm3),差異有統計學意義(t=3.88,P<0.05)。結論 EM-2分布在視網膜節細胞層,與μ阿片受體共存,在高眼壓狀態下,EM-2的表達減少。
內嗎啡肽;視網膜;高眼壓;分布
內嗎啡肽是內源性阿片肽家族的一個成員,是1997年Zadina等[1]在牛腦中發現,對μ阿片受體具有高選擇性的、強效的內源性配體。內嗎啡肽是一個四肽,氨基酸殘基序列為Tyr-Pro-Trp-Phe-NH2 或Tyr-Pro-Phe-Phe-NH2,分別命名為內嗎啡肽1 (EM-1)和內嗎啡肽2(EM-2)[2]。內嗎啡肽在鎮痛、心血管功能調節、呼吸功能調節以及消化功能調節都具有一定的作用,近期有文獻報道在腸神經系統中發現內嗎啡肽能神經元的分布,但內嗎啡肽在視網膜的分布尚未見報道。脊椎動物的視網膜是一個復雜的、具有重要感知功能的組織,鈣結合蛋白D-28k、鈣視網膜蛋白、一氧化氮合酶等表達于哺乳動物視網膜,近期有文獻報道內源性阿片肽家族的另一成員——腦啡肽在視網膜有表達,并與感光關系密切[3]。本文擬研究內嗎啡肽在視網膜的分布,現將結果報告如下。
材料與方法
一、材料
成年雄性SD大鼠12只,購自第四軍醫大學實驗動物中心,分為2組,每組6只大鼠,一組為正常對照組,另一組建立高眼壓模型。藥品與試劑:兔抗EM-1多克隆抗體(1∶200 Abcam);兔抗EM-2多克隆抗體(1∶200 Abcam);小鼠抗NeuN多克隆抗體(1∶500 millipore);生物素標記的驢抗兔多克隆抗體(1∶500 chemion);Alexa594標記的羊抗小鼠多克隆抗體(1∶500 Invitrogen);FITC標記的生物素(1∶1 000 Vector)。
二、方法
1.麻醉及高眼壓模型建立
大鼠經7%水合氯醛(0.4 ml/kg)腹腔注射麻醉后,俯臥位固定在手術臺上,利多卡因滴眼。以一次性輸液器連接4.5號針頭經角膜緣刺入前房,接500 ml生理鹽水,距大鼠垂直距離為1.5 m,保持60 min。右眼以針頭刺穿行假手術。7 d后處死取材。
2.取 材
25%烏拉坦(1ml/kg)腹腔注射麻醉,開胸經左心室穿刺入升主動脈,先灌入200 ml 0.01 mol/L PBS沖凈血液,再用含4%多聚甲醛的磷酸緩沖液(PB)500 ml灌注固定,取雙側眼球,放入上述溶液后固定24 h。
3.染 色
用恒冷箱切片機對眼球進行冠狀位冰凍切片,片厚12 μm,隔2張取1張,切片立即貼于經載膠處理的載玻片上。第1組第1套切片用于EM-1/EM-2單標記的免疫組織化學染色,步驟如下:①兔抗EM-1多克隆抗體(1∶200 Abcam)/兔抗EM-2多克隆抗體(1∶200 Abcam)4℃孵育72h;②加入Biotin標記的驢抗兔多克隆抗體(1∶200,Millipore),室溫孵育4 h;③加入ABC復合物(1∶200,Vector),室溫孵育2 h,DAB呈色10 min。將經過上述處理的切片室溫干燥后用中性樹膠封片,使用明視野顯微鏡觀察。
第1組第2套、第2組第1套切片用于EM-2/MOR雙標的免疫熒光組織化學染色,步驟如下:①兔抗EM-2多克隆抗體+小鼠抗MOR(1∶200,Abcam)4℃孵育72 h;②生物素標記的驢抗兔多克隆抗體(1∶500 chemion)+Alexa594標記的羊抗小鼠多克隆抗體(1∶500 Invitrogen),室溫孵育4 h;③FITC標記的生物素(1∶1 000 Vector),室溫孵育2 h。
第1組第3套、第2組第2套切片用于EM-2/NeuN雙標的免疫熒光組織化學染色,步驟如下:①兔抗EM-2多克隆抗體+小鼠抗NeuN多克隆抗體(1∶500,Millipore)4℃孵育72 h;②生物素標記的驢抗兔多克隆抗體(1∶500 chemion)+Alexa594標記的羊抗小鼠多克隆抗體(1∶500 Invitrogen),室溫孵育4 h;③FITC標記的生物素(1∶1 000 Vector),室溫孵育2 h。
上述各步驟之間均用0.01 mol/L的PBS (pH7.3)洗片3次,每次10 min。所有上述一抗和二抗均用含5%驢血清、0.3%Triton X2100、0.25%角叉菜膠和0.05%疊氮化鈉的0.01 mol/L PBS(pH7.3)稀釋。將經過上述處理的切片經室溫干燥,以2.5%三乙烯二胺和等量甘油的混合液封片,激光掃描共聚焦顯微鏡(FV1000,Olympus)觀察。同時以正常羊血清代替一抗孵育第2套切片,其余染色步驟與上相同進行陰性對照實驗,結果均為陰性。
4.細胞計數
每個標本取5個獨立視野(×600),計算每個獨立視野內的陽性細胞數,取平均值作為該標本單位面積內的陽性細胞數。
三、統計學處理
采用SPSS 12.0統計學軟件對數據進行統計分析,計量資料以±s表示,組間比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
結 果
一、內嗎啡肽在正常大鼠視網膜上的分布
免疫組織化學染色顯示,未見EM-1陽性產物在視網膜上的分布(圖1A,×20),EM-2陽性產物分布在視網膜節細胞層(GCL)神經細胞胞體[圖1 B(×20)、C(×100)],且EM-2與NeuN(圖2)、μ阿片受體(圖3)在視網膜上的共存。
二、內嗎啡肽在高眼壓模型大鼠視網膜上的分布
對大鼠眼前房行高眼壓處理后,視網膜節細胞層水腫且結構松散,行NeuN染色見神經細胞數量無明顯減少,而在EM-2在視網膜節細胞層的表達減少(圖4)。正常大鼠視網膜節細胞層單位面積EM-2陽性細胞數平均為4.6±0.8個/mm3,高眼壓模型大鼠視網膜節細胞層單位面積EM-2陽性細胞數平均為0.8±0.1個/mm3(表1)。高眼壓模型大鼠視網膜節細胞層內單位面積表達EM-2的細胞數明顯少于正常大鼠,差異有統計學意義(t=3.88,P<0.05)。
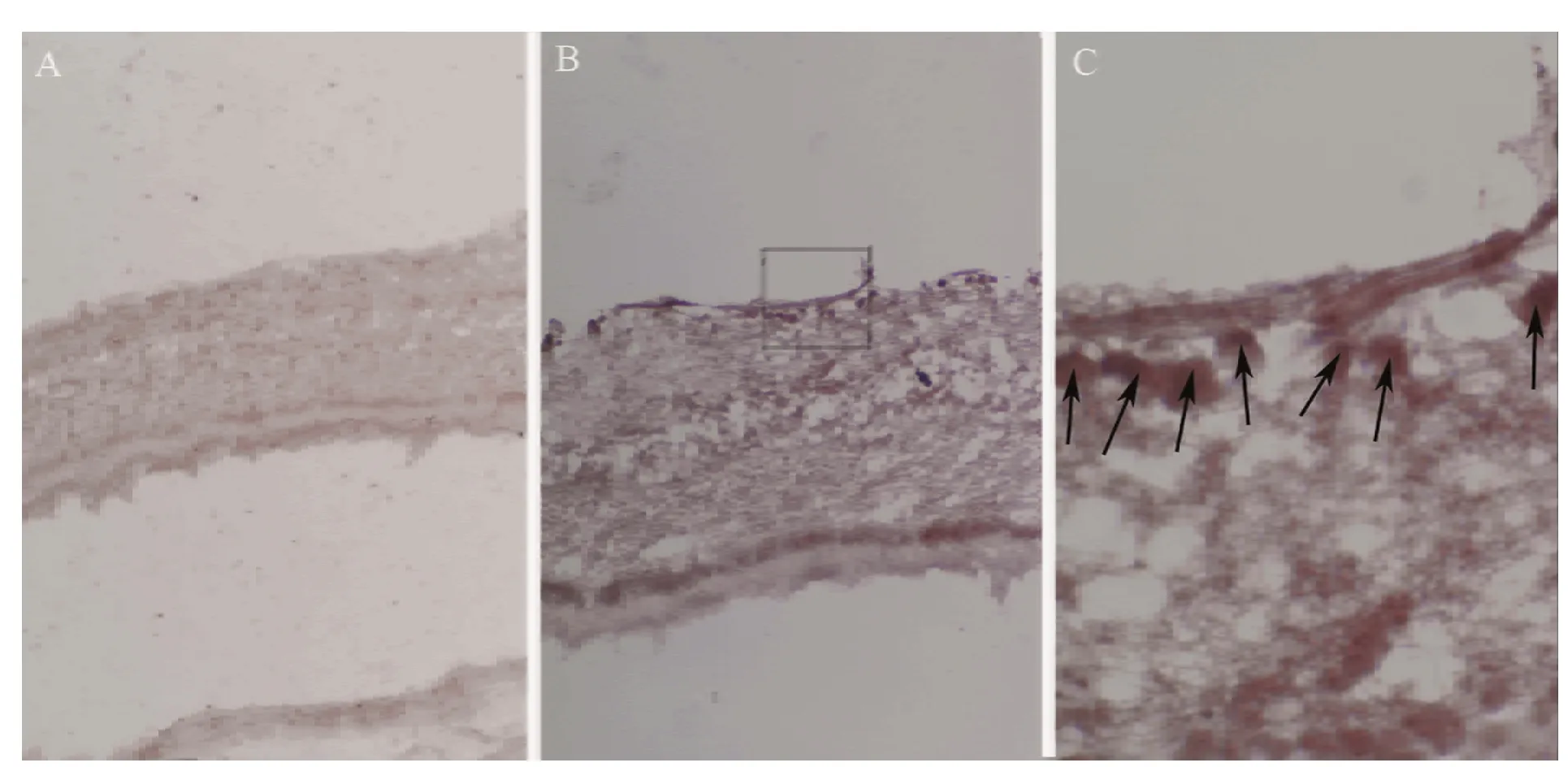
圖1 EM-1、EM-2陽性產物在小鼠視網膜上的分布
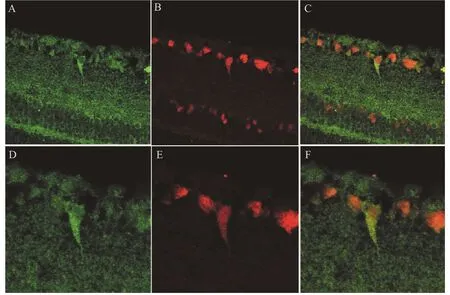
圖2 EM-2免疫陽性產物與NeuN在小鼠視網膜節細胞層的共存
表1 高眼壓組和正常對照組視網膜節細胞層EM-2陽性細胞數(±s,n=6)

表1 高眼壓組和正常對照組視網膜節細胞層EM-2陽性細胞數(±s,n=6)
組 別大鼠1大鼠2大鼠3大鼠4大鼠5大鼠6高眼壓組0.6±0.10.2±0.11.3±0.20.7±0.10.8±0.21.2±0.1正常對照組7.2±1.23.9±0.85.4±0.55.0±1.52.2±0.33.9±0.6
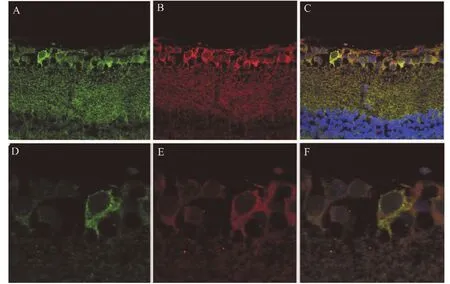
圖3 EM-2免疫陽性產物與μ阿片受體在小鼠視網膜節細胞層的共存

圖4 高眼壓處理后7 d的小鼠視網膜節細胞層
討 論
內嗎啡肽主要分布在中樞神經系統,與μ阿片受體分布相似,但EM-1和EM-2的分布并不相同。EM-1在腦部的分布比EM-2密集而廣泛,主要分布于孤束核、臂旁核、隔區、斜角帶、終紋床核、韁核、丘腦腹后內側核、下丘腦后核、導水管周圍灰質(PAG)、藍斑、伏核、杏仁核及運動性語言中樞等部位;EM-2在脊髓的分布比EM-1更為廣泛,主要分布于脊髓背角的小直徑初級傳入神經、脊髓背角淺神經層、背根及三叉神經脊束核。它也出現于腦中富有阿片受體的區域:伏核、丘腦中央中核、隔區、下丘腦和杏仁核、藍斑和PAG,但在大腦皮質、紋狀體、海馬、孤束核和背根神經節上分布很少[4]。EM-2樣免疫反應纖維和膨體在脊髓膠狀質和邊緣系統的分布與腦啡肽、強啡肽相似,與P物質則共存于三叉神經脊束核,從而提示它在痛覺調節中起重要作用[5]。EM-1及EM-2于在體實驗中均表現出較強的鎮痛作用[6]。
研究結果顯示,在視網膜上只有EM-2表達,無EM-1表達,EM-2陽性神經元分布在節細胞層,且與神經元特異性標記NeuN及μ阿片受體共存。視網膜內的細胞根據其形態、功能不同,分為無長突細胞、水平細胞、雙極細胞、節細胞、感光細胞等。根據視網膜內EM-2陽性神經元的形態可判定其屬于節細胞。
在高眼壓模型大鼠視網膜上,EM-2陽性細胞的表達明顯減少,提示EM-2在青光眼的發生發展中起到一定的作用。
致視網膜損傷的病理基礎是視網膜節細胞的進行性死亡。臨床研究結果證實,盡管許多青光眼患者的眼壓已得到控制,但視野和視神經損害仍繼續發展,有時將導致視力完全喪失[7]。既往研究顯示,內源性阿片肽對神經細胞、心肌缺血具有保護作用,當心肌缺血時,心臟通過自身分泌或者旁分泌內源性阿片肽,并作用于心肌上的阿片受體,發揮重要的心肌保護作用[8-9]。阿片受體激動劑通過改善神經細胞供血、減輕細胞水腫、降低TNF-α表達、減輕炎癥反應等途徑起到缺血保護作用[10-11]。內源性阿片肽可激活磷酸肌醇3-激酶通路、減少氧自由基形成、抑制神經細胞凋亡[12]。而在高眼壓模型上視網膜節細胞層的EM-2表達減少,提示內源性阿片肽在視網膜上可能起到缺血保護的作用,EM-2的表達減少是高眼壓造成視網膜持續性損害的可能機制。進行外源性阿片肽預處理可能能夠減輕高眼壓對視網膜的持續損害,但需要進一步研究證明。
[1]Zadina JE,Hackler L,Ge LJ,et al.A potent and selective endogenous agonist for the mu-opiate receptor. Nature,1997,386:499-502.
[2]Gong J,Strong JA,Zhang S,et al.Endomorphins fully activate a cloned human mu opioid receptor.FEBS Lett,1998,439:152-156.
[3]韓蕊,黃靜,陳晶,等.ENK與CaBPs在PPE-GFP轉基因小鼠視網膜細胞中的共存.神經解剖學雜志,2010,26:37-41.
[4]Schreff M,Schulz S,Wiborny D,et al.Immunofluorescent identification of endomorphin-2-containing nerve fibers and terminals in the rat brain and spinal cord.Neuroreport,1998,9:1031-1034.
[5]Moody TW,Miller MJ,Mártinez A,et al.Adrenomedullin binds with high affinity,elevates cyclic AMP,and stimulates c-fos mRNA in C6 glioma cells. Peptides,1997,18:1111-1115.
[6]Tseng LF,Narita M,Suganuma C,et al.Differential antinociceptive effects of endomorphin-1 and endomorphin-2 in the mouse.J Pharmacol Exp Ther,2000,292:576-583.
[7]Liu Y,Allingham RR.Molecular genetics in glaucoma. Exp Eye Res,2011,93:331-339.
[8]Chaturvedi K,Christoffers KH,Singh K,et al.Structure and regulation of opioid receptors.Biopolymers,2000,55:334-346.
[9]Tanaka K,Kersten JR,Riess ML.Opioid-induced cardioprotection.CurrPharmDes,2014,20:5696-5705.
[10]Chi OZ,Hunter C,Liu X,et al.Effects of fentanyl pretreatment on regional cerebral blood flow in focal cerebral ischemia in rats.Pharmacology,2010,85:153-157.
[11]Jeong S,Kim SJ,Jeong C,et al.Neuroprotective effects of remifentanil against transient focal cerebral ischemia in rats.J Neurosurg Anesthesiol,2012,24:51-57.
[12]Pateliya BB,Singh N,Jaggi AS.Possible role of opioids and KATP channels in neuroprotective effect of postconditioning in mice.Biol Pharm Bull,2008,31:1755-1760.
Expression of endomorphins in the retina of rat
Zhang Leshi,Li Zhifang,Liu Lixue,Xue Weining,Fan Shuangyi.Department of Neurology,Affiliated Hospital of Military Medical Sciences,Beijing 100071,China Corresponding author,Zhang Leshi,E-mail:zlsfmmu@163.com
Objective To investigate the distribution of endomorphins(EM)in the retina,and assess the coexistence of EM and μ-opioid receptor in the retina.Methods Twelve Sprague Dawley(SD)rats were divided into the control(n=6)and intraocular hypertension model groups(n=6).Immunohistochemistry was used to detect the expression and coexistence of EM-1,EM-2 and μ-opioid receptor in the rat retina,and evaluate the influence of intraocular hypertension upon the expression of EM-2.Results EM-1 was not expressed in the retina.EM-2 was mainly distributed in the retinal ganglion cell layer.EM-2,NeuN and μopioid receptor coexisted in the retinal ganglion cell layer.The density of cells expressing EM-2 in the intraocular hypertension model group was(0.8±0.1)/mm3,significantly lower compared with(4.6±0.8)/mm3in the control group(t=3.88,P<0.05).Conclusions EM-2 was expressed in the retinal ganglion cell layer and coexisted with μ-opioid receptor.The expression of EM-2 was decreased under intraocular hypertension.
Endomorphins;Retina;Intraocular hypertension;Distribution
2014-12-11)
(本文編輯:楊江瑜)
10.3969/g.issn.0253-9802.2015.04.005
100071北京,軍事醫學科學院附屬醫院神經內科
,張樂石,E-mail:zlsfmmu@163.com

