大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的相關因素分析
許鵬飛 徐永騰 付茹瑩 李子晨 林佛財 唐亞梅
臨床研究論著
大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的相關因素分析
許鵬飛 徐永騰 付茹瑩 李子晨 林佛財 唐亞梅
目的探討大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的相關影響因素。方法72例大腦中動脈狹窄或閉塞后急性腦梗死患者為研究對象,根據改良Rankin量表評分區分患者發病90 d臨床轉歸好壞,采用受試者工作特征(ROC)曲線擬合出預測90 d臨床轉歸的梗死灶體積最佳切點水平,并以最佳切點水平分組,分析梗死灶體積的相關影響因素。結果梗死灶體積≤30.92 ml可預測較好的90 d臨床轉歸,靈敏度為96.0%,特異度為95.7%,ROC曲線下面積為0.996。梗死灶體積≤30.92 ml組與體積>30.92 ml組的年齡、基線美國國立衛生院神經功能缺損評分、外周血白細胞數、血清白蛋白、超敏CRP、超氧化物歧化酶、GHbA1c及腦白質疏松程度,比較差異均有統計學意義(P均<0.05)。多因素Logistic回歸結果顯示腦白質疏松程度(OR=8.036,95%CI:1.951 ~44.467,P=0.005)及GHbA1c(OR=1.359,95%CI:1.032~4.790,P=0.029)是大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積>30.92 ml的危險因素,而白蛋白(OR=0.742,95%CI:0.610 ~0.902,P=0.003)是大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積>30.92 ml的保護因素。van Swieten量表評分3~4級及GHbA1c≥6.07%的患者梗死灶體積較大(P<0.001、P=0.001),而白蛋白≥35 g/L的患者梗死灶體積較小(P=0.017)。結論腦白質疏松程度、GHbA1c、血清白蛋白水平可影響大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積大小。
急性腦梗死;大腦中動脈;影響因素;梗死灶體積
大腦中動脈是頸內動脈的終末段,其發出的分支供應額葉、頂葉、顳葉前部的絕大部分血流,另外其分支豆紋動脈還供應基底節、尾狀核及內囊的血液。大腦中動脈狹窄或閉塞后,梗死灶體積一般較大,病情較重,預后也相對較差[1]。研究發現大腦中動脈遠端狹窄或閉塞后缺血梗死灶的體積可預測患者90 d的臨床轉歸,而梗死灶的體積又受多種因素的影響[2-3]。本文主要探討大腦中動脈狹窄或閉塞所致的急性腦梗死梗死灶體積的相關影響因素及其與患者90 d的臨床轉歸的關系。
對象與方法
一、研究對象
選取2008年1月至2014年7月在我院神經內科住院的由大腦中動脈狹窄或閉塞引起的急性腦梗死患者,將符合以下入選及排除標準的患者設為研究對象,入選標準:①符合《中國急性缺血性腦卒中診治指南》的急性腦梗死診斷標準;②經頭顱MRI檢查確診為腦梗死,磁共振血管造影(MRA)檢查示大腦中動脈狹窄(狹窄程度≥50%)或閉塞;③在24 h以內出現腦梗死的癥狀、體征。排除標準:①出血性腦梗死患者;②短暫性腦缺血發作患者。共72例符合要求,其中男46例、女26例,年齡(61.0±12.2)歲,大腦中動脈狹窄病程(3.1±1.2)年。根據文獻定義較好90 d臨床轉歸為改良Rankin量表(mRS)評分≤2[2]。按急性卒中Orgl10172治療試驗(TOAST)的腦梗死分類標準對患者進行以下分類:大動脈粥樣硬化性、心源性、腔隙性、其他病因和不明原因性腦梗死。
二、治療
按照中國急性缺血性腦卒中診治指南予所有入選患者相應治療,在超早期(腦梗死后0~6 h)及急性期(腦梗死后6~24 h)內根據患者的整體狀況選擇保守治療、介入或靜脈溶栓治療。給予危、重癥患者脫水、降顱壓、營養神經、改善循環、控制并發癥、維持水電解質平衡等對癥支持治療。
三、相關檢查及卒中評分
所有患者在入院當日(24 h內)行血常規、血液生化、GHbA1c、N端腦鈉肽前體(NT-pro-BNP)、凝血指標、心電圖等檢查,同時記錄患者入院時血壓、美國國立衛生院神經功能缺損評分(NIHSS),于發病后48 h內完善心臟彩色多普勒超聲檢查(彩超)、頸動脈血管彩超、經顱多普勒彩色成像、頭顱MRI及MRA等檢查。采用生物醫學成像軟件(Philips DICOM Viewer R2.5 Version 1.0)計算梗死灶面積(病灶最大層面長×寬)及體積(病灶最大層面長×寬×層間距×病灶層數×0.5)[4]。根據van Swieten量表(vSS)對患者腦白質疏松程度進行評分[5]。出院90 d后通過隨訪記錄患者的mRS評分,評估其神經功能恢復狀況。根據與90 d臨床轉歸相關的梗死灶體積進行分組,分析大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的相關影響因素。
四、統計學處理
結 果
一、預測急性腦梗死90 d臨床轉歸的梗死灶直徑、面積及體積的最佳切點水平
隨訪72例出院90 d后的mRS評分,其中47例患者mRS評分≤2,神經功能恢復情況較好,25例患者mRS評分>2,臨床轉歸相對較差。根據mRS評分,采用ROC曲線擬合出預測90 d臨床轉歸的最佳梗死灶直徑、面積及體積切點水平如下:梗死灶直徑≤3.16 cm及梗死灶面積≤10.05 cm2時,90 d臨床轉歸較好,靈敏度均達到90%以上,但特異度較低,分別為為57.4%及83.0%;梗死灶體積≤30.92 ml時,90 d臨床轉歸較好,靈敏度為96.0%,特異度為95.7%,ROC曲線下面積為0.996,具有較好的預測效果(表1、圖1)。
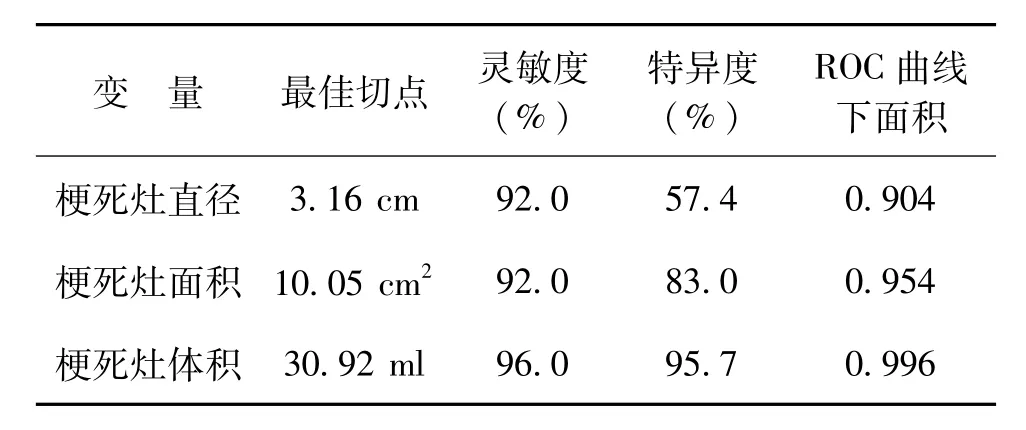
表1 預測大腦中動脈狹窄或閉塞后急性腦梗死90 d臨床轉歸的梗死灶直徑、面積及體積的最佳切點水平
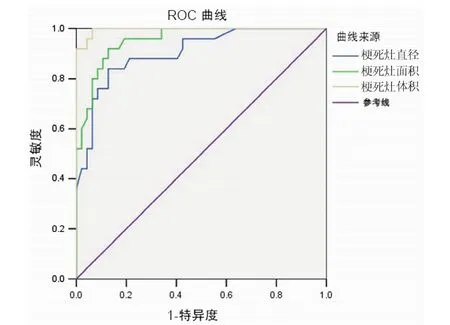
圖1 大腦中動脈狹窄或閉塞后急性腦梗死梗死灶直徑、面積及體積的ROC曲線分析圖
二、根據梗死灶體積最佳切點水平分組的大腦中動脈狹窄或閉塞后急性腦梗死患者的臨床特征比較
影響大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的單因素分析見表2,梗死灶體積≤30.92 ml組與>30.92 ml組的年齡、基線NIHSS、外周血白細胞數、血清白蛋白、超敏CRP(hs-CRP)、超氧化物歧化酶(SOD)、GHbA1c水平及腦白質疏松程度2組間比較差異均有統計學意義(P均<0.05)。性別、收縮壓、血糖、尿素、肌酐、尿酸、LDL、D-二聚體、同型半胱氨酸水平、NT-pro-BNP,高血壓病、糖尿病、心房顫動、血脂異常及吸煙、酗酒概率,還有治療方式及腦梗死分類在2組間比較差異均無統計學意義(P均>0.05)。
三、影響大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的多因素Logistic回歸結果
將單因素分析提示可能與大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積相關的影響因素(年齡、基線NIHSS評分,外周血白細胞數、白蛋白,hs-CRP,GHbA1c,SOD,腦白質疏松程度),采用逐步向前法建立多因素Logistic回歸方程。結果顯示腦白質疏松程度(OR=8.036,95%CI:1.951~44.467,P=0.005)及GHbA1c(OR=1.359,95%CI:1.032~4.790,P=0.029)是大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積>30.92 ml的危險因素,白蛋白(OR=0.742,95%CI:0.610 ~0.902,P=0.003)是大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積>30.92 ml的保護因素(表3)。
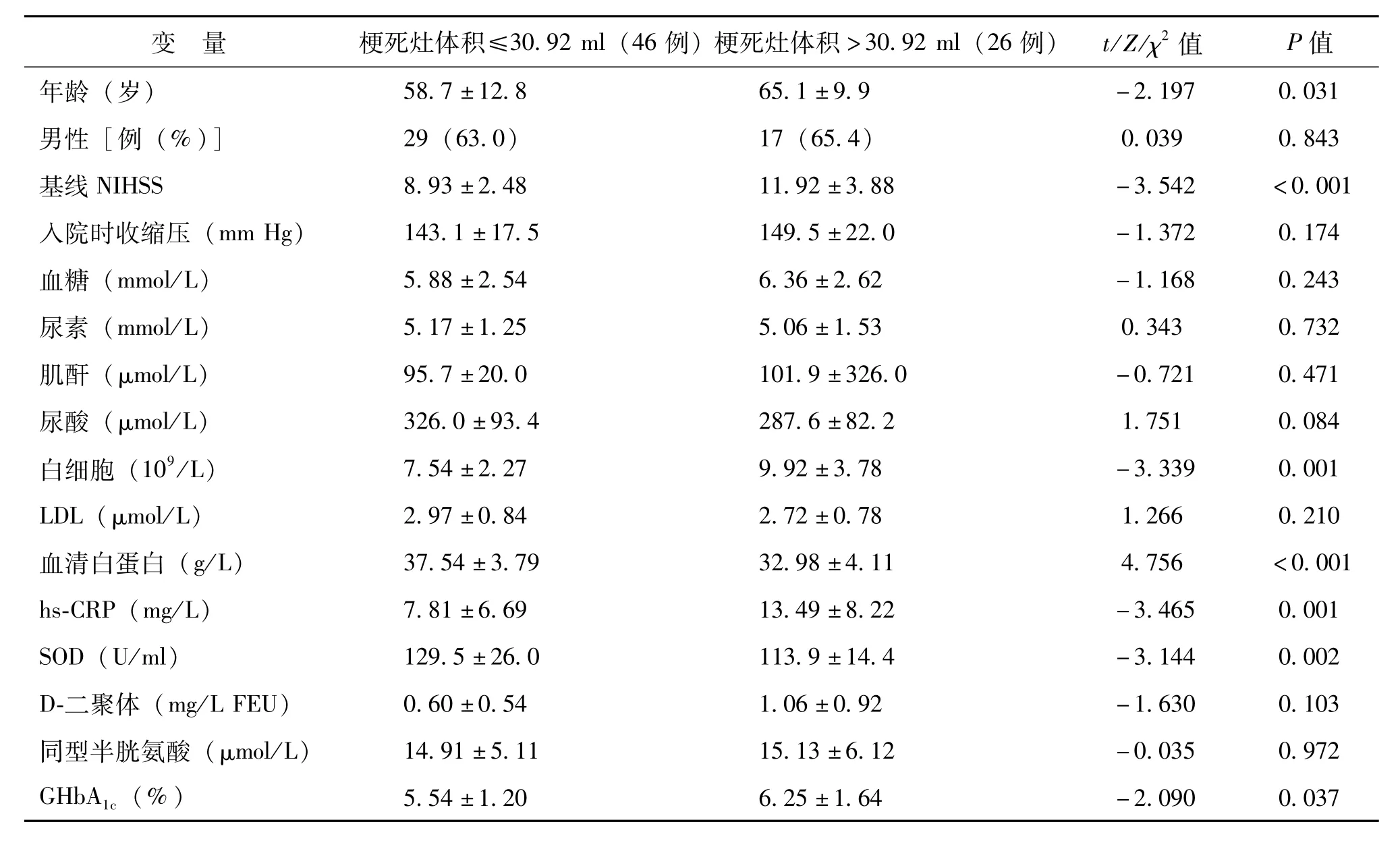
表2 根據梗死灶體積最佳切點水平分組的急性腦梗死患者基本臨床特征比較
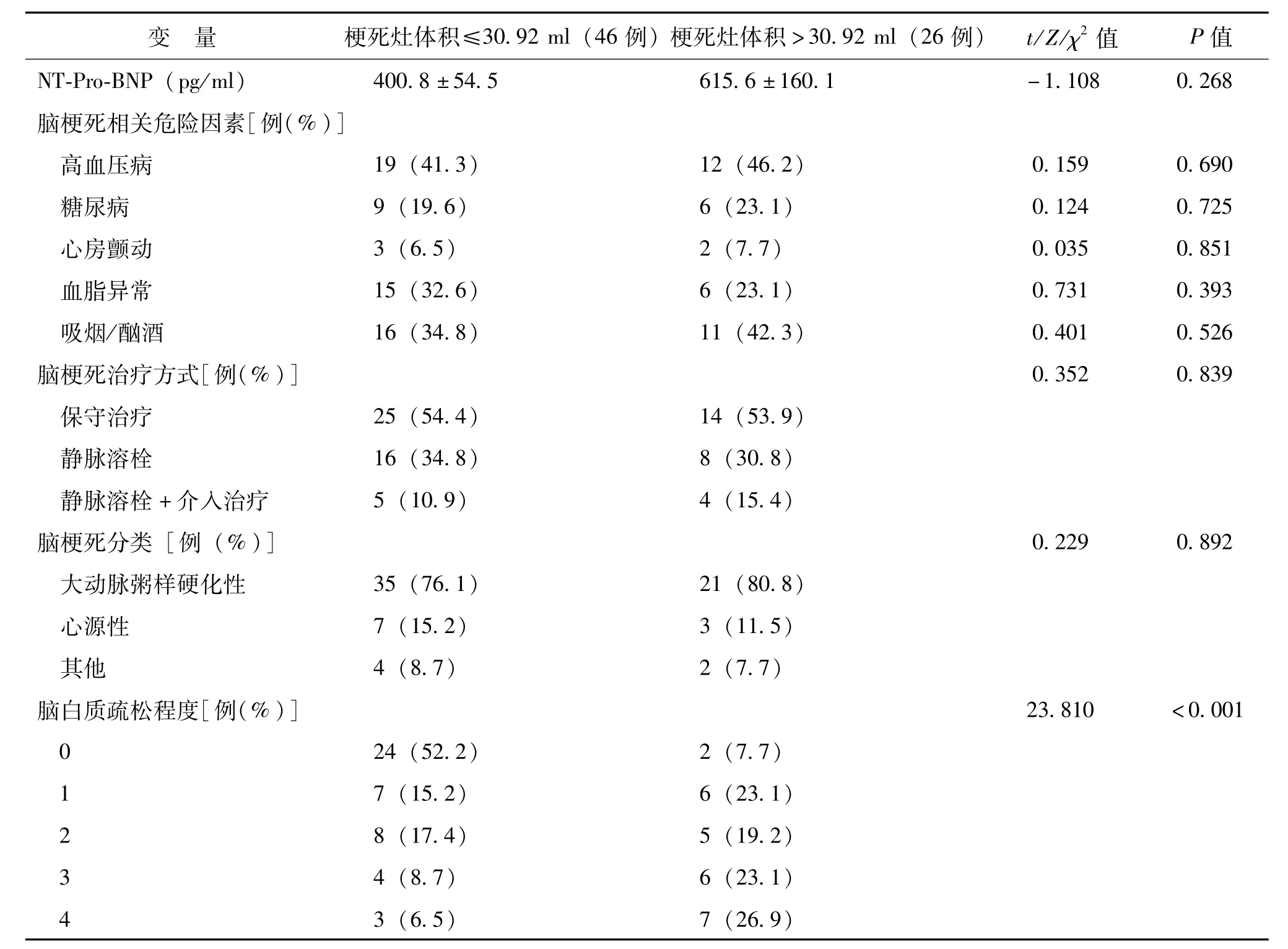
續表
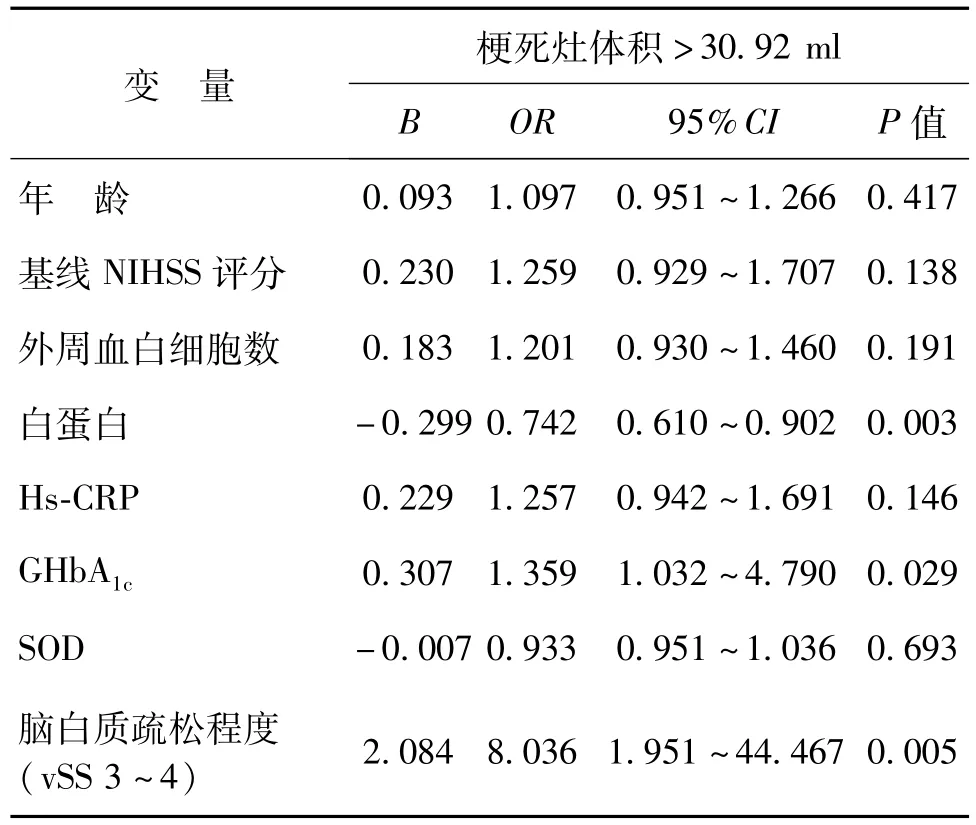
表3 影響大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的多因素Logistic回歸結果
四、根據vSS評分、GHbA1c及血清白蛋白水平分組的大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積比較
vSS 0~2級的急性腦梗死患者梗死灶體積為(22.4±10.5)ml,vSS 3~4級的患者梗死灶體積為(39.9±14.4)ml,2組間比較差異有統計學意義(Z=-4.702,P<0.001);以我院檢驗科檢測的GHbA1c正常高值及血漿白蛋白正常低值(2007年至2014年的正常參考值)為分界點分組,GH-bA1c<6.07%的急性腦梗死患者梗死灶體積為(23.9±13.0)ml,GHbA1c≥6.07%的急性腦梗死患者梗死灶體積為(35.0±14.7)ml,2組間比較差異有統計學意義(Z=-3.175,P=0.001);白蛋白≥35 g/L的急性腦梗死患者梗死灶體積為(23.1±11.0)ml,白蛋白<35 g/L的急性腦梗死患者梗死灶體積為(32.4±16.7)ml,2組間比較差異有統計學意義(Z=-2.383,P=0.017)(圖2)。
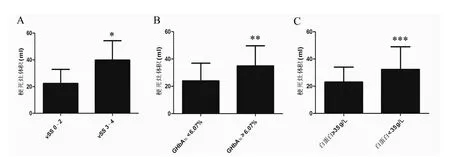
圖2 按vSS評分、GHbA1c水平及血清白蛋白水平分組的大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積比較
討 論
急性腦梗死是一組包括不同病因、嚴重程度、臨床轉歸的疾病的總稱,其發病率、致殘率、病死率均較高。影響急性腦梗死預后的因素包括閉塞或狹窄血管的位置及其引起梗死灶的大小等,輕者經過適當的治療可獲得較好預后,而重者如惡性大腦中動脈狹窄或閉塞引起的腦梗死,由于病變血管供應顱內大部分血流,梗死灶體積較大,病情重,預后較差,病死率較高[6]。
梗死灶體積可在一定程度上預測90 d臨床轉歸,Henninger等[2]報道對于大腦中動脈遠端狹窄或閉塞的急性腦梗死患者,缺血梗死灶體積≤27 ml可預測較好的90 d臨床轉歸,本研究結果顯示,預測較好大腦中動脈狹窄或閉塞后急性腦梗死90 d臨床轉歸的梗死灶體積為≤30.92 ml,與Henninger等的數據接近,由于本文研究的是大腦中動脈,所以預測臨床轉歸的體積相對增大。對于梗死灶體積>30.92 ml的大腦中動脈狹窄或閉塞后急性腦梗死患者,應得到臨床醫師的足夠重視。雖然ROC曲線擬合得出預測大腦中動脈狹窄或閉塞后急性腦梗死90 d臨床轉歸的梗死灶直徑及面積的靈敏度均達到90%以上,但特異度均較低,不能較好地預測患者臨床轉歸,筆者主要選擇了以大腦中動脈狹窄或閉塞后急性腦梗死的梗死灶體積作為切點分組,分析其相關影響因素。
既往的研究已報道,急性腦梗死患者外周血白細胞數、hs-CRP、血清白蛋白及GHbA1c水平明顯高于健康對照組,而基線NIHSS≥13分及NT-Pro-BNP水平高的急性腦梗死患者預后相對較差,另外外周血白細胞數及hs-CRP可預測缺血性腦血管病事件的發生[7-10]。外周血白細胞數增高可能會加重動脈粥樣硬化,并且能夠引起血管損傷及促進缺血缺氧組織的動脈粥樣硬化炎癥反應;hs-CRP可通過刺激單核細胞表達組織因子,促進血管內皮細胞表達黏附分子、趨化因子及內皮素,增強單核細胞-內皮細胞黏附促進血栓形成[8-9]。本研究中梗死灶體積≤30.92 ml組hs-CRP、外周血白細胞數及基線NIHSS較梗死灶體積>30.92 ml組低,比較差異有統計學意義。SOD是清除體內自由基的抗氧化酶,扮演著重要的清道夫作用,腦梗死急性期由于大量自由基的產生,SOD被過度消耗而降低。本研究中梗死灶體積>30.92 ml組SOD水平較低,且所有急性腦梗死患者SOD平均水平低于我院SOD正常參考值下限,急性腦梗死SOD水平降低,這與Cojocaru等[11]的研究結果一致。王文聞等[12]發現,急性腦梗死患者血清白蛋白水平較健康對照組低,可能是由于患者神經功能受損導致進食困難,蛋白質合成能力下降所致;還可能與白蛋白作為自由基清除劑及其修復作用被消耗有關。另外Idicula、Babu等[13-14]指出血清白蛋白水平高的腦梗死患者具有較好的臨床結局,是缺血性腦卒中的保護性因素。本研究中梗死灶體積>30.92 ml組血清白蛋白水平更低,白蛋白<35 g/L的患者腦梗死體積較白蛋白≥35 g/L的大。梗死灶體積>30.92 ml組基線NIHSS評分、外周血白細胞數、hs-CRP及GHbA1c水平較高,而白蛋白和SOD水平較低,這些檢測指標均與梗死灶體積相關,但是否存在梗死灶體積越大,相關檢測指標水平升高或降低越明顯,尚有待后續的進一步研究。
多因素Logistic回歸分析得出GHbA1c、腦白質疏松程度是大腦中動脈狹窄或閉塞后急性腦梗死缺血梗死灶體積>30.92 ml的危險因素,而血清白蛋白水平是其保護性因素。根據vSS評分分組得出vSS 0~2級的患者梗死灶體積明顯小于vSS 3~4級的患者,腦白質疏松程度與大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積相關,可影響梗死灶體積大小,具體的原因可能是伴有腦白質疏松的急性腦梗死患者皮層血管密度降低,引起皮層腦組織低灌注,從而降低皮層對缺血的耐受力,所以伴有腦白質疏松的腦梗死患者梗死灶的體積相對較大,臨床轉歸可能較差[2]。GHbA1c能降低微細血管對缺血缺氧的耐受力,與急性腦梗死梗死灶的體積大小及預后相關[15-17]。本文中GHbA1c≥6.07%的患者梗死灶體積大于GHbA1c<6.07%的患者,GHbA1c在一定程度上可影響急性腦梗死梗死灶體積的大小,患者入院后常規行GHbA1c檢查對急性腦梗死的評估有一定的臨床意義。血清白蛋白在卒中早期微循環再灌注期具有抗氧化應激、抑制血小板聚集及神經保護作用,另外在缺血再灌注動物模型中,予中、高劑量的人血白蛋白治療可有效地縮小腦梗死面積、減輕腦水腫及提高神經功能狀態,人血白蛋白治療急性腦梗死已取得較好的臨床效果[14]。血清白蛋白可影響急性腦梗死的梗死灶體積及預后。
綜上所述,對于大腦中動脈狹窄或閉塞后急性腦梗死患者,梗死灶體積≤30.92 ml可預測較好的90 d臨床轉歸,而GHbA1c、血清白蛋白及腦白質疏松的程度可影響大腦中動脈狹窄或閉塞后急性腦梗死梗死灶體積的大小。對于梗死灶體積>30.92 ml的大腦中動脈狹窄或閉塞后急性腦梗死患者,需予個體化的治療及護理方案,以期取得較好的90 d臨床轉歸。
[1]經屏,張臨洪,徐武平.動脈粥樣硬化性大腦中動脈狹窄患者腦梗死類型的臨床分析.中華神經醫學雜志,2013,12:147-151.
[2]Henninger N,Lin E,Haussen DC,et al.Leukoaraiosis and sex predict the hyperacute ischemic core volume. Stroke,2013,44:61-67.
[3]Henninger N,Khan MA,Zhang J,et al.Leukoaraiosis predicts cortical infarct volume after distal middle cerebral artery occlusion.Stroke,2014,45:689-695.
[4]Hussein HM,Tariq NA,Palesch YY,et al.Reliability of hematoma volume measurement at local sites in a multicenter acute intracerebral hemorrhage clinical trial. Stroke,2013,44:237-239.
[5]馮濤,王擁軍.腦白質疏松的影像學評測量表.中國卒中雜志,2009,4:226-230.
[6]Wartenberg KE.Malignant middle cerebral artery infarction.Curr Crit Care,2012,18:152-163.
[7]楊繼黨,林清原.糖化血紅蛋白及高敏C反應蛋白與腦梗死急性期患者頸動脈粥樣硬化的關系.中華神經醫學雜志,2013,12:286-288.
[8]Wu TH,Chien KL,Lin HJ,et al.Total white blood cell count or neutrophil count predict ischemic stroke events among adult Taiwanese:report from a communitybased cohort study.BMC Neurol,2013,13:7.
[9]Huang Y,Jing J,Zhao XQ,et al.High-sensitivity C-reactive protein is a strong risk factor for death after A-cute ischemic stroke among Chinese.CNS Neurosci T-her,2012,18:261-266.
[10]Chen X,Zhan X,Chen M,et al.The prognostic value of combined NT-pro-BNP levels and NIHSS scores in patients with acute ischemic stroke.Intern Med,2011,51:2887-2892.
[11]Cojocaru IM,Cojocaru M,Sapira V,et al.Evaluation of oxidative stress in patients with acute ischemic stroke. Rom J Intern Med,2013,51:97-106.
[12]王文聞,黃旅黔.腦梗死患者血清白蛋白,球蛋白水平及其比值變化研究.中華神經醫學雜志,2011,10:1023-1026.
[13]Idicula TT,Waje-Andreassen U,Brogger J,et al.Serum albumin in ischemic stroke patients:The higher the better.Cerebrovasc Dis,2009,28:13-17.
[14]Babu MS,Kaul S,Dadheech S,et al.Serum albumin levels in ischemic stroke and its subtypes:correlation with clinical outcome.Nutrition,2013,29:872-875.
[15]Li H,Kang Z,Qiu W,et al.Hemoglobin A1C is independently associated with severity and prognosis of brainstem infarctions.J Neurol Sci,2012,317:87-91.
[16]Rozanski M,Richter TB,Grittner U,et al.Elevated levels of hemoglobin A1c are associated with cerebral white matter disease in patients with stroke.Stroke,2014,45:1007-1011.
[17]Wu S,Wang C,Jia Q,et al.HbA1c is associated with increased all-cause mortality in the first year after acute ischemic stroke.Neurol Res,2014,36:444-452.
Analysis of factors associated with infarct volume in patients with acute ischemic stroke following middle cerebral artery stenosis or occlusion
Xu Pengfei,Xu Yongteng,Fu Ruying,Li Zichen,Lin Focai,Tang Yamei.Department of Neurology,Sun Yat-sen Memorial Hospital of Sun Yat-sen University,Guangzhou 510120,China
ObjectiveTo analyze the factors associated with infarct volume in patients presenting with acute ischemic stroke after middle cerebral artery stenosis or occlusion.MethodsSeventy-two cases with acute ischemic stroke following middle cerebral artery stenosis or occlusion were enrolled in this study.Clinical outcomes at 90 days after onset were evaluated based upon the modified Rankin scale score.The optimal cut-off value of infarct volume at 90-day clinical outcomes was estimated by receiver operating characteristic(ROC)curves.All patients were divided into different groups according to the optimal cut-off value to explore the factors associated with infarct volume.ResultsThe infract volume≤30.92 ml predicted relatively favorable 90-day clinical outcomes with a sensitivity of 96.0%,specificity of 95.7%and ROC area of 0.996.The age,baseline National institute of health stroke scale score,albumin level,high-sensitivity C-reactive protein,superoxide dismutase,GHbA1clevels,and leukoaraiosis grade all significantly differed between the infarct volume ≤30.92 ml and>30.92 ml groups(all P<0.05).Multivariate logistic regression analysis showed that the severity of leukoaraiosis(OR=8.036,95%CI:1.951~44.467,P=0.005)and GHbA1c(OR=1.359,95%CI:1.032~4.790,P=0.029)were independent risk factors,whereas albumin(OR=0.742,95% CI:0.610~0.902,P=0.003)served as a protective factor for infarct volume greater than 30.92 ml in patients with acute cerebral ischemic stroke after middle cerebral artery stenosis or occlusion.The infarct volume was significantly larger in patients with van Swieten scale score of 3 to 4 or GHbA1c≥6.07%(P<0.001,P=0.001),whereas the infarct volume was significantly smaller in those with albumin level≥35g/l(P=0.017).ConclusionSeverity of leukoaraiosis,GHbA1cand albumin level could influence the infarct volume in patients with acute cerebral ischemic stroke following middle cerebral artery stenosis or occlusion.
Acute ischemic stroke;Middle cerebral artery;Influential factors;Infarct volume
2014-10-20)
(本文編輯:洪悅民)
10.3969/g.issn.0253-9802.2015.04.008
廣州市珠江科技新星基金(2012J2200088)
510120廣州,中山大學孫逸仙紀念醫院神經科
,唐亞梅,Email:yameitang@hotmail.com

