產油微藻的篩選及其產油性能評價的研究
王玉榮, 師文靜, 佟明友
產油微藻的篩選及其產油性能評價的研究
王玉榮1,2, 師文靜2, 佟明友2
(1. 遼寧石油化工大學,遼寧 撫順 113001; 2. 中國石化撫順石油化工研究院,遼寧 撫順 113001)
為了篩選具有產油潛力的能源微藻,從東北地區部分水域中分離出98種微藻。根據生長情況和尼羅紅染色法篩選出14個藻種進行產油水平比較。通過藻種生物量以及油脂含量的測定,建立了富油微藻的綜合評價方法,獲得總脂含量超過30%的微藻10株,其中小球藻R1的油脂含量47.87%,油脂產率達到72.47 mg?L-1?d-1,并且其三酰基甘油含量較高,適合于生物柴油生產,是具有產業化潛力的優良藻種。
生物柴油; 產油微藻; 生物量; 油脂產率
為實現經濟和環境的可持續發展,可再生、無污染的生物質能源已成為研究熱點[1]。生物柴油是一種重要的可再生能源[2],但生產原料來源一直是限制其產業化的瓶頸。微藻因其資源豐富、生長迅速、油脂含量高等優點,成為生產生物柴油的理想原料[3,4]。但要發展能源微藻,進行含油微藻規模化生產,還面臨許多技術問題,優良藻種的獲得就是瓶頸之一。
很多微藻都含豐富的油脂,但不同微藻油脂含量有明顯差異[5]。因此,篩選高產油微藻是產業化的關鍵[6]。國內外研究者對能源微藻的篩選和評價做了很多工作[7,8]。本研究從東北地區的部分自然水體中分離出微藻藻種,利用尼羅紅染色法篩選出多株高產油微藻,對其生長速率、生物量和油脂含量進行分析評價,旨在獲得生長速度快、生物量高、油脂含量高的優良藻種,為微藻生物柴油提供原料來源。
1 試驗部分
產油微藻的篩選評價過程如圖1所示。首先通過東北地區的部分水樣采集得到各種微藻,分離、純化;然后用染色法和顯微檢測進行初篩;再根據生物量和油脂產量兩項指標進行復篩,其中生長速率和油脂含量是兩個重要指標。生長速率指在單位時間和單位體積內生物量的積累量;油脂含量主要是指能做為生物柴油原料油脂的含量。最后,選取生長速率快、油脂含量高的藻種分類保藏。具體方法如下:
1.1 藻種的分離與純化
藻種水樣采自東北地區部分水域,在實驗室進行平板劃線法分離、純化:吸取少量稀釋的水樣接種于滅菌的固體培養基上,在適宜的條件下培養2~3周,用接種環挑出單藻落,在大口三角瓶中純化培養,3~4周后鏡檢,重復數次,直到獲得純的目標藻株。本研究共分離出98株藻種。將分離的藻種用50 mL大口三角瓶培養3個月左右,選擇生長良好、易培養的52種藻株做下一步篩選。
1.2 微藻的尼羅紅染色
小試管中取1 mL藻液,添加0.01 mL尼羅紅染色液(以丙酮為溶劑配制成0.1 g/L),震蕩混勻,于20 ℃避光染色10 min,用倒置熒光顯微鏡(藍光激發)觀察藻細胞內被染色油脂,確保油脂著色。然后用分光光度計測藻液的OD689.5值,用培養液將藻液稀釋,使藻液的OD689.5值統一為5左右,再取1 mL的藻液于48孔熒光板,每孔再加入10 μL尼羅紅染色液,用酶標儀檢測530 nm光激發下,580 nm處的熒光強度,并扣除未染色藻液在該波長處的熒光強度即為凈熒光值,重復測定三次。
1.3 篩選評價實驗
首先將用尼羅紅染色初篩選出的藻種移至1 L三角瓶(500 mL藻液)擴大培養,置水平搖床培養3~5 d,收集藻細胞,最后用新鮮培養基在微藻培養裝置中接種。將藻種的初始濃度統一為OD689=0.1。培養周期為12 d,每兩天測一次OD值,檢測藻種生長速率,收集第12 d的藻液,10 000 r/min離心5 min收集藻細胞,凍干后測定生物量和油脂含量。
微藻分離純化與篩選評價試驗均采用BG-11培養基,培養溫度(25±1)℃,光暗時間比12:12,光照強度200μmol/(m2·s)。篩選評價實驗使用內徑3.6 cm,高34cm的柱狀光生物反應器(裝液量為200 mL)培養。篩選評價實驗持續通入壓縮空氣(1% CO2)。
1.4 分析方法
1.4.1 藻種比生長速率測定
比生長速率 = (lnN2- lnN1)/(T2-T1)
N1為接種時OD值,N2為培養結束時的OD值,T1和T2分別是培養開始和結束的時間。
1.4.2 生物量測定
將培養的藻液10 000 r/min離心5 min得到藻泥,-50 ℃下冷凍干燥至恒重,稱重得到藻細胞干重。
1.4.3 油脂含量測定方法
用乙酸乙酯/正己烷混合溶劑萃取法對藻粉的總脂含量進行測定[9,10]
1.4.4 油脂產率計算
油脂產率 = 生物量×油脂含量/培養天數
1.5 薄層層析
利用氯仿/甲醇提取藻細胞中的油脂[11],然后進行微藻總脂的薄層層析[12,13]。
2 試驗結果
2.1 藻株的分離純化及初步鑒定
從采集的水樣中分離純化出98株藻種,其來源和細胞形態特征見表1。根據微藻的細胞形態及其生長特征,參照《中國淡水藻類—系統、分類及生態》,可以將部分微藻初步歸入小球藻、柵藻、桿藻等屬,要準確分類到種,還需要用分子生物學手段確定。
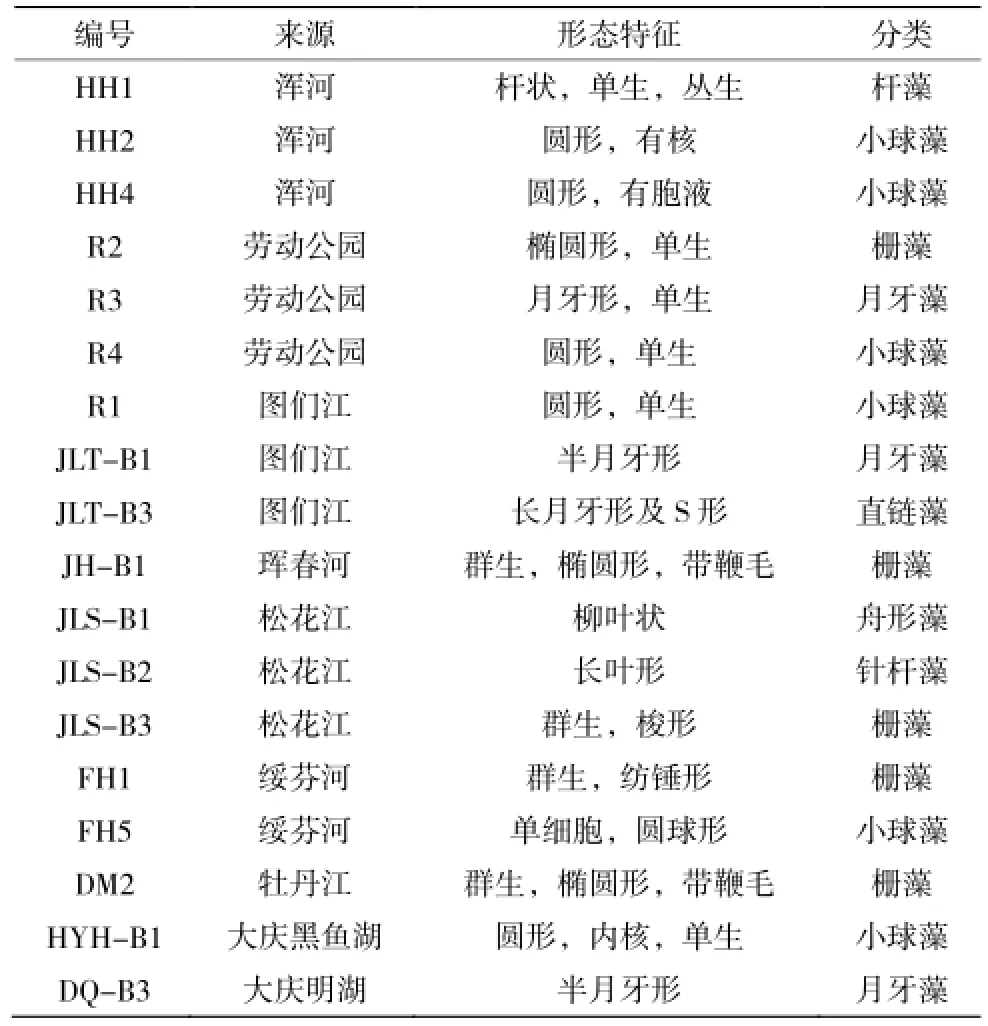
表1 部分藻種來源及特征Table 1 Sources and characteristics of part of algae species
從表1可知,分離出的藻種細胞形態均不一樣,有圓形、桿狀、月牙形、半月形、紡錘形、梭形、葡萄狀等各種形態。柵藻細胞一般以群體形態存在,小球藻以單細胞狀態存在。
2.2 藻株的尼羅紅染色篩選
從98種藻種中篩選出生長快、不貼壁、不結團、易培養的藻種52株,對其進行尼羅紅染色篩選。有研究表明,激發波長和散射波長分別為450~500 nm和大于528 nm時,經尼羅紅染色的微藻細胞熒光強度與細胞內中性油脂的含量顯著相關[14-17]。熒光強度越高則微藻油脂含量越高,因此,可通過即時測定熒光強度小來檢測微藻的油脂含量。
表2是52種藻株的凈熒光染色值,其中凈熒光值較高的有12種,分別是N2、R1、N-2-1、HH1、HH2、HH4、W1、W2、W3、W4、W5、JLT-B1。從表2得知,不同藻種的尼羅紅染色凈熒光值不一樣。藻株HH2的凈熒光值達到135.23,而JH-1的凈熒光值只有0.39,說明不同藻種的中性油脂含量差異很大。柵藻熒光值偏低,這與Luisa Gouveia[18]等報道的柵藻在自養條件下油脂含量較低相對應;而在篩選到的球藻中,多數有較高的熒光值,與文獻[19,20]報道的球藻有較高的含油量相吻合。
2.3 微藻生長速率、生物量和油脂含量的測定
選出N2、R1、N-2-1等12種熒光值較高的藻種和2種生長速率較高的藻種ABH-B3、JH-D4進行藻種評價試驗。表3 是藻種的生長速率、生物量和油脂含量的評價結果。比生長速率最高的是ABH-B3,達到0.5982d-1,其次是HH4、W2、JLT-B1、R1和HC-D4,都大于0.5 d-1。比生長速率較高的生物量也較高,因此藻種ABH-B3的生物量也高,達到2.32 g/L。藻種HH4、W2、JLT-B1、R1和HC-D4的生物量也都高于1 g/L。
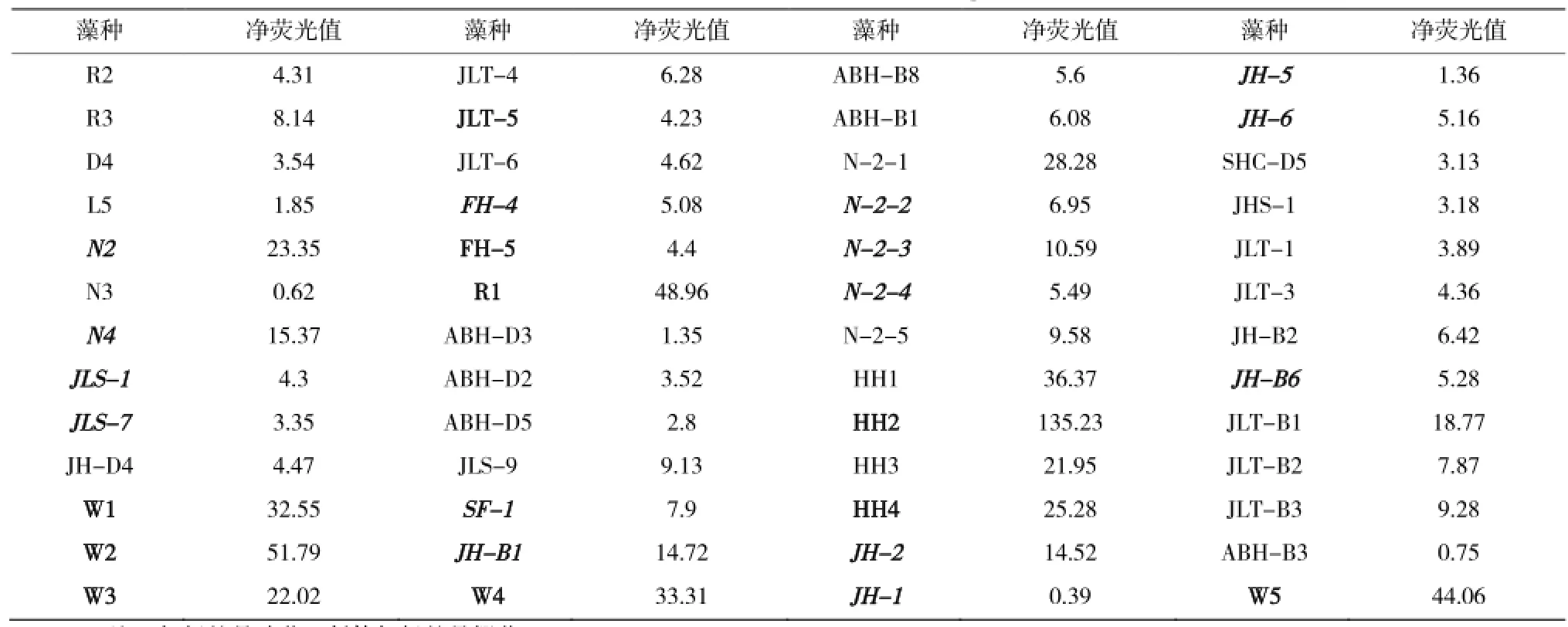
表2 尼羅紅染色藻種及凈熒光值Table 2 Nile red fluorescence of microalgae strains
2.4 微藻藻種的產油潛力評價
油脂產率是微藻總脂含量與生物量的乘積再除于培養天數,表示每天實際收獲的油脂量。它是反映微藻生長速率、生物量與總脂含量的綜合產考指標。圖1為14種微藻的油脂產率圖。其中R1的油脂產率最高,為72.47 mg?L-1?d-1。ABH-B3與HH4也有較高的油脂產率,分別為56.567 mg?L-1?d-1、42.03 mg?L-1?d-1。
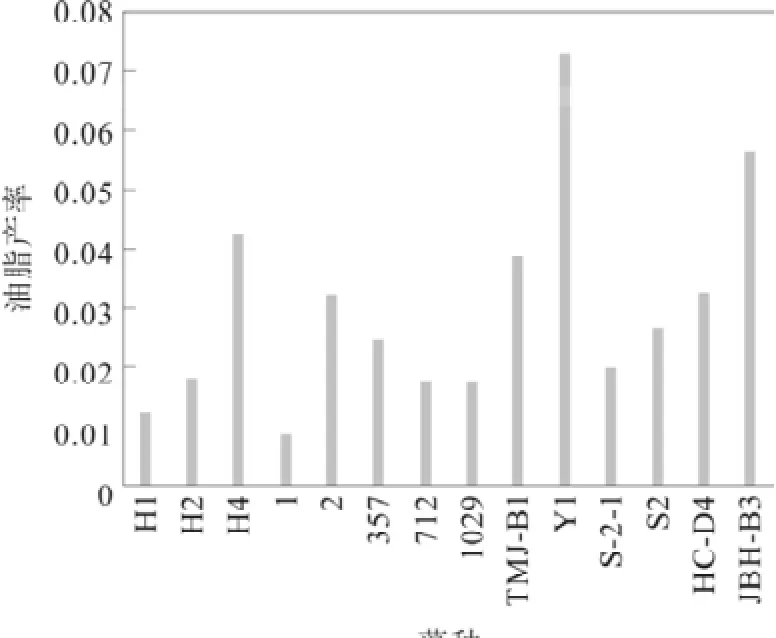
圖1 微藻的油脂產率比較Fig.1 Comparison of microalgae oil yield
2.5 微藻中三酰基甘油含量的測定
微藻細胞內儲存物三酰基甘油中的脂肪酸大多為飽和脂肪酸,是生產生物柴油所用原料的主要成分[21]。通過薄層層析可檢測微藻中的三酰基甘油含量。該方法具有操作方便、快速檢測、分離效果好等特點[22]。本研究將14種微藻培養至穩定期,以相同生物量提取油脂,通過薄層層析比較,篩選出三酰基甘油含量較高的藻種是R1、W2、W4、HH4和ABH-B3。
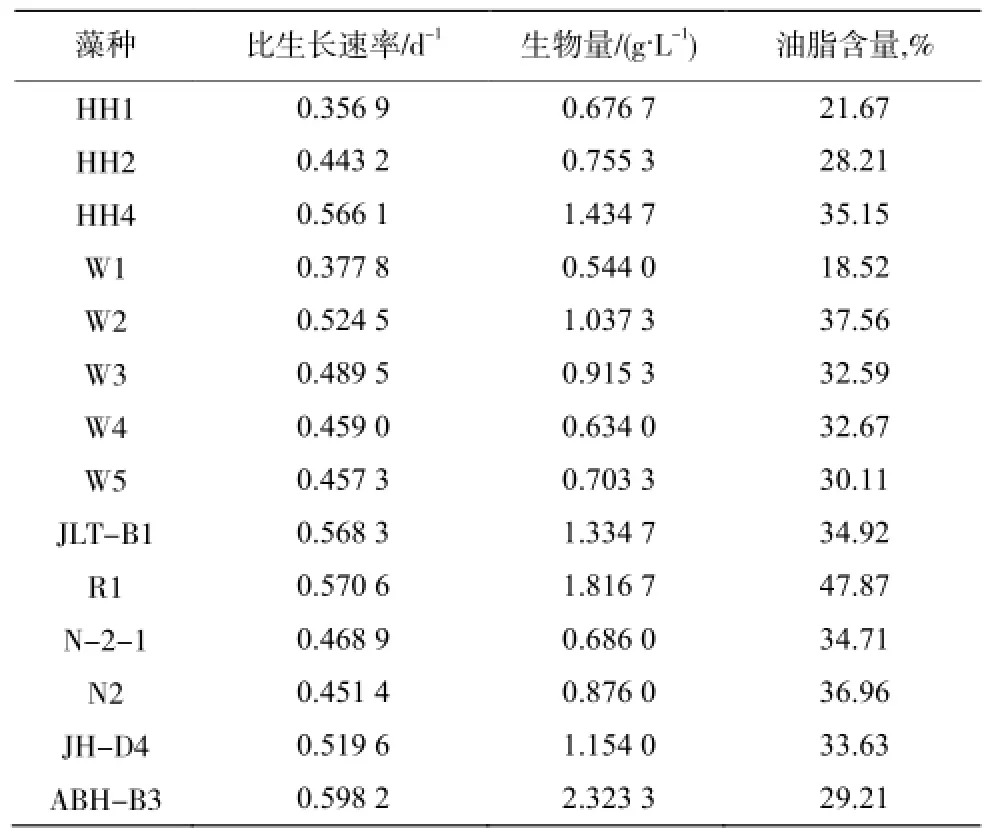
表3 藻種的生長速率、生物量和油脂含量Table 3 The growth rate,biomass and oil content of microalgae strains
3 結 論
從東北地區部分水域中分離出98種微藻,選出其中14種微藻進行產油水平評價,獲得總脂含量超過30%的微藻有10株,其中藻株Y1的油脂含量47.87%,油脂產率達到72.47 mg?L-1?d-1,并且其三酰基甘油含量較高,是適于生物柴油生產的優良藻種。
本研究利用快速篩選富油微藻的尼羅紅染色法、是一種很好的初級篩選方法。通過藻種比生長速率、生物量以及油脂含量的測定,建立了優良藻種的綜合評價方法
為了使篩選的藻種適合于生產生物柴油,對油脂中的三酰基甘油進行薄層層析,結合油脂產率,確定小球藻R1是有產業化潛力的優良藻種。
[1]梁穎,馮俊麗,徐方嬌,等.一株產油微藻—小球藻的純化鑒定與培養基的篩選[J].科技通報,2013,29(3):40-46.
[2]孫漫,聶娟,袁維道,等.產油脂海洋微藻的篩選、鑒定及Fe3+對其生長和油脂積累的影響[J].中國油脂,2012,37 (12):70-73.
[3]Li Y, Horsman M, Wu N, et al. Biofuels from microalgae[J]. Biotechnology Progress, 2008, 24(4): 815–820.
[4]張玉璽,馬紅軍.藻類生物燃料的發展與環境保護[J].當代化工,2013,42(12):1711-1714.
[5]張英偉,劉煒.微藻能源的研究進展[J].海洋科學,2012,36(1):132-138.
[6]Griffiths M J, Susan T L, Harrison. Lipid productivity as a key characteristic for choosing algal species for biodiesel production[J]. Journal of Applied Phycology, 2009, 21: 493–507.
[7]李濤,李愛芬,桑敏,等.富油能源微藻的篩選及產油性能評價[J].中國生物工程雜志,2011,31(4):98-105.
[8]Bai A, Jobbagy P, Durko E. Algae production for energy and foddering[J]. Biomass Conversion and Biorefinery, 2011, 1: 163–171.
[9]張桂艷,溫小斌,梁芳,等.重要理化因子對小球藻生長和油脂產量的影響[J].生態學報,2011,31 ( 8) :2076-2085.
[10]溫小斌,江麗麗,耿亞洪.微藻總脂定量分析方法的比較研究[J].中國油脂,2012,37(11):80-85.
[11]徐 進,徐旭東,方仙桃,等.高產油小球藻的篩選及其油脂分析[J].水生生物學報,2012 ,36( 3):426-432.
[12]Reiser S , Somerville C. Isolation of mutants of Acinetobactercal -coaceticus deficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase[J]. Journal Bacteriology, 1997,179(9): 2969-2975.
[13]Yu E T, Zendejas F J, Lane D P, et al. Triacylglycerol accumulation and profiling in the model diatoms Thalassiosira pseudonana and Phaeodactylum tricornutum (Baccilariophyceae) during starvation[J]. Journal Applied Phycology,2009, 21(6): 669-681.
[14]周文俊,鄭立,韓笑天,等.基于尼羅紅染色分析金藻總脂動態積累[J].水生生物學報,2014,38(2):312-319.
[15]楊勛,劉平懷,郝宗娣,等.富油微藻Monoraphidium sp.的分離及其油脂提取工藝研究[J].安徽農業科學,2011,39( 32) :19988-19990.
[16]胡小文,馬帥,弓淑芬,等.熒光光譜檢測微藻中油脂[J].中國油脂,2011,36(4):70-73.
[17]王海英,符茹,黃寶祥.基于尼羅紅熒光染色的小球藻脂質快速檢測方法研究[J].中國油脂,2012.37(3):78-81.
[18]Luisa Gouveia, Ana Cristina Oliveira. Microalgae as a raw material for biofuels production[J].Ind Microbiol Biotechnol, 2009, 36(2): 269–274.
[19]王金娜,嚴小軍,周成旭,等.產油微藻的篩選及中性脂動態積累過程的檢測[J].生物物理學報,2010,26(6):472-480.
[20]萬文文,岳燕燕,梁科鵬.兩株地下海水微藻的分子鑒定及其油脂分析[J].海洋環境科學,2013,32(3):440-443.
[21]李秀波,徐旭東,孔任秋.五種微綠球藻產油和產多不飽和脂肪酸的研究[J].水生生物學報,2010,34(5):893-897.
[22]黃瀟雅,陳鍇,嚴小平.泔水油的薄層層析法快速鑒別研究[J].杭州化工,2013,43(3):19-26.
Study on Screening of Oleaginous Microalgae and Evaluation of Its Oil-producing Performance
WANG Yu-rong1,2,SHI Wen-jing2,TONG Ming-you2
(1. Liaoning Shihua University, Liaoning Fushun 113001, China;2. Fushun Research Institute of Petroleum and Petrochemicals , SINOPEC, Liaoning Fushun 113001, China)
In order to screen microalgae that has the potential of oil production,98 strains of microalgae were isolated and purified from the water samples which were collected from the natural water in parts of northeast region. According to the growth characteristics of microalgal cultures and Nile red staining,lipid production capacities of fourteen strains of microalgae were compared. The comprehensive evaluation method of oleaginous microalgae was established by measuring biomass,total lipid content and total lipid yield. The results show that the total lipid contents of ten microalgae are more than 30 percent. It’s concluded that the most potential for industrial application is Chlorella Sp Y1,whose total lipid content and lipid productivity are 47.87% and 72.47 mg / ( L·d) respectively.R1 has high content of Triglycerides for biodiesel production.
Biodiesel; Oleaginous microalgae; Biomass; Lipid productivity
TK 6;S 216.2
: A
: 1671-0460(2015)04-0680-04
中國石化集團微藻生物柴油成套技術開發,項目號:210080
2015-02-16
王玉榮(1989-),女,內蒙人,碩士研究生,從事微藻生物資源研究。E-mail:qimuge1989@163.com。
師文靜(1980-),女,陜西渭南人,從事生物質能源研究。E-mail:shiwenjing @163.com。

