漢黃芩素對卵巢癌HO-8910細胞增殖及凋亡的影響
陳麗君 王 娟 李 佳 王 建
1.陜西省渭南市富平縣醫院婦產科,陜西富平711700;2.西安交通大學醫學院第一附屬醫院婦產科,陜西西安710004;3.第四軍醫大學西京醫院婦產科,陜西西安710032
漢黃芩素對卵巢癌HO-8910細胞增殖及凋亡的影響
陳麗君1王 娟2李 佳3王 建3
1.陜西省渭南市富平縣醫院婦產科,陜西富平711700;2.西安交通大學醫學院第一附屬醫院婦產科,陜西西安710004;3.第四軍醫大學西京醫院婦產科,陜西西安710032
目的探討漢黃芩素對人卵巢癌HO-8910細胞增殖、凋亡的影響,并分析可能的作用機制。方法采用不同濃度(0、20、50、80、100、130 μg/mL)的漢黃芩素處理人卵巢癌HO-8910細胞,48 h后分別用MTT法檢測細胞活力的變化,AnnexinⅤ/PI雙染法檢測細胞凋亡的變化,Western blotting分析p21、cyclin B1、p53和Bax蛋白的表達水平。結果隨著處理濃度的增加,漢黃芩素劑量依賴性地抑制人卵巢癌HO-8910細胞的增殖(P<0.05),同時誘導細胞大量凋亡。進一步分析證實,漢黃芩素能夠劑量依賴性地下調細胞周期相關蛋白cyclin B1的表達,同時上調p21的表達(P<0.05),提示漢黃芩素可通過抑制細胞有絲分裂進程來抑制細胞的增殖。此外,漢黃芩素還能顯著誘導p53通路的活化及其下游促凋亡分子Bax的表達(P<0.05);而用p53通路抑制劑PFT-α預處理能夠顯著性降低漢黃芩素誘導的促卵巢癌細胞的凋亡效應(P<0.05)。結論漢黃芩素能通過抑制細胞有絲分裂進程及調控p53促凋亡通路的活化來抑制卵巢癌細胞的增殖,同時顯著誘導細胞大量凋亡,提示漢黃芩素可能具有一定的抗卵巢癌活性,從而為進一步探討其作為臨床治療卵巢癌的潛在藥物奠定理論基礎。
卵巢癌;漢黃芩素;增殖;凋亡;細胞周期
漢黃芩素(wogonin,別名5,7-二羥基-8-甲氧基-2-苯基-4H-1-苯并呋喃-4-酮)是從中藥黃芩根及半枝蓮中提取的活性物質,具有抗病毒、抗菌、保護血管、降血脂及利膽、解痙等生物活性[1-4]。近年來,漢黃芩素在抗腫瘤中的作用得到廣泛關注。研究表明,漢黃芩素能夠有效地抑制多種癌細胞的生長,同時誘導腫瘤細胞的大量凋亡[4-5]。但是,漢黃芩素對卵巢癌細胞的影響及其機制尚不清楚。因此,本研究體外觀察漢黃芩素對卵巢癌細胞HO-891增殖及凋亡的影響,并探討相關的作用機制,從而為進一步探討其在臨床中的應用提供理論依據。
1 材料與方法
1.1 材料
人卵巢癌HO-8910細胞株購自南京凱基生物科技發展有限公司;胎牛血清和MTT購自華美生物工程有限公司;p53抑制劑PFT-α購自Calbiochem公司;AnnexinⅤ/PI雙染凋亡檢測試劑盒購自BD公司;兔抗人p53、p21和Bax多克隆抗體均購自美國Santa Cruz公司;兔抗人cyclin B1抗體和小鼠抗兔-HRP標記抗體均購自Cell Signaling公司。
1.2 方法
1.2.1 細胞培養與處理將人卵巢癌HO-8910細胞株置于含10%滅活胎牛血清、100 U/mL青霉素和100 g/mL鏈霉素的RPMI1640培養基中,37℃、5%CO2孵箱中培養。每1~2天換液1次,2~3 d傳代1次。將對數生長期的HO-8910細胞接種于24孔板,每孔200 μL,含1×105個細胞。細胞中分別加入20、50、80、100、130 μg/mL的漢黃芩素,培養48 h后進行相關實驗,空白處理為空白對照組。用100 μg/mL的漢黃芩素處理細胞,48 h后用25 μmol/L的p53抑制劑PFT-α處理細胞,2 h后進行細胞凋亡實驗。
1.2.2 MTT法檢測細胞增殖能力不同濃度漢黃芩素處理細胞48 h后,向每孔加入20 μL MTT溶液(5 mg/mL),繼續培養4 h后棄上清;加入150 μL DMSO(二甲基亞砜),置于搖床上低速振蕩10 min,充分溶解結晶物;酶標儀上測定490 nm處OD值。細胞存活率=(實驗組A490值-空白調零組A490值)/(空白對照組A490值-空白調零組A450值)×100%
1.2.3 AnnexinⅤ/PI檢測細胞凋亡收集預處理細胞,用預冷的PBS洗滌3次后加入1 mL 1×AnnexinⅤ結合緩沖液,4℃1000 r/min離心10 min去上清;加入200 μL結合緩沖液重懸細胞,隨后分別加入10 μL AnnexinⅤ-FITC和5 μL PI(5 μg/mL)進行標記,輕輕混勻;避光孵育30 min,將細胞置于流式細胞儀中檢測細胞凋亡情況。具體操作按說明書進行。
1.2.4 Western blotting檢測蛋白表達用0.05%胰蛋白酶消化細胞,PBS洗滌3次;200 μL預冷的裂解液裂解細胞,冰上放置20 min,4℃12 000 r/min離心10 min,取上清。樣品煮沸處理后,進行SDS-PAGE蛋白電泳;采用半干轉法將目的蛋白轉移到硝酸纖維素膜上,用5%脫脂奶粉封閉,按照常規的方法加入兔抗人p21、cyclin B1、p53及Bax一抗和HRP標記的小鼠抗兔的二抗。ECL底物顯色,觀察p21、cyclin B1、p53及Bax的表達水平。
1.3 統計學方法
采用SPSS 13.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗;兩組間比較采用t檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1 漢黃芩素對HO-8910細胞增殖的影響
MTT法分析顯示,與空白對照組相比,漢黃芩素對卵巢癌細胞HO-8910的生長具有抑制作用,且隨著劑量的加大,細胞的生長速率明顯降低,其中,80、100、130 μg/mL漢黃芩素作用48 h時,細胞的存活率分別為(61.4±4.2)%、(55.8±5.8)%、(42.7±6.7)%,與空白對照組比較,差異有統計學意義(P<0.05)。見圖1。
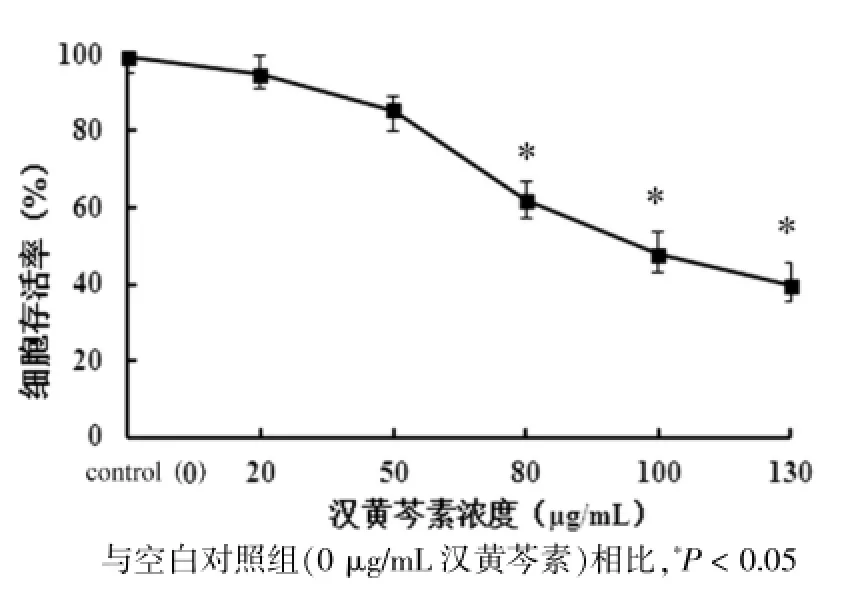
圖1 漢黃芩素對HO-8910細胞增殖的影響
2.2 漢黃芩素對HO-8910細胞凋亡的影響
流式分析顯示,與空白對照組相比,漢黃芩素處理組中Q2和Q4區熒光強度不斷增加,表明漢黃芩素能夠誘導HO-8910細胞大量凋亡(圖2A)。定量分析表明,用50、100 μg/mL漢黃芩素處理后,細胞的凋亡率分別為(27.2±2.5)%和(45.1±3.8)%,與空白對照組比較,差異有統計學意義(P<0.05或P<0.01)(圖2B),提示漢黃芩素劑量依賴性地誘導HO-8910細胞的凋亡。
2.3 漢黃芩素對HO-8910細胞周期蛋白cyclin B1和細胞周期蛋白依賴性激酶抑制因子p21表達的影響
Western blotting分析表明,與空白對照組相比,漢黃芩素劑量依賴性地上調細胞周期蛋白依賴性激酶抑制因子p21的表達,同時細胞周期蛋白cyclin B1的表達明顯下調(圖3A)。定量分析證實,分別用50 μg/mL和100 μg/mL漢黃芩素處理48 h后,p21的表達水平分別上調至空白對照組的2.50倍和3.82倍(P<0.01);而cyclin B1的表達水平分別下降至空白對照組的0.78倍和0.52倍(P<0.05)(圖3B),表明漢黃芩素可劑量依賴性地抑制HO-8910細胞DNA的合成。
2.4 漢黃芩素對p53通路的影響
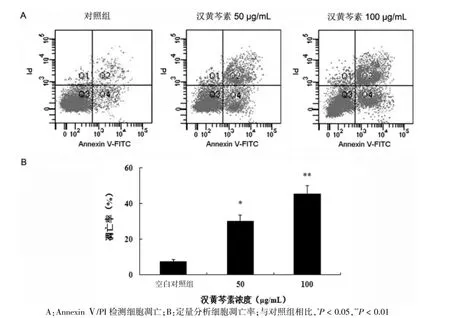
圖2 漢黃芩素對HO-8910細胞凋亡的影響
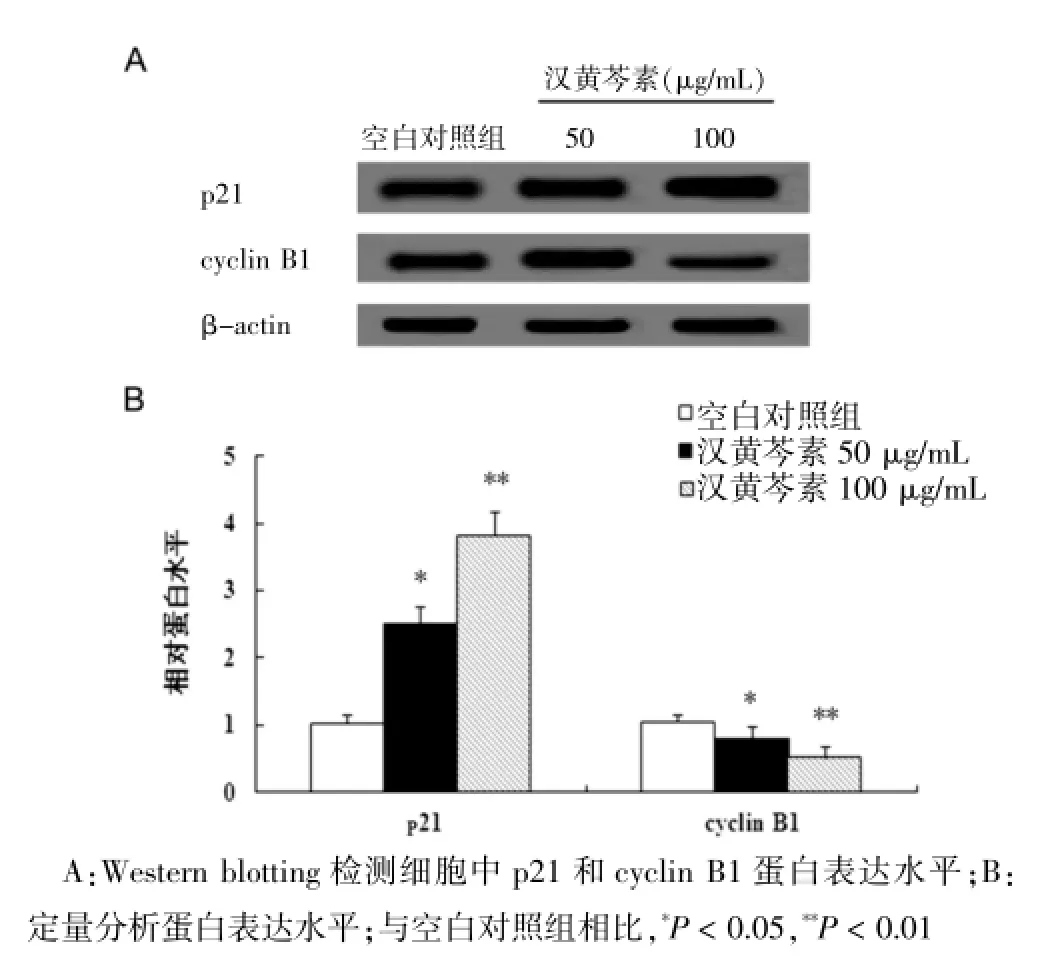
圖3 Western blotting分析p21和cyclin B1蛋白表達水平
結果證實,100 μg/mL漢黃芩素處理48 h后,細胞中p53表達水平明顯增高,同時其下游促凋亡分子Bax蛋白的表達水平顯著性上調(圖4A);定量分析表明,與空白對照組相比,100 μg/mL漢黃芩素處理后p53和Bax的表達水平分別增加了3.8和2.7倍(P<0.05),提示漢黃芩素能夠誘導HO-8910細胞中p53通路的活化(圖4B)。進一步機制分析表明,25 μmol/L的p53抑制劑PFT-α處理2 h后,漢黃芩素誘導的HO-8910細胞的凋亡率明顯下降,與漢黃芩素單獨處理組相比,下降了100%,差異有統計學意義(P<0.05)(圖4C)。
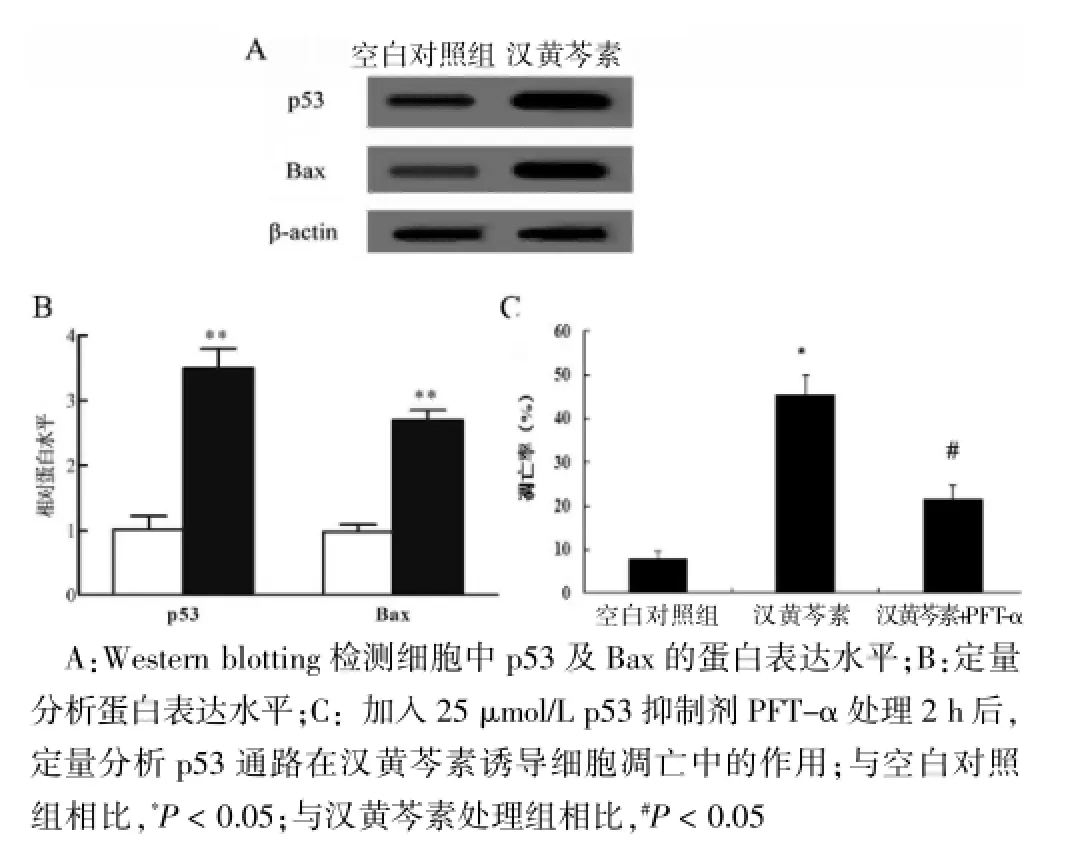
圖4 漢黃芩素對p53通路的影響
3 討論
卵巢癌是一種致死率最高的常見惡性婦科腫瘤,具有較高的增殖及遷移速率[6-8]。傳統的手術、化療、放療及綜合治療等方法雖然在卵巢癌患者的治療中得到廣泛應用,但并不能提高晚期卵巢癌患者預后5年生存率,且伴隨有化療耐藥及嚴重的藥物毒副作用等缺點[9]。因此,尋求新型高效、低毒抗癌藥物成為卵巢癌治療研究的熱點之一。
黃酮類化合物具有廣泛的抗炎、抗病毒、解熱等功效,越來越多的研究證實,黃酮類化合物具有潛在的抗腫瘤特性[10-12]。漢黃芩素是一種典型的黃酮類化合物,具有來源廣泛、價格低廉、無毒副作用等優點,可發揮抗感染、抗血栓和抑制腫瘤等功能[13-15]。研究證實,漢黃芩素不僅能夠制黑素瘤細胞的侵襲,還可通過調控多種信號通路發揮抗肺癌細胞生長的功效[5,16]。但是,漢黃芩素對卵巢癌細胞生理特性的影響及其機制尚不清楚。
本研究證實,漢黃芩素可劑量依賴性地抑制卵巢癌細胞增殖,同時誘導細胞大量凋亡。多項研究證實,許多抗癌藥可通過阻斷癌細胞的細胞周期來抑制細胞的增殖進程,進而發揮細胞生長抑制效應[17-20]。已知細胞周期蛋白依賴性激酶CDK能夠調控DNA的復制及有絲分裂過程,而p21作為CDK1的抑制劑,能夠阻止細胞向G2/M期的過渡,抑制DNA合成。細胞周期蛋白cyclin B1能夠與CDK1結合,觸發細胞有絲分裂進程。當用漢黃芩素處理后,細胞中p21的表達水平顯著性增加,同時cyclin B1表達水平明顯下降,表明漢黃芩素能夠通過阻斷細胞有絲分裂進程來抑制卵巢癌細胞的增殖。已知p53及其下游的促凋亡分子Bax在調控細胞凋亡的過程中起著重要作用。本研究證實,漢黃芩素處理后,卵巢癌細胞HO-8910中p53的表達水平明顯增高,同時誘導p53下游促凋亡分子Bax表達的上調。進一步分析表明,阻斷p53通路后,漢黃芩素誘導的卵巢癌細胞凋亡率明顯下降,提示漢黃芩素可能通過p53通路的活化來誘導細胞凋亡。因此,本研究證實了漢黃芩素能夠通過抑制細胞周期進程及促凋亡通路的活化來調節卵巢癌細胞的增殖和凋亡,從而為進一步討論其在卵巢癌治療中的應用奠定理論基礎。但是,漢黃芩素如何調控細胞周期及活化p53促凋亡通路的作用機制尚不清楚,還有待于進一步研究。
[1]Bak EJ,Kim J,Choi YH,et al.Wogonin ameliorates hyperglycemia and dyslipidemia via PPARα activation in db/db mice[J].Clin Nutr,2014,33(1):156-163.
[2]Takagi R,Kawano M,Nakagome K,et al.Wogonin attenuates ovalbumin antigen-induced neutrophilic Airway inflammation by inhibiting Th17 differentiation[J].Int J Inflam,2014,14:571508.
[3]Song X,Zhou Y,Zhou M,et al.Wogonin influences vascular permeability via Wnt/β-catenin pathway[J].Mol Carcinog,2013,[Epub ahead of print].
[4]Zhang M,Liu LP,Chen Y,et al.Wogonin induces apoptosis in RPMI 8226,a human myeloma cell line,by downregulating phospho-Akt and overexpressing Bax[J].Life Sci,2013,92(1):55-62.
[5]Chen XM,Bai Y,Zhong YJ,et al.Wogonin has multiple anti-Cancer effects by regulating c-Myc/SKP2/Fbw7α and HDAC1/HDAC2 pathways and inducing apoptosis in human lung adenocarcinoma cell line A549[J].PLos One,2013,8(11):e79201.
[6]Chen T,Jansen L,Gondos A,et al.Survival of ovarian cancer patients in Germany in the early 21st century:a period analysis by age,histology,laterality,and stage[J].Eur J Cancer Prev,2013,22(1):59-67.
[7]Matsuo K,Yoshino K,Hiramatsu K,et al.Effect of lymphovascular space invasion on Survival of stageⅠepithelial ovarian cancer[J].Obstet Gynecol,2014,123(5):957-965.
[8]Lengyel E.Ovarian cancer development and metastasis[J]. Am J Pathol,2010,177(3):1053-1064.
[9]Naora H,Montell DJ.Ovarian cancer metastasis:integrating insights from disparate model organisms[J].Nat Rev Cancer,2005,5(5):355-366.
[10]林春蕾,郭傳勇.白藜蘆醇抗肝癌作用研究[J].中國醫藥導報,2013,10(6):22-24.
[11]Lin Y,Yngve A,Lagergren J,et al.A dietary pattern rich in lignans,quercetin and resveratrol decreases the risk of oesophageal cancer[J].Br J Nutr,2014,27:1-8.
[12]Tameda M,Sugimoto K,Shiraki K,et al.Resveratrol sensitizesHepG2 cells to TRAIL-induced apoptosis[J]. Anti-Cancer Drugs,2014,25(9):1028-1034.
[13]LeeW,KuSK,BaeJS.Anti-inflammatoryeffectsofbaicalin,baicalein,and wogonin in vitro and in vivo[J].Inflammation,2014,[Epub ahead of print].
[14]Ku SK,Bae JS.Antithrombotic activities of wogonin and wogonoside via inhibiting platelet aggregation[J].Fitoterapia,2014,98:27-35.
[15]Zhao K,Song X,Huang Y,et al.Wogonin inhibits LPS-induced tumor angiogenesis via suppressing PI3K/Akt/ NF-κB signaling[J].Eur J Pharmacol,2014,737:57-69.
[16]Zhao K,Wei L,Hui H,et al.Wogonin suppresses melanoma cell B16-F10 invasion and migration by inhibiting rasmedicated pathways[J].PLos One,2014,9(9):e106458.[17]Liu E,Kuang Y,He W,et al.Casticin induces human glioma cell death through apoptosis and mitotic arrest[J]. Cell Physiol Biochem,2013,31(6):805-814.
[18]Casella ML,Parody JP,Ceballos MP,et al.Quercetin prevents liver carcinogenesis by inducing cell cycle arrest,decreasing cell proliferation and enhancing apoptosis[J]. Mol Nutr Food Res,2014,58(2):289-300.
[19]Tian D,Narayanan B,Mazumder A,et al.Abstract B27:Tripterine induced cell cycle arrest and apoptosis is associated with modulation of PI3K-AKT-mTOR pathway in human pancreatic cancer cell[J].Cancer Prev Res,2013,6(11 Supplement):B27.
[20]Guo H,Xu YM,Ye ZQ,et al.Curcumin induces cell cycle arrest and apoptosis of prostate cancer cells by regulating the expression of IκBα,c-Jun and androgen receptor[J].Pharmazie,2013,68(6):431-434.
Effect of wogonin on the proliferation and apoptosis of ovarian carcinoma HO-8910 cells
CHEN Lijun1WANG Juan2LI Jia3WANG Jian3
1.Department of Obstetrics and Gynecology,Fuping County Hospital in Weinan City,Shaanxi Province,Fuping 711700,China;2.Department of Obstetrics and Gynecology,the First Affiliated Hospital of School of Medicine of Xi'an Jiaotong University,Shaanxi Province,Xi'an710004,China;3.Department of Obstetrics and Gynecology,Xijing Hospital,Fourth Military Medical University,Shaanxi Province,Xi'an710032,China
ObjectiveTo explore the role and underlying molecular mechanism of wogonin on the proliferation and apoptosis of ovarian carcinoma HO-8910 cells.MethodsFollowing the stimulation with various doses of wogonin(0, 20,50,80,100,130 μg/mL)for 48 h,MTT colorimetry was used to detect cell proliferation rate.Cell apoptosis was analyzed using double staining with AnnexinⅤand propidium iodide(AnnexinⅤ/PI).The expression levels of p21, cyclin B1,p53 and Bax were assessed by Western blotting.ResultsWogonin dampened ovarian carcinoma HO-8910 cell proliferation and promoted the apoptosis rates in a dose-dependent manner(P<0.05).Moreover,wogonin dosedependently down-regulated the expression levels of cell cycle protein cyclin B1,as well as the up-regulation of p21 expression levels(P<0.05),suggesting that wogonin might inhibit cell growth by suppressing cell cycle.Additionally, an obvious increase in p53 and its downstream Bax was observed in HO-8910 cell stimulated with wogonin statistically (P<0.05).However,this up-regulation was dramatically attenuated when preconditioning with p53 inhibitor PFT-α(P<0.05).ConclusionWogonin can abrogate HO-8910 cell proliferation and enhance cell apoptosis by regulating cell mitosis and apoptosis-related p53 pathway,implying as potential suppressor for ovarian cancer.Therefore,this study will support its potential targets for further development of anti-ovarian cancer therapy.
Ovarian cancer;Leptin;Proliferation; Apoptosis;Cell cycle
R737.31
A
1673-7210(2015)02(b)-0004-05
2014-11-05本文編輯:程銘)
國家自然科學基金項目(編號81172458/H1621)。
陳麗君(1980-),女,陜西富平人,碩士;研究方向:婦科腫瘤。
王建(1962-),男,碩士,主任醫師;研究方向:婦科腫瘤。

