CKD 3 ~5 期患者外周血T 淋巴細胞CD154 表達能力的變化
楊 濤 王惠明 顏 奇 丁國華
慢性腎臟病(CKD)患者隨著腎功能的減退,將不可逆的向終末期腎病進展,需腎臟替代治療。研究顯示CKD 3 期后的患者病死率逐漸升高,死亡原因中感染占第2 位[1]。慢性腎臟病患者感染呈現發生率高、易反復、病情重、病死率高等特點,免疫功能紊亂是患者感染的重要因素。尿毒癥患者的免疫功能下降與尿毒癥狀態下各種免疫細胞的功能異常相關,這些免疫細胞包括:中性粒細胞、單核細胞、巨噬細胞、NK 細胞、T/B 淋巴細胞等[2]。這些免疫細胞可表現為絕對數量的異常、分泌各種細胞因子的異常、表面受體/配體的表達異常,它們之間的相互影響、相互作用促成尿毒癥患者免疫功能的異常。
CD40 分子屬于腫瘤壞死因子受體(TNFR)超家族的Ⅰ型跨膜糖蛋白,主要表達于不同分化階段的B細胞、造血前體細胞、單核- 吞噬細胞、樹突狀細胞(DC)和多種不同組織來源的腫瘤細胞等。CD154 是CD40 分子的配體(CD40L),CD154 也稱gp39、腫瘤壞死因子相關激活蛋白(TRAP)、T 細胞-B 細胞活化分子(T-BAM),為33kDa 的Ⅱ型跨膜糖蛋白,共有266aa,其中胞膜外區214 個氨基酸,與TNF 在氨基酸水平具有較高的同源性。CD154 主要表達于活化的CD4+T 淋巴細胞,部分活化的CD8+T 細胞、嗜堿性粒細胞、肥大細胞、NK 細胞也有表達。活化T細胞膜表達CD154 與CD40 的結合,為T/B 細胞活化提供必需的第二信號,對B 細胞的激活、增殖、同型轉換、漿細胞抗體的表達,對T 細胞活化增殖,對抗原遞呈細胞的成熟等均有有著重要的臨床意義[3~6]。Contin 等[7]研究顯示抑制B 細胞上CD40 與配體CD154 的結合,可導致B 細胞分泌的免疫球蛋白減少。目前尚無CKD 3 ~5 期患者T 細胞CD154 表達變化的相關報道。本研究針對慢性腎臟病患者T 細胞上CD154 的表達,從T 細胞角度探討了CKD 3 ~5期患者的免疫功能紊亂。
資料與方法
1.一般資料:選取健康人為對照組,CKD 3 ~5 期未透析患者、CKD5 期透析患者為實驗組,檢測各組受試者外周血T細胞比例、活化T 細胞CD154 的表達。實驗組納入標準:慢性腎臟病3 ~5 期未透析患者;透析組選取血液透析或腹膜透析超過6 個月患者。實驗組排除標準:①合并有糖尿病或原發病為糖尿病腎病患者,系統性紅斑狼瘡等風濕性疾病所致腎衰竭患者,腎臟淀粉樣變患者,腫瘤患者;②近期合并感染性疾病、消化道出血、嚴重心腦血管疾病患者;③CKD 并發急性腎損傷患者。健康人群17 人(男性/女性為10/7),患者平均年齡50.18±3.36 歲;未透析組30 人(男性/女性為19/11),患者平均年齡56.10±3.06 歲;透析組20 人(男性/女性為12/8),患者平均年齡53.10±3.78 歲,年齡、性別比較差異無統計學意義(P <0.05)。
2.主要試劑及儀器:紅細胞裂解液購自美國Biolegend 公司;淋巴細胞分離液購自中國達科為公司;鼠抗人的PE antihuman CD40L、FITC anti - human CD3、APC anti -human CD8及同型對照購自美國Biolegend 公司;離子霉素(Inomycin)及佛波酯(PMA)購自美國Alexis 公司;流式細胞儀為BD Accuri C6。
3.檢測方法:活化CD4+T 淋巴細胞及表面CD154 的檢測:采用肝素抗凝管留取受試者外周血,取全血200μl 加入RPMI 1640 培養基800μl,加入離子霉素(1μg)+佛波酯(50ng),孵育5h,采用紅細胞裂解液裂解紅細胞后,運用Biolegend 公司的PE anti-human CD154、FITC anti -human CD3、APC anti -human CD8 及同型對照染色,流式細胞儀分析。取2ml 全血運用淋巴細胞分離液獲取PBMC,一部分同上直接染色,流式細胞儀分析,另一部分運用流式細胞儀計數,按2 ×106/ml 比例加入1640 完全培養基(加有10% 的小牛血清),加入離子霉素(1μg)+佛波酯(50ng),孵育5h,染色后流式細胞儀分析。
4.統計學方法:采用SPSS 17.0、GraphPad Prism、BD Accuri C6 自帶軟件進行數據處理、做圖,多組間比較采用單因素方差分析,兩變量之間的相關關系采用一元線性相關分析,實驗組與正常組配對做t 檢驗,以P <0.05 為差異有統計學意義。
結 果
1.各組外周血T 細胞頻率比較:相對于對照組,CKD 3 ~5 期未透析組患者外周血淋巴細胞中T 細胞頻率下降,差異有統計學意義(P <0.05);CKD5 期透析組較對照組及未透析組差異均無統計學意義(對照組為72.05% ±2.65%;未透析組為63.06% ±3.37%;透析組為68.92% ±3.22%)(P <0.05,圖1)。
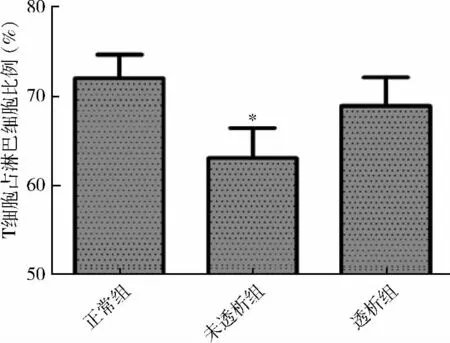
圖1 各組外周血淋巴細胞中T 淋巴細胞表達頻率
2. 各組受試者外周血CD3+CD8-T 細胞上CD154 的比較:未活化的T 細胞在各組均未見CD154明顯表達;運用離子霉素聯合佛波脂刺激T 細胞后可見CD154 的表達上調。各組全血提取PBMC 后再刺激,實驗組CD3+CD8-T 細胞上CD154 表達較對照組差異無統計學意義(對照組65.33% ±3.00%;未透析組59.72% ±3.01%;透析組65.53% ±1.63%);各組全血刺激后,CKD 3 ~5 期未透析組CD3+CD8-T 細胞CD154 表達下降(P = 0. 037),維持性透析組CD3+CD8-T 細胞上CD154 的表達較對照組差異無統計學意義(對照組79.78% ± 2. 00%;未透析組73.61% ± 1. 91%;透析組78. 94% ± 2.47%,P <0.05,詳見圖2、圖3。
討 論
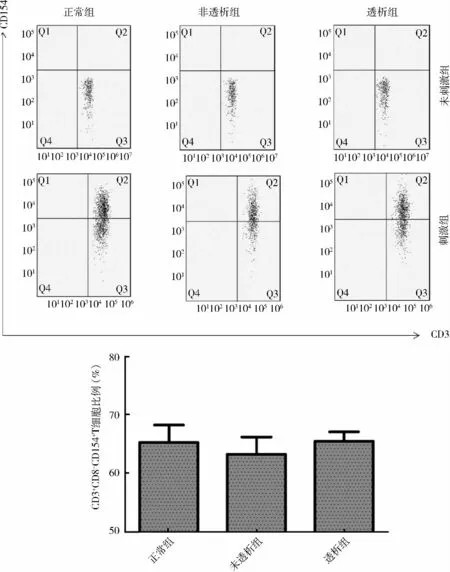
圖2 各組PBMC 刺激后CD3 +CD8 - CD154 + T 細胞占CD3 +CD8 - T 細胞頻率
健康人外周血淋巴細胞中T 細胞比例為70% ~80%。本研究顯示,相對于對照組CKD 3 ~5 期未透析患者存在淋巴細胞比例下降,透析后比例恢復正常,說明在非透析患者中存在影響T 細胞比例的因素。在運用離子霉素及佛波酯激活T 細胞過程中,CD4+T 細胞表面的CD4 的表達下調,故本研究檢測CD8-T 細胞代表CD4+T 細胞。實驗中可見各組外周血在去除血漿及其他細胞的影響后(提取PBMC),其活化的CD3+CD8-T 淋巴細胞上CD154 表達差異無統計學意義;而在全血刺激后,CKD 3 ~5 期未透析組CD3+CD8-T 細胞CD154 表達明顯下調,維持性組CD154 表達恢復。此現象說明,在CKD 3 ~5 期未透析患者中,存在抑制CD154 表達的因素。
Yoon 等[8]報道尿毒癥患者毒素蓄積(如氮質血癥、氧化應激、糖基化終末產物、鐵的超負荷、炎癥)所致幼稚T 細胞、記憶T 細胞凋亡、耗損增加。本實驗中CKD 3 ~5 期患者外周血T 細胞頻率下降與之相關。CKD 3 ~5 期未透析患者外周血同時存在T 細胞比例下降,膜表面CD154 的表達下調,可能影響了患者T 細胞介導的細胞免疫和體液免疫功能。透析后患者T 細胞表達頻率及膜表面CD154 表達恢復可能與相關抑制因素清除相關。有研究顯示,炎性細胞中也可見CD154 與CD40 的表達,這些炎性細胞也可能會影響到細胞活化,刺激CD154 的表達;維持性透析中,機體會接觸各種異體物質,可能刺激炎癥產生,上調了T 細胞上CD154 的表達[9]。本實驗中未明確影響T 細胞CD154 表達能力的具體因素,但慢性腎臟病患者存在各種尿毒癥毒素的蓄積,推測其表達下調可能為各種毒素協同所致。
綜上所述,CKD 3 ~5 期未透析患者存在T 細胞的頻率下降,同時伴有CD3+CD4+T 細胞CD154 的表達能力下降,可能是患者免疫力下降、容易感染的重要原因。
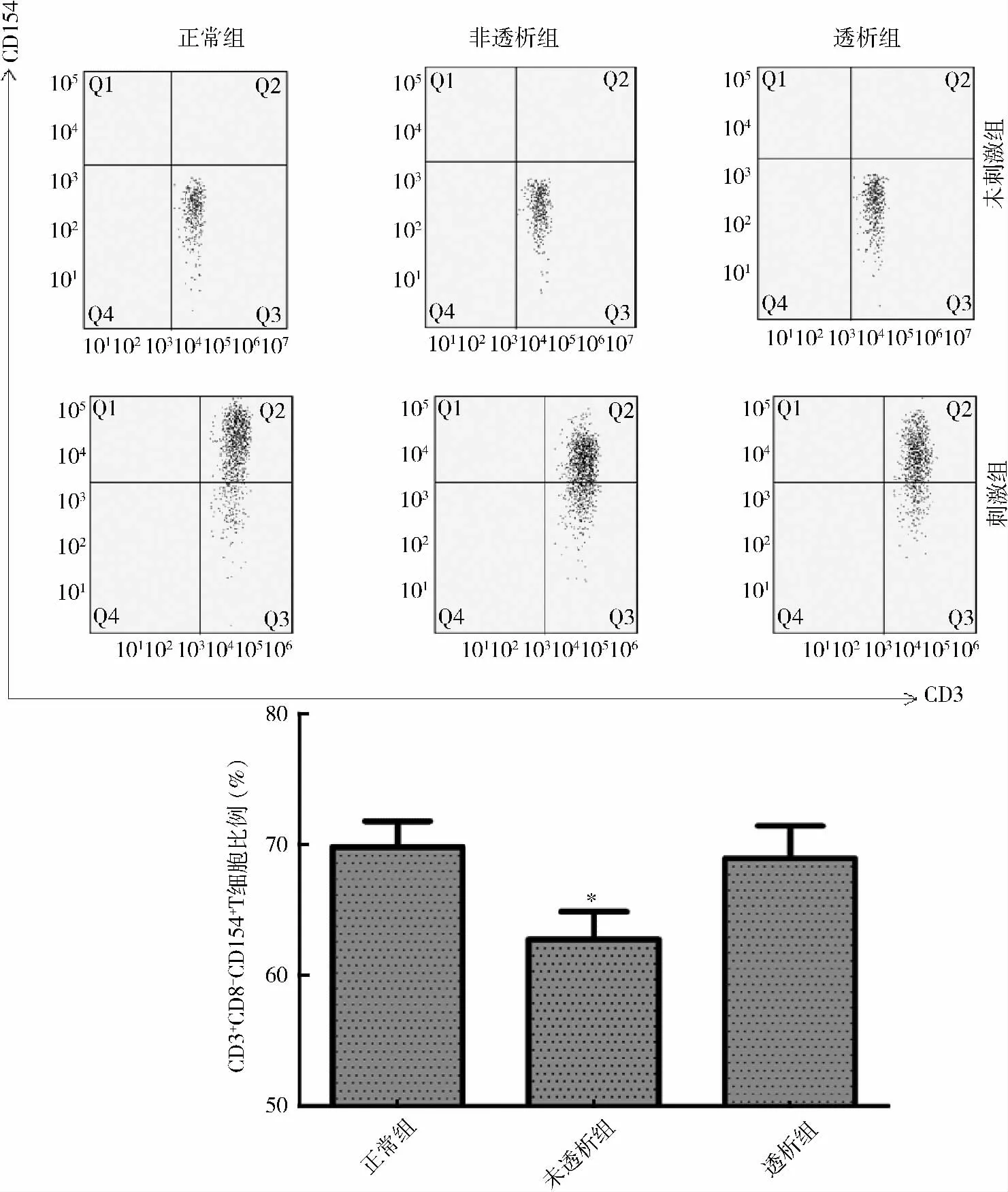
圖3 全血刺激后各組CD3 +CD8 - CD154 + T 細胞占CD3 +CD8 - T 細胞頻率
1 Kato S,Chmielewski M,Honda H,et al.Aspects of immune dysfunction in end- stage renal disease[J]. Clin J Am Soc Nephrol,2008,3:1526 -1533
2 Eleftheriadis T,Antoniadi G,Liakopoulos V,et al. Disturbances of acquired immunity in hemodialysis patients[J]. Semin Dial,2007,20:440 -451
3 Durie FH,Foy TM,Masters SR,et al. The role of CD40 in the regulation of humoral and cell - mediated immunity[J]. Immunol Today,1994,15:406 -411
4 Klaus SJ,Berberich I,Shu G,et al. CD40 and its ligand in the regulation of humoral immunity[J]. Semin Immunol,1994,6:279 -286
5 Schonbeck U,Libby P. The CD40/CD40L receptor/ligand dyad[J].Cell Mol Life Sci,2001,58 (1):4 -43
6 O'Sullivan B,Thomas R. CD40 and dendritic cell function[J]. Crit Rev Immunol,2003,23:83 -107
7 Contin C,Pitard V,Delmas Y,et al. Potential role of soluble CD40 in the humoral immune response impairment of uraemic patients[J]. Immunology,2003,11:131 -140
8 Yoon J,Gollapudi S,Pahl M,et al. Na?ve and Central Memory T -cell lymphopenia in endstage renal disease[J]. Kidney Int,2006,70:371 -376
9 Rizvi M,Pathak D,Freedman JE,et al. CD40 -CD40 ligand interactions in oxidative stress,inflammation and vascular disease[J]. Trends Mol Med,2008,14:530 -538

