鈍頂螺旋藻固定二氧化碳效率的研究
王 霞,張 濤,童 丹
(湖北工業大學輕工學部資源與環境工程學院,湖北 武漢430068)
CO2是引起全球變暖的主要溫室氣體[1],而微藻固碳是目前最有效、環保的固碳方法[2]。用于CO2減排的微藻種類很多,如葡萄藻、小球藻、柵藻、衣藻、螺旋藻等[3]。而鈍頂螺旋藻可生產蛋白質、維生素、不飽和脂肪酸、色素、多糖等高附加值產品,且繁殖速度快,戶外大規模生產技術已經非常成熟,微藻吸收CO2一般為200~600mg/(L·d),而小球藻可達800~1 000mg/(L·d)[3]。本文通過試驗了解鈍頂螺旋藻生命規律,探索其生長及固碳最優生長條件,在吸收高濃度CO2下,同時得到生長速率較高的螺旋藻,為其運用于凈化燃煤工業廢氣中高濃度CO2碳提供理論依據。
1 材料和方法
1.1 藻種
鈍頂螺旋藻(Spirulina platensis),來源于湖北工業大學輕工學部微藻實驗室。
1.2 微藻培養
用自來水配制Zarrouk培養基[4],戶外自然條件下(湖北工業大學輕工學部樓頂)培養螺旋藻至對數期接種進行實驗。本研究采用自制光反應器,6個圓底透明玻璃瓶(10L,直徑22cm)串聯,形成相對密閉裝置。利用通氣泵鼓氣將空氣注入各反應器底部,使空氣充分與藻液接觸。

圖1 光生物反應器
1.3 室外溫度、光照、通氣流量的測定
用溫度計每天定時測量反應器內外溫度,全天光照強度使用自動在線光照檢測儀每5min自動測定1次,用流量計測量通氣流量。
1.4 生長參數及pH、NaHCO3含量的測定
收集適量藻液,用560nm紫外分光光度計測量藻細胞光密度(OD),用膜法測量細胞干重[5],甲醇法測量細胞葉綠素a含量[6]。培養過程中,用德國默克pH試紙測量各反應器藻液pH。用雙指示劑中和法[7]測量 NaHCO3濃度。
1.5 二氧化碳濃度的測定及固碳質量的計算
每天定時收集每個(0#~5#)反應器出氣口的氣體并測定氣體流量,用GC/MSD測量氣體樣品中CO2含量。

所測得的CO2質量分數按如下公式轉換為CO2質量式中:mO2為CO2質量,g;w 為CO2的質量分數,10-6;v為空氣泵通氣速率,L/h;Q為每天通氣時間,h;M 為CO2的摩爾質量,g/mol;T 為培養天數,d。
1.6 GC/MS分析
采用安捷倫7890A/5975C氣相色譜-質譜聯用儀,色譜柱為GS-GasPro(30m×0.323mm,專有鍵合硅膠);載氣 He,純度大于99.999%,恒流2.1 mL/min;柱箱初始溫度為26℃,保持5min,以5℃/min上升到80℃,保持2min,再以4℃/min上升到220℃;進樣口壓力19 443.9Pa,分流比為50∶1,進樣體積為500μL。質譜條件:電離方式為EI,70eV;傳輸線溫度280℃;離子源溫度為230℃,四級桿溫度為150℃。利用不同質量分數CO2氣體所做標準曲線計算樣品中CO2含量。
2 結果
2.1 戶外條件下鈍頂螺旋藻生長情況
根據每天定時取樣測量的螺旋藻生長參數數據顯示,1#~5#反應器中藻的生長參數(OD、干重、葉綠素α)數值,隨著培養時間的加長均逐漸增加,但相互之間無明顯差別(圖2a、b、c)。在培養過程中,濁度從0.37升至3.93,干重從0.16g/L升至1.88g/L,葉綠素α的含量由2.73mg/L升至21.00mg/L。圖2c表明在培養過程的前7天,各反應器中藻液pH均緩慢升高至10.5;第7天后各瓶藻液pH高達12.5,其中5#反應器上升速率較為明顯。
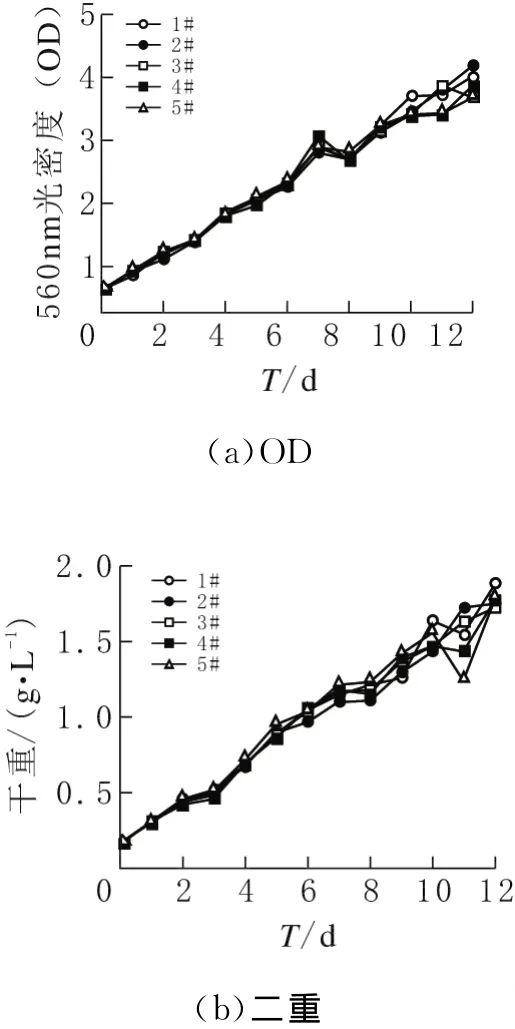

圖2 螺旋藻OD、干重、葉綠素a、pH隨時間變化
螺旋藻是光合自養生物,即白天吸收CO2進行光合作用生長繁殖。根據本研究自制光的反應裝置設計,1#~5#反應器中唯一單因素變量為進入各個培養瓶藻液CO2含量的不同(由于1#~5#反應器串聯連接,空氣從1#進氣口進入該反應器,其藻液吸收空氣中一部分CO2。該氣體從1#出氣口進入2#進氣口;依次類推各反應器藻液對空氣中CO2均有不同程度的吸收,導致進入各培養瓶藻液CO2含量不同)。然而螺旋藻的碳源不僅是空氣中的CO2,還有Zarrouk培養基中的NaHCO3,后者含量高達16.8g/L遠遠高于空氣中 CO2(約0.4%)。螺旋藻對空氣中CO2利用,所占碳的利用量比例小得多,同時此階段培養基中pH低于10(圖2d)[7],導致各瓶生長無明顯差別。
鈍頂螺旋藻進入生長對數期后,其藻液pH隨生長而緩慢增加。在第5天后,各反應器中培養基不再釋放CO2,由于通入各反應器(1#~5#)的CO2逐漸減少,可能使CO2在降低pH的能力方面逐漸降低,導致5#~1#pH依次逐漸升高。
2.2 螺旋藻吸收CO2變化
在試驗過程中,每天定時測量各培養瓶出氣口CO2體積分數。由圖3可見,在培養過程的前4天,各培養瓶出氣口CO2的量遠遠高于空氣中的CO2的量,最大相差14倍。第4天開始,各瓶螺旋藻開始吸收CO2。整個實驗裝置中藻液幾乎能完全固定空氣中的CO2。經計算,每個反應器藻液固定空氣中40%的CO2。同時接種前期,戶外晴天(溫度約35℃,光照強度約800μmol/(m2·s)從培養基釋放CO2的時間將縮短。
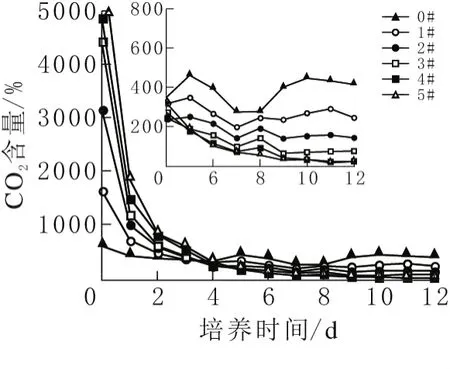
圖3 各反應器進出口二氧化碳含量變化
試驗中前4天出氣口CO2濃度高,是因為瓶內培養基部分NaHCO3轉化為CO2并釋放出來。Zarrouk培養基pH僅為9,在低pH時HCO3-=CO2+ OH-的平衡向右移動(占優勢)[14],同時培養前4天螺旋藻正處于適應期,光合作用利用CO2的效率有所降低,藻液水溫較高,CO2溶解度大大減小,導致CO2大量釋放。從試驗結果可知,大量NaHCO3轉化為CO2被浪費,大規模培養將適當減少接種培養基的NaHCO3用量,從而降低成本。
2.3 培養基中碳酸氫鈉使用量與剩余量關系
螺旋藻培養基Zarrouk[4]中,NaHCO3質量體積為16.8g/L。圖4柱狀圖中條紋部分為第12d培養基剩余NaHCO3的含量,白色部分為試驗中消耗NaHCO3的量。在戶外培養12天后,經滴定法得出1#~5#培養瓶培養基中剩余NaHCO3約為9.76 g/L,其消耗量僅為接種時的一半。

圖4 碳酸氫鈉剩余量與使用量的關系
空氣中CO2較燃煤產業廢氣中CO2濃度小得多。在CO2較低濃度時,一定量的鈍頂螺旋藻可以完全吸收。
在武漢夏季重復試驗中(特別是戶外溫度達到約40℃)發現,試驗后期,5#藻液pH逐漸升高,可達13,此時螺旋藻藻絲斷裂,藻液顏色由藍綠色依次漸變為棕綠色、棕色、橘黃色至藻細胞徹底死亡。這可能是由于溫度過高藻細胞中起光合作用的酶活性受到抑制甚至失活,同時培養基中碳酸氫鈉逐漸被消耗,降低了對藻液pH的調節作用,而通入的氣體中較少CO2(約0.05%),對pH的調節幾乎可以忽略。在戶外溫度較高(約40℃)的條件下,這種現象會依次在5#、4#、3#培養瓶中發生。
2.4 螺旋藻固定CO2與生物量增長關系
圖5中黑色條紋柱表示以螺旋藻開始吸收CO2為起始點,收獲時為終點的各瓶螺旋藻平均生物增長量。白色柱表示依然是螺旋藻開始吸收CO2為起始點,收獲時為終點螺旋藻平均固定CO2的量。在整個裝置中1#~5#藻液增長量的總和即“Total”表示。在試驗過程中,整個光生物反應器平均干重增長量可達0.14g/(L·d)。其中1#~5#瓶內平均生物增長量基本一致,而固定CO2的量逐漸降低,5#幾乎沒有固定CO2。整個裝置中1#~5#藻液固定空氣中CO2的總碳量為89mg/(L·d),即固定CO2量為326mg/(L·d)。螺旋藻平均生物增長量是固定氣體碳的量約為7.62倍。
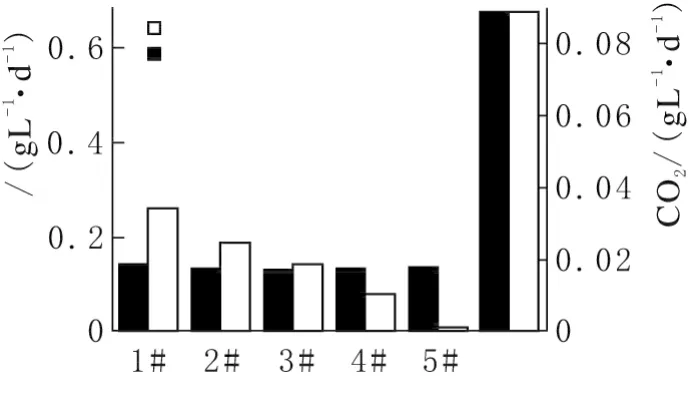
圖5 螺旋藻固定二氧化碳與生物量增長量之間關系
在螺旋藻生長過程中,各反應器中藻細胞生長幾乎沒有差別。1#~5#瓶內平均生物增長量基本一致。通氣氣體經過1#~4#培養瓶藻液,CO2依次被吸收,進入5#反應器之前,氣體中的CO2已經吸收完畢,則其藻液沒有吸收到CO2氣體,導致5#瓶藻液對空氣中CO2無固定。生物量增長量遠遠大于固體氣體碳量,主要是由于螺旋藻的主要碳源依然是培養基中NaHCO3。
3 結束語
利用營養豐富、蛋白質含量高的鈍頂螺旋藻,研究在密閉條件下CO2固定效率。由于培養基中高濃度的NaHCO3及pH低于10,試驗前期(第0~4天,夏季晴天時時間較短),有大量的CO2從培養基中溢出,之后藻液開始固定空氣中CO2。整個試驗裝置可以將空氣中CO2全部吸收固定,單一反應器藻液固定CO2效率為40%。實驗結果表明,在合適的光生物反應器中鈍頂螺旋藻固定CO2效率較高。培養過程中大量NaHCO3轉化為CO2溢出被浪費,適當減少NaHCO3用量,可降低成本,但導致培養基pH緩沖能力降低,可能影響螺旋藻的生長。該研究得出該自制光生物反應器固定CO2為326mg/(L·d),與報道的量200~600mg/(L·d)[5]相符。但本實驗戶外培養比報道研究室內培養更具有實際意義。利用微藻處理工業廢氣、廢水,可釋放大量氧氣,改善空氣質量,緩解全球溫室效應,獲得高附加值產品,在能源行業、環境保護、循環經濟方面都具有重大的意義。在后續研究中,將加大CO2通入濃度,進一步觀察在高濃度下鈍頂螺旋藻生長情況及固碳效率。
[1] Metz B,Davidson O,Coninck H C D,et al.Special report on carbon dioxide capture and storage[J].IPCC,2005,9(02):189-194.
[2] Lin C C,Liu W T,Tan C S.Removal of carbon dioxide by absorption in a rotating packed bed[J].Ind.Eng.Chem.Res.,2003,42:2 381–2 386.
[3] Shih-Hsin H,Chun-Yen C,Duu-Jong L,et al.Perspectives on microalgal CO2-emission mitigation systems[J].Biotechnology Advances,2011,29:189–198
[4] Zarrouk C J,Contribution a L′etude D′une Cianophycee:influence de divers facteurs physiques et chimiques sur la croissance et la photosynthese de spirulina maxima(setch.et garndner)geitler[M].Faculte des Sciences,Universite de Paris,1996.
[5] Zhu C J,Lee Y K.Determination of biomass dry weight of marine microalgea[J].Journal of applied phycology,1997,9(02):189-194.
[6] Bennett A,Bogorad L.Complementary chromatic adaptation in filamentous blue-green alga[J].The journal of cell biology,1973,58(02):419-435.
[7] 鮑士旦.土壤農化分析[M].北京:中國農業出版社,2000:157.
[8] Daniel de Alava,Paulo Corrêa de Mello,Klaus Wagener.The relevance of the CO2partial pressure of sodium bicarbonate solutions for the mass cultivation of the microalga spirulina[J].J.Braz.Chem.Soc.,1997,8(05):447-450.

