中國制藥企業歐盟GMP 認證現狀分析
郝曉芳,李鵬飛
(華北制藥河北華民藥業有限責任公司,河北 石家莊 052165)
2011 年3 月1 日,我國《藥品生產質量管理規范(2010 年修訂)》正式實施[1],執行標準基本等同于歐盟藥品生產質量管理規范(GMP)。2012 年2 月,國務院發布的《國家藥品安全“十二五”規劃》[2],明確提出對已經達到國際水平的制藥企業,在藥品定價、招標采購、醫保報銷等方面給予支持。從近兩年各省、市的藥品招標采購情況來看,該項政策已得到不同程度的落實。因此,從理論上分析,由于國內政策及法規變化的驅動,國內藥品生產企業進行國外高端GMP 認證的能力及動力均應有所提升。筆者通過分析中國制藥企業通過歐盟GMP 認證的實際數據,分析行業當前在國際高端GMP 認證方面的有關情況,為行業發展提供參考。
1 歐盟GMP 簡介
歐盟作為歐洲國家的政治經濟聯合體,在醫藥產品方面也采取了相應的統一管理措施。Eudralex 是歐盟發布的一系列關于藥物管理的規則和規章,共10 冊,其中第4 冊是關于GMP 的有關要求。第1 版歐盟GMP 發布于1989 年,現已經過1992 年、2004 年、2005 年及2010 年4 次修訂。
歐盟GMP 依據2003 /94/EC 號指令(關于人用藥)及91/412 /EEC 號指令(關于獸用藥)制訂,共分3 個部分:第1 部分為藥品生產的基本要求,介紹了藥品生產中采用GMP 管理的基本原則;第2 部分為原料藥生產的基本要求,基于原料藥生產與制劑生產的差異,對原料藥生產過程相關的GMP 管理提出更加明確的要求;第3 部分為GMP 相關的指南文件,表明了藥政當局對于企業實施GMP 的預期。
歐盟共有28 個成員國,為了在歐洲范圍內共享藥品注冊批準、GMP 認證、不良反應等信息,由歐洲藥品管理局(EMA)負責,所有歐盟國家藥品監管當局共同參與建立和完善了歐盟遠程信息管理系統。該遠程信息管理系統由臨床研究信息(Eudra CT)、歐洲內藥品的研發、批準及生產情況(Eudra Data Warehouse)及藥品生產發運管理(Eudra GMDP)等11 個信息版塊組成,通過其中的Eudra GMDP 網站便可查詢到所有歐盟GMP 及藥品發運質量管理規范(GDP)認證情況。
2 數據查詢情況概述
2014 年8 月21 日,通過Eudra GMDP 網站GMP 證書數據庫查詢[3],共獲得261 條關于中國企業歐盟GMP 認證的情況記錄,其中10 條是系統內的重復性錄入,5 條是中國澳門企業記錄,2條是中國香港企業記錄,19 條中的企業名稱和所鏈接證書中企業名稱不匹配,剩余225 條是中國大陸制藥企業歐盟GMP 認證情況的有效信息,其中包含17 條不符合性記錄。考慮到本次研究的重點是企業通過認證的情況,因此只對208 條符合性認證結果進行分析。
3 中國藥企通過歐盟GMP 認證情況分析
認證情況見圖1 至圖4。由于每條查詢結果均對應GMP 證書,因此208 條歐盟GMP 符合性結果對應有208 份歐盟GMP 證書,其中單個企業證書數量達到7 個的只有1 家,另有2 家擁有4 個證書,12 家擁有3 個證書,29 家擁有2 個證書,剩余99 家擁有1 個證書。
4 討論
4.1 中歐藥品生產交流合作持續增長
目前,中國制藥企業進行歐盟GMP 認證的情況主要分為2種,1 種是原料藥的GMP 認證,另1 種是作為國外制劑產品的生產場地進行認證。根據歐盟的相關法律法規,無論哪種情況,認證的發起方均為歐洲當地的制劑上市許可持有人或生產商。因此,2010 年后中國制藥企業獲得歐盟GMP 證書的數量持續增加,充分說明歐洲市場對中國生產原料藥及制劑的需求在不斷增加,中國制藥企業迎來“走出去”發展的良好機遇期。從另一方面看,中國制藥企業經過過去十幾年出口原料藥的經驗積累,對國外的藥品生產質量管理體系有了比較深入的認識,加之中國新版GMP的實施,國內制藥企業GMP 管理體系的完善程度和實施水平明顯改善,通過國際高端GMP 認證的能力顯著提高。

圖1 中國制藥企業歐盟認證國家分布
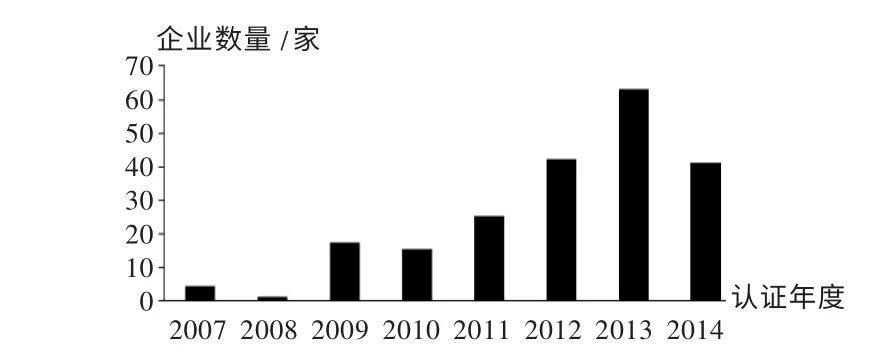
圖2 中國制藥企業歐盟GMP 認證年份分布
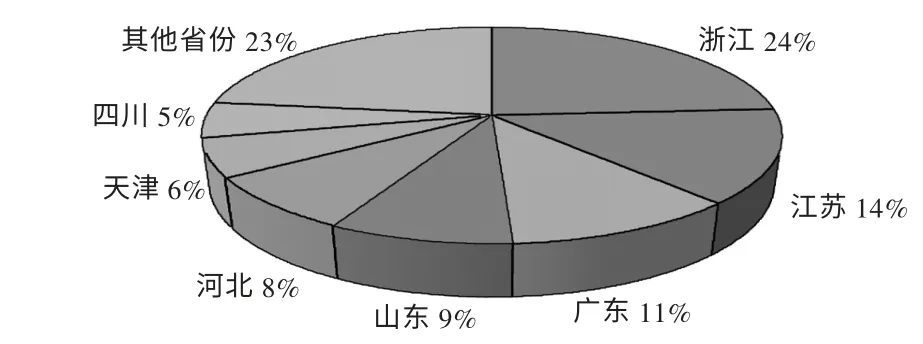
圖3 通過歐盟GMP 的中國制藥企業地區分布
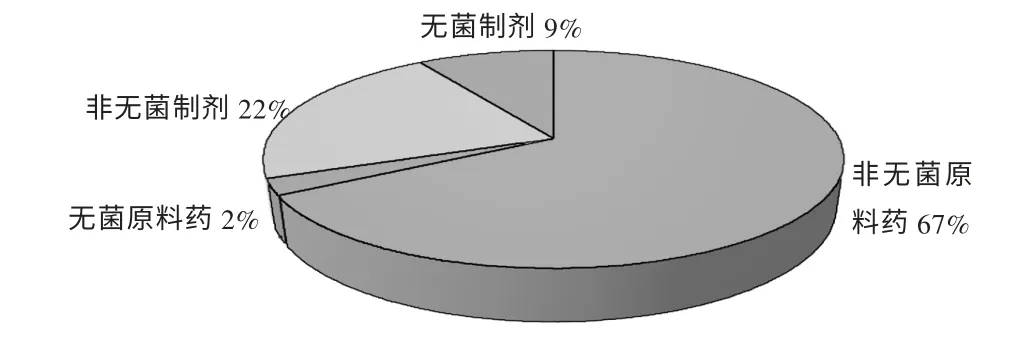
圖4 通過歐盟GMP 的劑型分布
4.2 中國制藥企業產品結構調整的效果逐步顯現
在通過歐盟GMP 認證的產品劑型分布方面,非無菌原料藥占絕對優勢,說明我國的藥品出口仍以普通原料藥為主;制劑直接供給患者使用,出現質量投訴的風險大,質量管理體系要求更加嚴格,因此較原料藥的出口發展緩慢。但從進一步數據分析仍可以看到,從2012 年開始,中國通過歐盟GMP 認證的制劑生產企業數量明顯增多,2007 年僅有2 家,2012 年10 家,2013 年23 家,2014 年8 月達到19 家。這一方面說明企業進行產品結構調整的效果正在逐步顯現,部分企業已經開始由生產附加值低的原料藥轉向附加值較高的制劑產品;另一方面說明中國制藥企業的GMP 實施水平確實在提高,敢于向管理要求更高的制劑生產發起挑戰。
4.3 中國制藥企業的出口認證存在明顯的地區差異
由于中國地域遼闊,東西部經濟發展不平衡,制藥行業在國內各省份的發展也不平衡。浙江、江蘇等地由于地處東部沿海地區,信息、技術、人才資源相對豐富,加之企業領導在發展戰略及規劃方面有所建樹,兩省制藥行業的發展在國內遙遙領先,擁有江蘇恒瑞、浙江海正、浙江華海等一批外向型發展業績突出的企業。而華北地區的河北和山東,由于有華北制藥、石藥集團、齊魯制藥等傳統大型制藥企業,獲得歐盟GMP 證書的情況明顯好于除江浙及廣東以外的省份,尤其是齊魯制藥,通過認證的品種范圍不僅包括多種原料藥,還包括無菌制劑。以上現象說明,國內制藥企業的出口發展仍在延續傳統的地區強弱格局,但在當前信息技術、物流運輸極大發展的形勢下,地域差異已不再是阻礙企業發展的關鍵因素。相反,內地企業有人力成本和資源方面的優勢,在同等質量管理水平下,或許能實現更好的成本控制優勢。中國雖有較大的內需市場,但面對監管持續變嚴、價格政策不斷緊縮的局面,國內藥品行業競爭同樣慘烈。因此,如何規劃企業發展,抓住機遇參與制藥產業鏈的全球分工,更是目前發展相對落后的地區及企業應該關注的問題。
4.4 中國制藥企業真正的國際化發展任重道遠
縱觀全球的制藥巨頭,無論是美國的輝瑞,還是歐洲的葛蘭素史克、諾華等,都在全球范圍內擁有龐大的制劑產品生產網絡和銷售網絡;即使是后起之秀印度,國際化發展比較成功的Dr.Reddy's 及Ranbaxy 等公司[4],也在仿制藥的全球注冊和銷售方面取得了明顯成功。而中國制藥企業目前仍以原料藥出口為主,處于藥品生產供應鏈的最末端,附加值低,且生產過程需要消耗大量的資源,污染嚴重。可喜的是,江蘇恒瑞、浙江海正等企業的制劑產品國際化戰略已經起步,江蘇恒瑞側重創新,一類新藥國內外同步注冊;海正則依托傳統的特色原料藥出口優勢穩扎穩打,推進相關品種的仿制藥國際注冊和場地GMP 工作,著力建設產業鏈供應式的產品出口結構。中國制藥企業雖然迎來產業鏈全球調整的良好機遇,但由于國際藥品市場競爭同樣激烈,且歐美等發達國家的海外審計及監管日益趨嚴,中國制藥企業實現真正的國際化發展依然任重道遠。
[1] 國家食品藥品監督管理總局. 關于實施《藥品生產質量管理規范(2010 年修訂)》有關事宜的公告(2011 年第19 號)[EB/OL].[2014-08-21].http:/ /www.sda.gov.cn/WS01/CL0087/59027.html.
[2] 國家食品藥品監督管理總局,國務院關于印發國家藥品安全“十二五”規劃的通知(國發[2012] 5 號)[EB/OL] . [2014 -08 -21] .http:/ /www.sda.gov.cn/WS01 /CL0100 /69672.html.
[3] European Commission.EU Guidelines to Good Manufacturing Practice to Medicinal Products for Human and Veterinary Use-Introduction[EB/OL] . [2014 -08 -21] . http:/ /ec.europa. eu/health/documents/eudralex/vol-4 /index_en. htm.

