四項免疫組化標志物在診斷甲狀腺乳頭狀癌中的臨床探討
陳桂軍 董 征
(1 錦州市衛(wèi)生學(xué)校,遼寧 錦州 121000;2 錦州市中心醫(yī)院,遼寧 錦州 121000)
甲狀腺乳頭狀癌是臨床常見的惡性腫瘤,其在甲狀腺癌發(fā)生率中占60%~70%[1]。甲狀腺乳頭狀癌的臨床診斷主要是依靠形態(tài)學(xué)特征,如具有毛玻璃樣核、核內(nèi)有包涵體等,但是一些甲狀腺的良性病變,如結(jié)節(jié)性甲狀腺腫、濾泡性甲狀腺腺瘤、橋本甲狀腺炎等均可能伴有不同程度的乳頭狀增生或者毛玻璃樣核等病變,給甲狀腺乳頭狀癌診斷帶來較大的難度[2]。本研究通過對錦州市中心醫(yī)院甲狀腺乳頭狀癌患者臨床資料進行分析,擬探討四項免疫組化標志物在診斷甲狀腺乳頭狀癌中的應(yīng)用效果,現(xiàn)將結(jié)果報道如下。
1 資料與方法
1.1 臨床資料:選取錦州市中心醫(yī)院2010年2月至2014年3月收治的甲狀腺乳頭狀癌患者50例作為觀察組進行分析,男性7例,女性43例,年齡42~61歲,年齡(50.3±9.5)歲,50例患者均有不同程度的頸部腫大臨床表現(xiàn),病灶位置:左側(cè)23例,右側(cè)22例,峽部3例,雙側(cè)2例。選取同期收治的良性甲狀腺結(jié)節(jié)患者200例作為對照組,男性20例,女性180例,年齡43~62歲,年齡(51.7±8.1)歲,兩組觀察對象一般資料無統(tǒng)計學(xué)差異,P>0.05。
1.2 方法:兩組研究對象采集的標本通過甲醛固定,通過乙醇脫水和石蠟包埋,進行連續(xù)切片,切片厚度為4 μm,進行HE染色,通過2名有豐富經(jīng)驗的病理醫(yī)師進行雙盲獨立性評價。免疫組化染色通過S-P法進行,參照定制的試劑盒說明書進行嚴格的操作。分別選擇Ki67、TTF-1、HBME-1和HER-2/neu抗體均是鼠抗人的單克隆抗體。通過奧林巴斯光學(xué)顯微鏡進行結(jié)果判定。TTF-1染色要在細胞核進行定位,HER-2/neu在細胞質(zhì)或者細胞膜進行定位。PBS替代一抗作為陰性對照。每張病理學(xué)切片隨機選擇10個高倍視野,對陽性細胞進行計數(shù),通過半定量分析的方法對陽性細胞率進行計算。陽性判定標準:Ki67陽性為細胞核內(nèi)有棕黃色顆粒出現(xiàn),陽性細胞依據(jù)比例情況進行分組,(-):陽性細胞比例<1%;(+):陽性細胞比例1%~3%;(++):陽性細胞比例3.1%~5.0%;(+++):陽性細胞比例>5.0%。對TTF-1、HBME-1和HER-2/neu進行免疫組化評分。免疫組化評分中陽性細胞比例評分:0分:陽性細胞比例<10%,1分:陽性細胞比例為10%~25%;2分:陽性細胞比例(25%~50%),3分:陽性細胞比例50%~75%,4分:陽性細胞比例>75%。
1.3 觀察指標
1.3.1 觀察兩組研究對象Ki67、甲狀腺轉(zhuǎn)錄因子1(TTF-1)、人骨髓內(nèi)皮細胞標志物(HBME-1)和HER-2/neu陽性率情況。
1.3.2 觀察Ki67、TTF-1、HBME-1和HER-2/neu診斷甲狀腺乳頭狀癌的敏感性、特異性、陽性預(yù)測和陰性預(yù)測的情況:敏感性又稱真陽性率,即實際甲狀腺乳頭狀癌而按該篩檢實驗的標準被正確判斷為甲狀腺乳頭狀癌的百分比,它反映篩檢實驗發(fā)現(xiàn)甲狀腺乳頭狀癌的能力。特異性又稱真陰性率,即實際無甲狀腺乳頭狀癌按該診斷標準被正確地判斷為無病的百分比。它反映篩檢實驗確定非甲狀腺乳頭狀癌的能力。陽性預(yù)測值指篩檢實驗陽性者不患目標甲狀腺乳頭狀癌的可能性。陰性預(yù)測值指篩檢實驗陰性者患甲狀腺乳頭狀癌的可能性。敏感性=真陽性/(真陽性+假陰性);特異性=真陰性/(真陰性+假陽性);陽性預(yù)測值=真陽性/(真陽性+假陽性);陰性預(yù)測值=真陰性/(真陰性+假陰性)。
1.4 統(tǒng)計學(xué)分析:采用統(tǒng)計學(xué)軟件SPSS 19.0建立數(shù)據(jù)庫,針對計數(shù)資料通過百分比表示,采用卡方檢驗分析,P<0.05,差異有統(tǒng)計學(xué)意義。
2 結(jié) 果
2.1 兩組研究對象Ki67、TTF-1、HBME-1和HER-2/neu陽性率情況:見表1。觀察組Ki67、TTF-1、HBME-1和HER-2/neu陽性率明顯高于對照組,P<0.05,差異均有統(tǒng)計學(xué)意義。
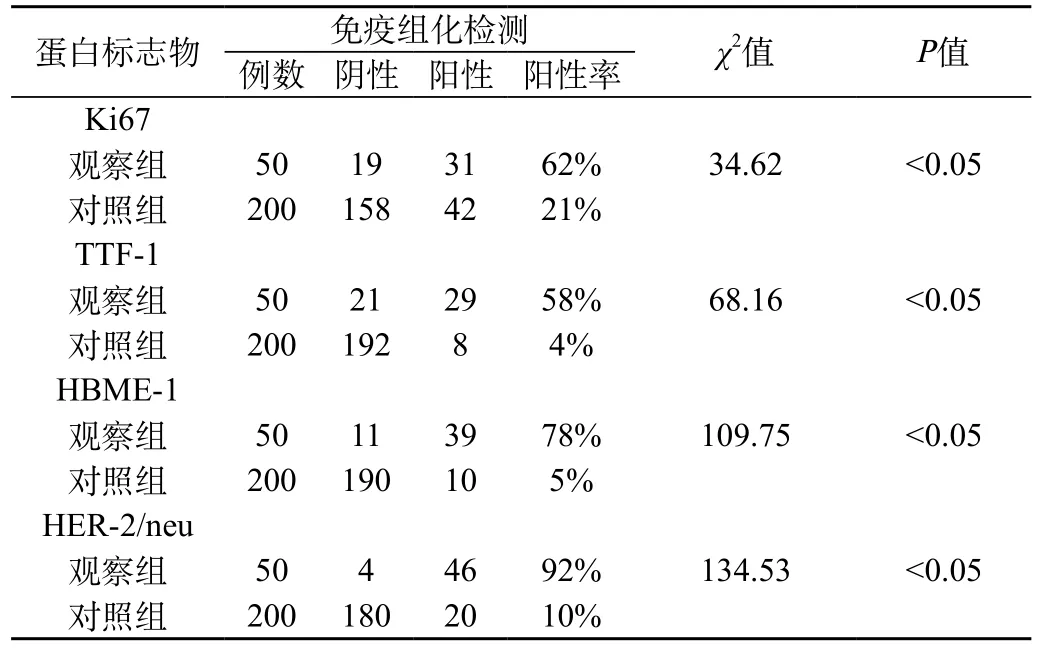
表1 兩組研究對象Ki67、TTF-1、HBME-1和HER-2/neu陽性率情況
2.2 Ki67、TTF-1、HBME-1和HER-2/neu診斷甲狀腺乳頭狀癌的敏感性、特異性、陽性預(yù)測和陰性預(yù)測的情況:見表2。HER-2/neu診斷甲狀腺乳頭狀癌的敏感性最高92%,TTF-1特異性最高96%。
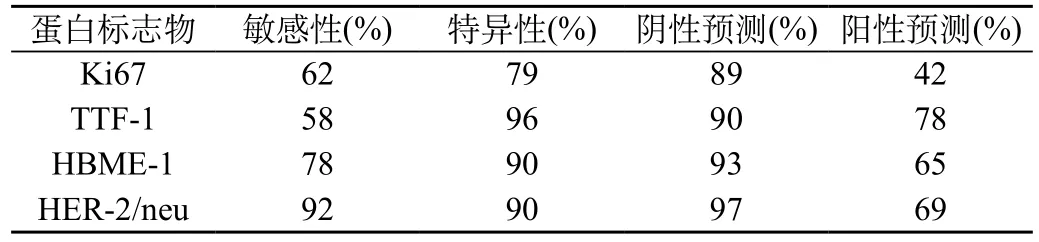
表2 Ki67、TTF-1、HBME-1和HER-2/neu診斷甲狀腺乳頭狀癌的敏感性、特異性、陽性預(yù)測和陰性預(yù)測的情況
3 討 論
甲狀腺乳頭狀癌作為甲狀腺最為常見的惡性腫瘤,其主要特征是具有乳頭狀結(jié)構(gòu)和特征性的細胞核,其臨床病例特征往往不是十分明顯[3]。結(jié)節(jié)性甲狀腺腫是臨床常見的增生性疾病,其往往伴有乳頭狀增生,并且當(dāng)乳頭狀增生復(fù)雜、細胞層次較多、細胞核具有一定的異型性,進而和乳頭狀癌十分相似,影響了臨床診斷的準確率[4]。Ki67是一種和細胞周期相關(guān)的蛋白質(zhì),其異常表達可以覆蓋除了G0期以外的細胞各個增殖周期,在G1晚期、S期、G2期和M期持續(xù)性的存在,并且隨著細胞周期的不斷發(fā)展,抗原的表達明顯增高,一直到G2期和M期達到表達的高峰,對于細胞增殖的活性可以明顯的反映[5]。另外Ki67在低分化腺癌組織中的表達往往高于中、高分化腺癌,其可以客觀的反映腫瘤的性質(zhì)和惡性程度,也可以應(yīng)用細胞增殖的活性、周期和生長方式等探討,是腫瘤診斷和預(yù)后判定的重要生物標志物[6]。TTF-1是調(diào)控基因表達的轉(zhuǎn)錄因子之一,其主要在甲狀腺濾泡、甲狀旁腺等組織器官表達,并且參與甲狀腺的分化發(fā)育和功能的維持。TTF-1和甲狀腺癌是互為因果的關(guān)系,甲狀腺癌對TTF-1表達和活性造成影響,同時TTF-1突變和活性降低又會促使甲狀腺細胞分化、成熟受到損傷,誘發(fā)惡性病變[7]。甲狀腺癌組織中存在著TTF-1表達量的異常,同時也存在著基因的突變[8]。TTF-1大多數(shù)定位在細胞核內(nèi),也有少量定位在細胞質(zhì),當(dāng)出現(xiàn)細胞質(zhì)型TTF-1時提示甲狀腺細胞可能出現(xiàn)了惡化,可能由于TTF-1蛋白在細胞質(zhì)內(nèi)的過量表達,且累及TTF-1蛋白進入細胞核信號肽序列。HER-2/neu位于人體染色體的17q-12-21.3,是人體重要的細胞癌基因,HER-2/neu編碼的產(chǎn)物和表皮生長因子受體具有一半是同源的,參與細胞的分裂和生長,是酪氨酸激酶受體的一種。HER-2/neu正常狀態(tài)下處于非激活的狀態(tài),其通過影響細胞轉(zhuǎn)導(dǎo)通路來參與到細胞的增殖、分化和凋亡過程中,進而促使細胞惡變。Her-2/neu蛋白由胞外的配體結(jié)合區(qū)、單鏈跨膜區(qū)及胞內(nèi)的蛋白酪氨酸激酶區(qū)三部分組成,由于目前尚未發(fā)現(xiàn)能與Her-2/neu蛋白直接結(jié)合的配體,其主要通過與家族中其他成員包括EGFR(HERl/erbBI),HER3/erbB3[9]。HBME-1是間皮細胞表面微絨毛的抗原,其是酸性氨基酸多聚糖蛋白,主要成分是透明質(zhì)酸。為單克隆抗體,是間皮細胞微絨毛表面特異性標志物,在腫瘤血管的形成、腫瘤的生長以及腫瘤的轉(zhuǎn)移中發(fā)揮重要作用。有資料顯示,HBME-1在甲狀腺乳頭狀癌中呈現(xiàn)較高的表達,然而結(jié)節(jié)性甲狀腺腫、乳頭狀的良性病變則表現(xiàn)為陰性[10]。本研究通過分析錦州市中心醫(yī)院2010年2月至2014年3月收治的甲狀腺乳頭狀癌患者50例臨床資料,作為觀察組,選取同期良性甲狀腺結(jié)節(jié)患者200例作為對照組。結(jié)果表明,觀察組Ki67、TTF-1、HBME-1和HER-2/neu陽性率明顯高于對照組, HER-2/neu診斷甲狀腺乳頭狀癌的敏感性最高92%,TTF-1特異性最高96%。提示HER-2/neu聯(lián)合TTF-1可能明顯的提高診斷甲狀腺乳頭狀癌準確率,值得臨床推廣應(yīng)用。
[1]婁欣,張全武,趙紅梅,等.甲狀腺乳頭狀癌與乳頭狀增生的免疫組化特征[J].腫瘤基礎(chǔ)與臨床,2011,24(2):103-105.
[2]Prasad ML,Huang Y,Pellegata NS,et al.Hashimotos thyroiditis with papillary thyroid carcinoma(PTC)-Like nuclear alterations express molecular markers of PTC[J].Histopathology,2004,45(1):39-46.
[3]楊曉斌,歐陵斌,肖古月.細針吸取結(jié)合液基細胞學(xué)對甲狀腺乳頭狀癌的免疫組化分析[J].中國現(xiàn)代醫(yī)學(xué)雜志,2011,21(27):3380-3382.
[4]Dipasqual M,Rothstein JL,Palazzo JP.Pathologic features of Hashimotos-associated papillary thyroid carcinomas[J].Hum Pathol,2001,32(1):24-30.
[5]李天一,吳鋼,蔡端.四項免疫組化標志物在診斷甲狀腺乳頭狀癌中的臨床意義[J].上海醫(yī)藥,2014,35(10):24-27.
[6]Liu LH,Bakhos R,Wojcik EM.Concomitant thyroid carcinoma and Hoshimotos thyroiditis[J].Semin Diagn Pathol,2001,18(2):99-103.
[7]楊玉清,姚宏.CK19 Galectin-3 HBME-1 S-100及Ki67在甲狀腺乳頭狀癌中表達的意義[J].中國藥物與臨床,2012,12(9):1144-1146.
[8]Bruwer M,Schmid K W,Senninger N,et al.Immunohisto-chemical expression of P53 and oncogenes in ulcerative colitis-associated color-ectal carcinoma[J].World J Surg,2002,26(3):390-396.
[9]Papale F,Cafiero G,Grimaldi A,et al.Galectin-3 expression in thyroid fine needle cytology (t-FNAC) uncertain cases:validation of molecular markers and technology innovation[J].J Cell Physiol,2013,228(5):968-974.
[10]Kazaure HS,Roman SA,Sosa JA.Aggressive variants of papillary thyroid cancer: incidence, characteristics and predictors of survival among 43,738 patients[J].Ann Surg Oncol, 2012,19(6):1874-1880.

