紫外法測定重組人紅細胞生成素(Fc)融合蛋白的含量
張桂濤 陽 勇 李慶昌 何 凱 韓為躍
(廣東聯(lián)康生物與醫(yī)藥研究院,廣東 東莞 523581)
紫外法測定重組人紅細胞生成素(Fc)融合蛋白的含量
張桂濤陽勇李慶昌何凱韓為躍
(廣東聯(lián)康生物與醫(yī)藥研究院,廣東 東莞 523581)
目的 建立紫外法測定重組人紅細胞生成素(Fc)融合蛋白(rhEPO-Fc)含量的方法。方法 利用Edelhoch法測定rhEPO-Fc的摩爾消光系數(shù),計算得到其溶液百分比消光系數(shù),并測定rhEPO-Fc溶液A280值,依據(jù)公式c=A/ε計算rhEPO-Fc的含量。結(jié)果 rhEPO-Fc溶液百分比消光系數(shù)為1.3,在0.02~1.28 mg/mL濃度范圍內(nèi),測定含量結(jié)果偏差<4%。結(jié)論 該方法操作簡便、專屬性強、結(jié)果準確可靠,可用于rhEPO-Fc含量測定。
消光系數(shù);紅細胞生成素;融合蛋白
蛋白質(zhì)定量是重組蛋白藥物研究開發(fā)中最基本的實驗內(nèi)容,常用的定量方法包括Bradford、Lowry和HPLC法等,這些方法需要對應的標準品,而重組蛋白的標準品一般情況下無法獲取,以前多采用牛血清白蛋白或者人血清白蛋白作為替代標準品用于重組蛋白的含量測定,但不同蛋白質(zhì)的氨基酸組成不同,其理化性質(zhì)不同,因此用非同質(zhì)標準品測定蛋白含量偏差比較大,不能準確反映待測蛋白的真實含量。近年來,紫外吸光法已成為FDA、EMA推薦的重組蛋白藥物含量測定方法之一。在摩爾消光系數(shù)及相對分子質(zhì)量已知的情況下,僅需要測定樣品的光吸收值,即可計算出蛋白濃度,而不需要蛋白標準品。
目前已知的摩爾消光系數(shù)的測定有幾種方法,包括dry weight[1]、nitrogen determination[2]和spectral method[3],這幾種方法都存在蛋白質(zhì)用量大、過程繁瑣等缺點,限制了它們在實驗室的使用。
rhEPO-Fc為創(chuàng)新蛋白質(zhì)藥物,擬用于腎性貧血治療,該藥物制劑在臨床預試驗中表現(xiàn)出長效化特征,該蛋白利用EPO融合Fc片段后以同源二聚體形式存在,理論上其半胱氨酸都以二硫鍵形成胱氨酸,因此其變性狀態(tài)下的摩爾消光系數(shù)為111280;而二聚體的氨基酸相對分子質(zhì)量為88629.2。
本研究中,筆者采用Edelhoch法測定rhEPO-Fc的摩爾消光系數(shù),計算得到其溶液百分比消光系數(shù),從而依據(jù)公式(1)測定其蛋白質(zhì)含量;本法具有的優(yōu)點:在確定溶液百分比消光系數(shù)后,不需要任何反應,可直接測定該蛋白溶液的吸收值,從而計算出蛋白質(zhì)的含量,操作簡便、可重復性良好且專屬性強。
1 材料與儀器
rhEPO-Fc原液(純度>95%,自制),脫鹽柱為Amersham Biosciences產(chǎn)品(貨號:52-13080-00)。紫外分光光度計(Beckman DU730)。鹽酸胍、氯化鈉等均為國產(chǎn)分析純。
2 方法與結(jié)果
2.1rhEPO-Fc消光系數(shù)的測定:將經(jīng)脫鹽得到的rhEPO-Fc水溶液用超純水稀釋3、6、12、24、48倍,分別測定A280。由于在蛋白溶液中蛋白顆粒會出現(xiàn)光散射現(xiàn)象,因此必須對A280進行校正,即扣除光散射值A光散射。A光散射的測定方法是測定溶液在320、325、330、335、340、345、350 nm波長處的吸光度,用線性回歸法,以吸光度的對數(shù)值與其相對應波長的對數(shù)值繪圖,獲得最適標準曲線,將此標準曲線外推至280 nm波長,從而確定A280光散射。同樣,將EPO-Fc蛋白水溶液用相同的稀釋倍數(shù)溶解在6mol/L鹽酸胍溶液中,分別測定其A280和A280光散射。計算同一濃度的rhEPO-Fc在水溶液和6mol/L鹽酸胍溶液中紫外吸收值的比值,并利用公式(3)(4)(5)計算rhEPO-Fc水溶液中的溶液百分比消光系數(shù)。結(jié)果:rhEPO-Fc的消光系數(shù)為1.3,RSD=0.41%,見表1。

表1 溶液百分比消光系數(shù)測定結(jié)果
2.2溶液百分比消光系數(shù)測定干擾性試驗
2.2.1糖基化對rhEPO-Fc溶液百分比消光系數(shù)的影響:對于糖蛋白,雖然單糖分子在280 nm處沒有紫外吸收值,但是其糖鏈組成可能會影響到蛋白質(zhì)的構象,從而影響糖蛋白的紫外吸收值。為了研究糖基化是否對rhEPO-Fc的消光系數(shù)存在影響,取rhEPO-Fc蛋白原液,用肽N-糖苷酶F酶切N-糖鏈,酶切完成后,蛋白質(zhì)用Protein A柱進行純化,去除肽N-糖苷酶F和反應緩沖液,用上述方法測定無糖基化的rhEPO-Fc的溶液百分比消光系數(shù),結(jié)果為1.2,去除糖基后的rhEPO-Fc消光系數(shù)下降了約7%,這說明糖基化會影響糖蛋白的消光系數(shù),但是并不顯著,可能是由于蛋白糖基化后構象發(fā)生改變引起。
2.2.2離子強度對rhEPO-Fc溶液百分比消光系數(shù)的影響:取適量的rhEPO-Fc蛋白水溶液,調(diào)整A280在0.6~1.4,用不同濃度的氯化鈉分別進行倍比稀釋,使rhEPO-Fc蛋白溶液中氯化鈉的濃度分別為0、0.25、0.5、1.00、1.50、2.00mol/L,混合靜置2~3min后用分光光度計分別測定其A280和A280光散射,校正A280,結(jié)果見表2,rhEPO-Fc蛋白在0.25~2.00mol/L的氯化鈉溶液中A280值變化不大,而且與在0mol/L氯化鈉溶液中相當,說明2mol/L以下的氯化鈉不影響蛋白質(zhì)的光吸收值,即不影響其溶液百分比消光系數(shù)。見表2。

表2 rhEPO-Fc在不同濃度氯化鈉中的吸光值
2.3濃度測定范圍確定:取適量rhEPO-Fc蛋白原液,用超純水稀釋成濃度為1.28、0.64、0.32、0.16、0.08、0.04、0.02、0.01 mg/mL,分別測定其A280和A280光散射。同時,利用rhEPO-Fc溶液百分比消光系數(shù)計算理論吸收值,并比較由計算得到的吸收值相對于測定校正吸收值的偏差,結(jié)果見表3,rhEPO-Fc濃度在0.02~1.28 mg/mL范圍檢測紫外吸收值與計算吸收值的相對偏差<4%,因此,在該濃度范圍內(nèi),紫外法測定該rhEPO-Fc含量是可信的。見表3。
2.4重復性試驗:分別取同批rhEPO-Fc原液5份,分別測定A280和A280光散射,校正A280,利用公式(1)計算得到原液含量為0.97 mg/mL,RSD=0.65%(n=5),重復性良好。
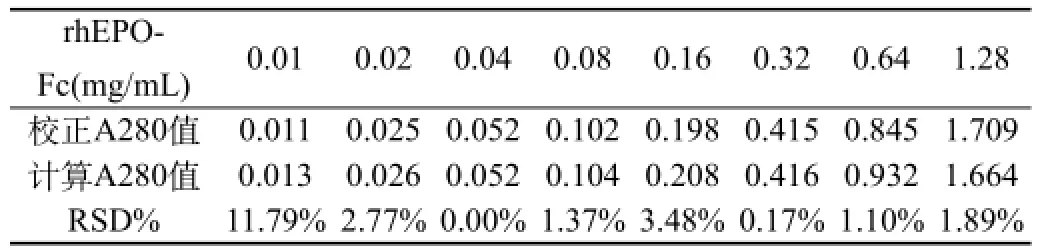
表3 相同濃度rhEPO-Fc測定校正后A280與c=A/εAbs0.1%計算A280比較
3 討 論
利用Edelhoch法測定rhEPO-Fc蛋白的摩爾消光系數(shù),操作簡便,可用于rhEPO-Fc含量的測定。但考慮到消光系數(shù)的專屬性,為保證結(jié)果的準確,待檢樣品的純度應不低于95%,即所含的目標蛋白幾乎為rhEPO-Fc的情況下,計算的rhEPO-Fc原液含量才更準確。筆者研究了數(shù)十種蛋白質(zhì)消光系數(shù)發(fā)現(xiàn),利用Edelhoch法測定的摩爾消光系數(shù)和直接經(jīng)公式ε=(Trp數(shù)量)×5500+(Tyr數(shù)量)×1490+(cystine數(shù)量)×125計算的摩爾消光系數(shù)比較,大部分蛋白的偏差都5%左右,少數(shù)蛋白的偏差超過10%,如Rituximab。重組糖蛋白的糖基化程度、糖基化位點及糖基化的類型對其消光系數(shù)的影響也不盡相同,如rhEPO-Fc脫糖后的消光系數(shù),相對于脫糖前下降約7%左右,而Rituximab脫糖前后幾乎無差異。該方法專屬性強、準確度高,可用于純度高rhEPO-Fc原液或制劑的定量。
[1] Hunter MJ.A method for the determination of protein partial secific volum[J].J Phys Chem,1996,70(10):3285-3292.
[2] Jaenicke L.A rapid micromethod for the determination of nitrogen and phosphate in biological material[J].Anal Biochemis ty,1974,61(4):623-627.
[3] Whitaker JR, Granum PE.An absolute method for protein determination based on difference in absorbance at 235 and 280 nm[J] .Anal Biochem,1980,109(1):156-159.
R-3
B
1671-8194(2015)10-0065-02
廣東省重大科技專項(重大新藥創(chuàng)制)課題(編號:2011A080502001)

