PTPMeg2的PTP結(jié)構(gòu)域?qū)α姿峄疭TAT3入核的抑制作用
蘇富琴 王玉春 齊占朋 孫 超 李淑艷
(齊齊哈爾醫(yī)學(xué)院生物化學(xué)教研室,黑龍江 齊齊哈爾 161006)
PTPMeg2的PTP結(jié)構(gòu)域?qū)α姿峄疭TAT3入核的抑制作用
蘇富琴1王玉春2齊占朋2孫 超2李淑艷
(齊齊哈爾醫(yī)學(xué)院生物化學(xué)教研室,黑龍江 齊齊哈爾 161006)
目的 探討PTPMeg2結(jié)構(gòu)域?qū)α姿峄疭TAT3核轉(zhuǎn)位的影響。方法 采用免疫共沉淀技術(shù)研究PTPMeg2與STAT3不同結(jié)構(gòu)域的相互作用,采用GST pull down實驗研究STAT3與PTPMeg2不同結(jié)構(gòu)域的相互作用,用激光共聚焦顯微鏡直接觀察PTPMeg2對磷酸化STAT3細(xì)胞定位的影響。結(jié)果 STAT3與PTPMeg2的所有結(jié)構(gòu)域均有相互作用,PTPMeg2的PTP結(jié)構(gòu)域和△SEC結(jié)構(gòu)域(PTP結(jié)構(gòu)域+LK結(jié)構(gòu)域)可以抑制磷酸化STAT3入核。結(jié)論 PTPMeg2的PTP結(jié)構(gòu)域?qū)α姿峄疭TAT3的入核具有抑制作用。
PTPMeg2;磷酸化STAT3;核轉(zhuǎn)位
STAT為一類存在于細(xì)胞質(zhì)中的信號轉(zhuǎn)導(dǎo)和轉(zhuǎn)錄激活因子。STAT3信號通路能被多種因子所激活,如白細(xì)胞介素(IL)-6家族因子、表皮生長因子(EGF)、血小板源樣生長因子(PDGF)、胰島素樣生長因子(IGF)等生長因子〔1〕,以及 v-Src、v-Sis、v-Fps、v-Ros、IGF-IR、c-Eyk/v-Eyk 等原癌蛋白〔2〕。在許多腫瘤中都檢測到了持續(xù)激活或者高水平磷酸化的STAT3〔3〕。PTPMeg2是存在于細(xì)胞質(zhì)中的蛋白酶,已經(jīng)證實STAT3是PTPMeg2的直接底物,PTPMeg2對磷酸化的STAT3具有直接去磷酸化作用〔4〕,Yuan等〔5〕發(fā)現(xiàn) PTPMeg2 還可以通過抑制磷酸化EGF受體(EGFR)水平和磷酸化ErBb2水平間接降低磷酸化STAT3水平。目前,磷酸化STAT3負(fù)調(diào)控的研究熱點集中在幾個層面:激酶水平的負(fù)調(diào)控,磷酸化STAT3核轉(zhuǎn)位的負(fù)調(diào)控,STAT3結(jié)合DNA的負(fù)調(diào)控,STAT3的蛋白降解。本研究通過乳腺癌MCF7細(xì)胞轉(zhuǎn)染外源性基因后,通過激光共聚焦顯微鏡直接觀察PTPMeg2的不同結(jié)構(gòu)域?qū)L-6激活的磷酸化STAT3核轉(zhuǎn)位的影響。
1 材料與方法
1.1 質(zhì)粒和抗體 PTPMeg2 WT由美國Oklahoma健康科學(xué)中心趙志壯教授惠贈。Myc-PTPMeg2 SEC、Myc-PTPMeg2△SEC、Myc-PTPMeg2 PTP、Myc-PTPMeg2 △PTP、Myc-PTPMeg2 LK 由清華大學(xué)醫(yī)學(xué)院常智杰教授惠贈。pXJ40/Flag-STAT3、pXJ40/Flag-STAT3-NTO、pXJ40/Flag-STAT3-M1、 pXJ40/Flag-STAT3-SH2+CT以及pXJ40/GST、pXJ40/GST-STAT3由新加坡國立大學(xué)曹新民博士惠贈。轉(zhuǎn)染試劑vigofect購自威格拉斯試劑公司。抗鼠 Myc、抗兔-FITC、抗鼠-TRITC、抗兔-HRP、抗鼠-HRP均為Santa Cruz公司產(chǎn)品。
1.2 細(xì)胞培養(yǎng)及細(xì)胞轉(zhuǎn)染 HEK293T細(xì)胞及乳腺癌細(xì)胞MCF7于含5%CO2的37℃培養(yǎng)箱中培養(yǎng),培養(yǎng)基為含10%胎牛血清及 100 U/ml青霉素、100 mg/L鏈霉素的DMEM培養(yǎng)基。所用細(xì)胞均為對數(shù)增長期細(xì)胞。取對數(shù)生長期細(xì)胞,更換新鮮完全培養(yǎng)基2.5 h后進(jìn)行轉(zhuǎn)染。按照vigofect轉(zhuǎn)染說明書,在一個轉(zhuǎn)染管中將100 μl 0.9%NaCl與需要轉(zhuǎn)入的質(zhì)粒DNA混和,在另一轉(zhuǎn)染管中將0.9%NaCl與的vigofect等體積混和,室溫放置5 min。然后將含有vigofect的混合液滴加到質(zhì)粒DNA的混合液中,混勻,在室溫放置15 min后滴入細(xì)胞培養(yǎng)基中。轉(zhuǎn)染后3 h更換新鮮的完全培養(yǎng)基。
1.3 GST pull down實驗 用表達(dá)GST或者GST-STAT3的真核表達(dá)質(zhì)粒和pcDNA3.1/PTPMeg2、Myc-PTPMeg2 SEC、Myc-PTPMeg2△SEC、共轉(zhuǎn)染HEK-293T細(xì)胞后,培養(yǎng)48 h,收獲細(xì)胞并用細(xì)胞裂解液〔80 mmol/L KCl,10 mmol/L Na2HPO4,1 mmol/L EDTA(pH8.0),0.5%NP-40,10%Glycerol,1 mmol/L DTT,1 mmol/L PMSF,1 μg/ml Aprotinin,1 μg/ml Leupeptin,1 μg/ml Pepstatin,0.1 mmol/L Na3VO4〕裂解細(xì)胞;在細(xì)胞裂解液中加入30 μl處理好的GST Sepharose-4B beads懸旋液,在4℃旋轉(zhuǎn)過夜;1 500 r/min,4℃離心后棄上清,用細(xì)胞裂解緩沖液漂洗,離心,在沉淀中加入30 μl 2×十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)上樣液,SDS-PAGE分離蛋白復(fù)合物;Western雜交檢測相應(yīng)的結(jié)合蛋白。
1.4 免疫共沉淀試驗(Co-IP)及Western印跡 HEK293T細(xì)胞單獨(dú)轉(zhuǎn)染 pcDNA3/Myc-PTPMeg2,共同轉(zhuǎn)染 pcDNA3/Myc-PTPMeg2 及 pXJ40/Flag-STAT3、 pXJ40/Flag-STAT3-NTO、pXJ40/Flag-STAT3-M1、pXJ40/Flag-STAT3-SH2+CT。收獲轉(zhuǎn)染24 h的細(xì)胞,用細(xì)胞裂解液冰上裂解細(xì)胞30 min,4℃高速離心15 min。取細(xì)胞裂解上清加等容的2×SDS-PAGE上樣液變性10 min,-20℃保存?zhèn)溆谩F溆嗟募?xì)胞裂解物,加入2 μg Flag抗體,4℃混合4 h。然后在上述混合物中加入30 μl G蛋白耦聯(lián)的葡聚糖顆粒懸浮液,4℃旋轉(zhuǎn)混合過夜。洗滌葡聚糖顆粒4次,在沉淀中加入 30 μl 2×SDS-PAGE 上樣液煮 10 min。Western印跡雜交分析蛋白表達(dá)。使用10%的SDS-PAGE電泳,轉(zhuǎn)膜后用Western印跡檢測相應(yīng)的結(jié)合蛋白。
1.5 細(xì)胞免疫熒光染色 將對數(shù)生長期的乳腺癌MCF7細(xì)胞種植于鋪有載玻片的6孔板中,待細(xì)胞貼壁后進(jìn)行轉(zhuǎn)染。轉(zhuǎn)染24 h用IL-6刺激細(xì)胞30 min,洗滌后用4%多聚甲醛/磷酸鹽緩沖液(PBS)固定,PBS洗滌,加入穿透液(0.3%Triton-X 100/PBS),洗滌,封閉液室溫封閉1 h。加一抗(抗兔Flag抗體1∶100稀釋;抗小鼠myc抗體1∶100稀釋)4℃過夜。相應(yīng)的二抗1∶200稀釋液避光孵育,37℃ 1 h,PBST浸泡洗滌,除鹽后用防熒光淬滅的封片劑(甘油)封片。激光共聚焦顯微鏡觀察并拍照。
2 結(jié)果
2.1 PTPMeg2與STAT3的所有結(jié)構(gòu)域均存在相互作用 為了確定PTPMeg2與STAT3結(jié)合結(jié)構(gòu)域,將STAT3的六個功能結(jié)構(gòu)域(N-端功能域、螺旋結(jié)構(gòu)域、DNA結(jié)合結(jié)構(gòu)域、連接結(jié)構(gòu)域,SH2結(jié)構(gòu)域以及轉(zhuǎn)錄激活結(jié)構(gòu)域)分成了3個部分,即Flag-NTO結(jié)構(gòu)域、Flag-M1結(jié)構(gòu)域、Flag-SH2+CT結(jié)構(gòu)域。PTPMeg2全長和STAT3的功能結(jié)構(gòu)域分別進(jìn)行共同表達(dá),通過免疫共沉淀的方法分析PTPMeg2與STAT3相互作用結(jié)構(gòu)域,結(jié)果PTPMeg2與STAT3所有結(jié)構(gòu)域均有相互作用。見圖1,圖2。
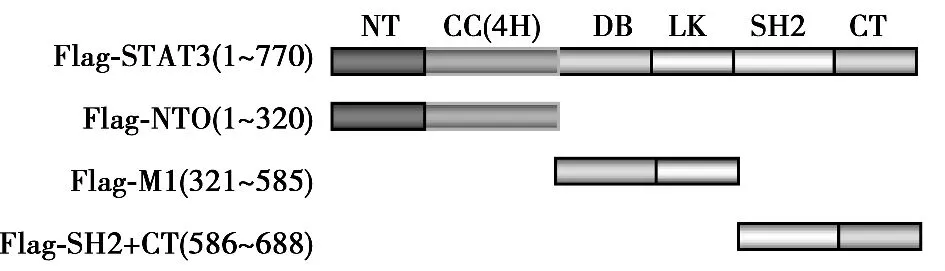
圖1 STAT3結(jié)構(gòu)域示意圖
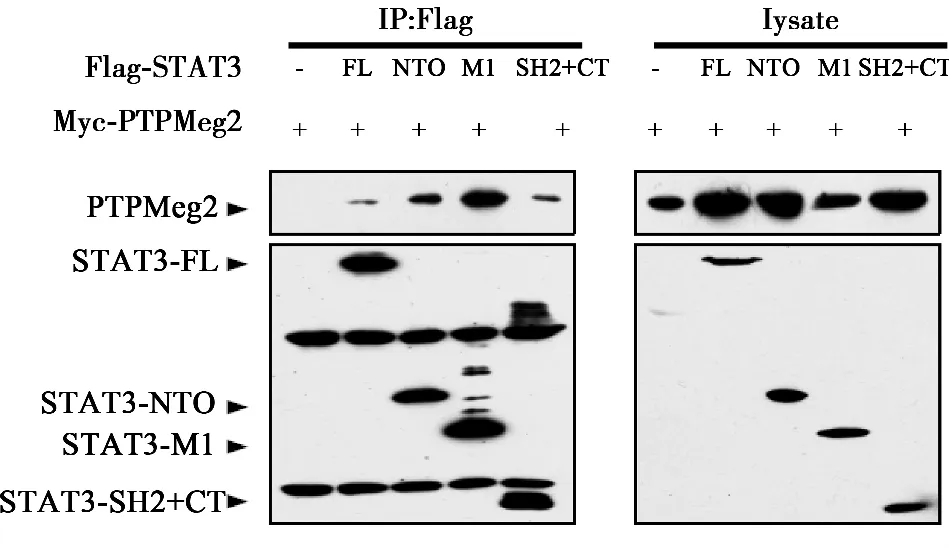
圖2 STAT3不同結(jié)構(gòu)域與PTPMeg2全長的相互作用
2.2 STAT3與PTPMeg2的所有結(jié)構(gòu)域均存在相互作用 采用真核細(xì)胞GST pull down實驗,在HEK293T細(xì)胞中同時共轉(zhuǎn)染了GST-STAT3和PTPMeg2各個結(jié)構(gòu)域的質(zhì)粒,用GST beads進(jìn)行pull down實驗。Western印跡檢測結(jié)果表明,PTPMeg2全長和其所有的結(jié)構(gòu)域與STAT3通過pull down沉淀得到的復(fù)合物中檢測到了明顯的PTPMeg2相應(yīng)的特異性條帶。而對照組用GST所作的pull down沉淀中沒有檢測到相互作用。見圖3,圖4。
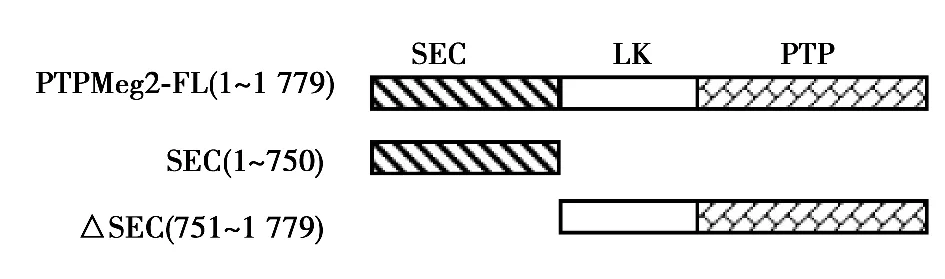
圖3 PTPMeg2結(jié)構(gòu)域示意圖
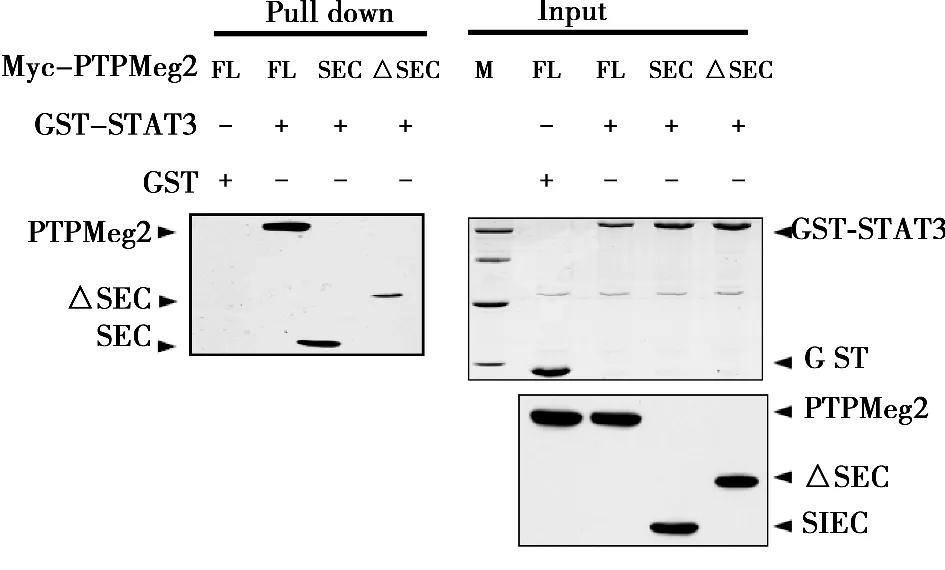
圖4 PTPMeg2不同結(jié)構(gòu)域與STAT3全長的相互作用
2.3 PTPMeg2的PTP結(jié)構(gòu)域可抑制磷酸化STAT3入核 PTPMeg2的結(jié)構(gòu)域與STAT3均有相互作用,這些結(jié)構(gòu)域知否對活化的STAT3的細(xì)胞定位有影響,我們同樣在乳腺癌MCF7細(xì)胞中共表達(dá)了PTPMeg2的不同結(jié)構(gòu)域以及STAT3,在IL-6激活30 min后檢測STAT3的細(xì)胞定位變化。結(jié)果顯示,PTPMeg2的SEC結(jié)構(gòu)域仍然在胞質(zhì)中呈均勻分布,對STAT3的入核也沒有抑制作用(見圖5b1~圖5b3),SEC結(jié)構(gòu)域的缺失突變體則在胞質(zhì)中呈點狀分布,并且可以抑制活化的STAT3入核(見圖5d1~圖5d3)。SEC結(jié)構(gòu)域的缺失突變體含有連接結(jié)構(gòu)域和PTP結(jié)構(gòu)域,是否是PTP結(jié)構(gòu)域引起的變化,在PTP結(jié)構(gòu)域的共轉(zhuǎn)染細(xì)胞中,同樣觀察到了PTPMeg2蛋白呈明顯的點狀分布,并且也同樣抑制活化的STAT3入核(見圖5f1~圖5f3)。對于PTP結(jié)構(gòu)域的缺失突變體在胞漿中呈現(xiàn)均勻分布,與SEC結(jié)構(gòu)域相同,也不能阻止活化的STAT3入核(見圖5h1~圖5h3)。說明PTP結(jié)構(gòu)域是PTPMeg2的功能結(jié)構(gòu)域。
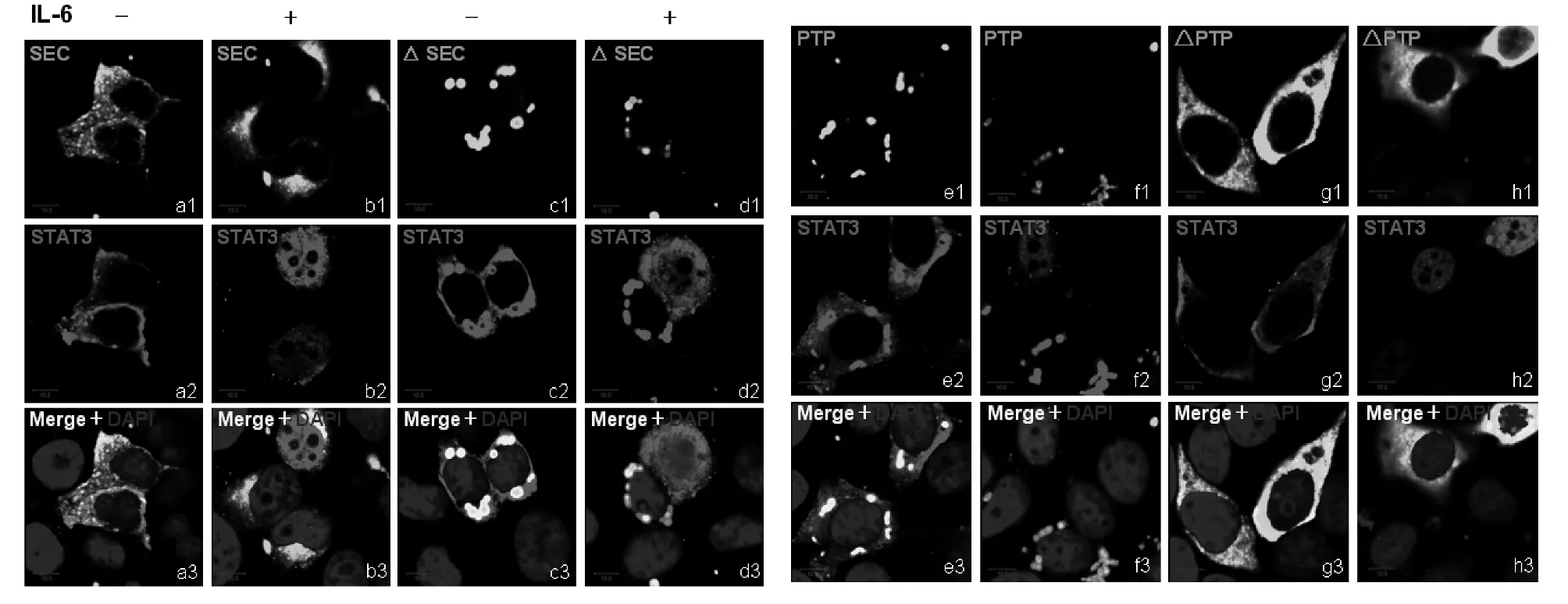
圖5 PTPMeg2結(jié)構(gòu)域?qū)TAT3的細(xì)胞定位變化
3 討論
STAT3在細(xì)胞生長、分化、存活甚至凋亡等都起到重要作用的蛋白,是 STAT信號通路中的一個重要的結(jié)點蛋白〔6〕。STAT3功能發(fā)揮的關(guān)鍵在于能夠特異性地并且以不同的親和力與其他各類分子(包括蛋白質(zhì))結(jié)合,甚至形成大的復(fù)雜的復(fù)合物。病理情況下,STAT3在腫瘤中呈現(xiàn)持續(xù)活化或者高磷酸化狀態(tài),這種持續(xù)活化的狀態(tài)可能是由于激酶的持續(xù)激活或者磷酸酶的失活引起的。PTPMeg2是與STAT3存在相互作用的磷酸酶,是 STAT3 的負(fù)性調(diào)控因子〔4,5〕。
STAT3信號通路的負(fù)調(diào)控主要從以下幾個層次得到了研究:(1)激酶水平上的負(fù)調(diào)控。有研究〔7〕表明,SHP2通過和gp130受體Y759位點的結(jié)合,從而起到對STAT3信號通路的抑制作用。苯氨基嘧啶類(STI751)和第一種對AG490能抑制JAK激酶,從而抑制白血病增殖而對正常造血無影響〔8〕。第三種吡哆(2、3 d)吡拉明酪氨酶激酶能選擇性抑制C-Src激酶,對通過C-Src激酶途徑的腫瘤細(xì)胞具有明顯的抗增殖作用〔9〕。JAB、CIS及SOCS3蛋白通過和JAK2激酶的酪氨酸激酶功能域結(jié)合,從而阻止JAK2對STAT3的激活作用〔10〕。(2)STAT3的核轉(zhuǎn)位負(fù)調(diào)控。對于STAT3的核轉(zhuǎn)位的負(fù)調(diào)控包括對其入核的抑制和對其出核的協(xié)助。兩個不同的研究小組分別采用酵母雙雜交的方法,得到與STAT3相互作用的蛋白GRIM。GRIM可以通過抑制STAT3的入核對STAT3的信號通路達(dá)到負(fù)調(diào)控的目的〔11〕。(3)STAT3結(jié)合DNA的負(fù)調(diào)控。PIAS3可以特異的和磷酸化的STAT3進(jìn)行結(jié)合,從而影響STAT3結(jié)合DNA的能力〔12〕。(4)STAT3 的蛋白降解。2000 年,Daino等〔13〕發(fā)現(xiàn),STAT3可以通過泛素化方式降解,從而抑制HL60等白血病細(xì)胞的增殖。Tanaka等〔14〕發(fā)現(xiàn)PDZ-LIM 結(jié)構(gòu)蛋白PDLIM2可以作為E3酶介導(dǎo)STAT3的蛋白酶體降解,從而抑制TH17細(xì)胞的形成,阻斷其在肉芽腫中發(fā)揮的病理作用。(5)STAT3的小分子抑制劑。小分子物質(zhì)直接抑制STAT3與DNA結(jié)合。LLL12和FLLL32作為小分子抑制劑,直接靶向STAT3,抑制其與DNA的結(jié)合,從而引起腫瘤的增殖抑制作用〔15~17〕。另外直接靶向STAT3的microRNA let-7也可以直接抑制STAT3發(fā)揮作用〔18〕。
PTP結(jié)構(gòu)域是磷酸酶去磷酸化作用的功能結(jié)構(gòu)域〔6〕。本實驗結(jié)果可見STAT3與PTPMeg兩種蛋白的所有結(jié)構(gòu)域之間都有相互作用,具體機(jī)制不是特別清楚。內(nèi)源性的蛋白之間相互作用仍然是蛋白的全長在起作用,PTPMeg2的全長蛋白就對磷酸化的STAT3起到直接和間接的去磷酸化作用,而PTPMeg2的PTP結(jié)構(gòu)域也是其發(fā)揮去磷酸化作用的功能結(jié)構(gòu)域〔4〕。本研究發(fā)現(xiàn)含有PTP結(jié)構(gòu)域的片段都可以對磷酸化STAT3起到抑制作用,這種抑制是否是與親核蛋白形成的大的復(fù)核體而阻止其入核,還是封閉了STAT3的核定位信號蛋白的功能,還需要進(jìn)一步深入研究。
1 Ruff-Jamison S,Chen K,Cohen S.Induction by EGF and interferon-gamma of tyrosine phosphorylated DNA binding proteins in mouse liver nuclei〔J〕.Science,1993;261(5129):1733-6.
2 Besser D,Bromberg JF,Darnell JE,et al.A single amino acid substitution in the v-Eyk intracellular domain results in activation of Stat3 and enhances cellular transformation〔J〕.Mol Cell Biol,1999;19(2):1401-9.
3 Groner B,Lucks P,Borghouts C.The function of Stat3 in tumor cells and their microenvironmen〔tJ〕.Semin Cell Dev Biol,2008;19(4):341-50.
4 Su F,Ren F,Rong Y,et al.Protein tyrosine phosphatase Meg2 dephosphorylates signal transducer and activator of transcription 3 and suppresses tumor growth in breast cancer〔J〕.Breast Cancer Res,2012;14(2):2-13.
5 Yuan T,Wang Y,Zhao ZJ,et al.Protein-tyrosine phosphatase PTPN9 negatively regulates ErbB2 and epidermal growth factor receptor signaling in breast cancer cells〔J〕.J Biol Chem,2010;285(20):14861-70.
6 Resemann HK,Watson CJ,Lloyd-Lewis B.The Stat3 paradox:a killer and an oncogene〔J〕.Mol Cell Endocrinol,2013;382(1):603-11.
7 Ohtani T,Ishihara K,Atsumi T,et al.Dissection of signaling cascades through gp130 in vivo:reciprocal roles for STAT3-and SHP2-mediated signals in immune responses〔J〕.Immunity,2000;12(1):95-105.
8 Caceres-Cortes JR.A potent anti-carcinoma and anti-acute myeloblastic leukemia agent,AG490〔J〕.Anticancer Agents Med Chem,2008;8(7):717-22.
9 Nagaraj NS,Smith JJ,Revetta F,et al.Targeted inhibition of SRC kinase signaling attenuates pancreatic tumorigenesis〔J〕.Mol Cancer Ther,2010;9(8):2322-32.
10 Zhang L,Badgwell DB,Bevers JJ,et al.IL-6 signaling via the STAT3/SOCS3 pathway:functional analysis of the conserved STAT3 N-domain〔J〕.Mol Cell Biochem,2006;288(1-2):179-89.
11 Lufei C,Ma J,Huang G,et al.GRIM-19,a death-regulatory gene product,suppresses Stat3 activity via functional interaction〔J〕.Embo J,2003;22(6):1325-35.
12 Chung CD,Liao J,Liu B,et al.Specific inhibition of Stat3 signal transduction by PIAS3〔J〕.Science,1997;278(5344):1803-5.
13 Daino H,Matsumura I,Takada K,et al.Induction of apoptosis by extracellular ubiquitin in human hematopoietic cells:possible involvement of STAT3 degradation by proteasome pathway in interleukin 6-dependent hematopoietic cells〔J〕.Blood,2000;95(8):2577-85.
14 Tanaka T,Yamamoto Y,Muromoto R,et al.PDLIM2 inhibits T helper 17 cell development and granulomatous inflammation through degradation of STAT3〔J〕.Sci Signal,2011;4(202):85.
15 Fossey SL,Bear MD,Lin J,et al.The novel curcumin analog FLLL32 decreases STAT3 DNA binding activity and expression,and induces apoptosis in osteosarcoma cell lines〔J〕.BMC Cancer,2011;11(2):112.
16 Onimoe GI,Liu A,Lin L,et al.Small molecules,LLL12 and FLLL32,inhibit STAT3 and exhibit potent growth suppressive activity in osteosarcoma cells and tumor growth in mice〔J〕.Invest New Drugs,2012;30(3):916-26.
17 Couto JI,Bear MD,Lin J,et al.Biologic activity of the novel small molecule STAT3 inhibitor LLL12 against canine osteosarcoma cell lines〔J〕.BMC Vet Res,2012;8(5):244.
18 Patel K,Kollory A,Takashima A,et al.MicroRNA let-7 downregulates STAT3 phosphorylation in pancreatic cancer cells by increasing SOCS3 expression〔J〕.Cancer Lett,2014;347(1):54-64.
R-33
A
1005-9202(2015)09-2355-04;
10.3969/j.issn.1005-9202.2015.09.020
黑龍江省自然科學(xué)基金(No.D201084)
1 清華大學(xué)醫(yī)學(xué)院 2 齊齊哈爾醫(yī)學(xué)院藥理教研室
李淑艷(1968-),女,教授,博士,主要從事腫瘤生物治療研究。
蘇富琴(1971-),女,副教授,博士,主要從事蛋白修飾與腫瘤發(fā)生發(fā)展關(guān)系及抗腫瘤藥物研究。
〔2014-03-11修回〕
(編輯 袁左鳴/滕欣航)

