硫氫化鈉預處理大鼠腎缺血再灌注損傷對肝臟組織的影響*
賈小艷,陳勤,李飛,馮偉,杜靖
(1.新疆醫科大學厚博學院,新疆烏魯木齊 830011;2.新疆醫科大學高職學院機能教研室,新疆烏魯木齊 830011;3.武警新疆總隊醫院,新疆烏魯木齊 830091)
硫氫化鈉預處理大鼠腎缺血再灌注損傷對肝臟組織的影響*
賈小艷1,陳勤2,李飛3,馮偉1,杜靖2
(1.新疆醫科大學厚博學院,新疆烏魯木齊 830011;2.新疆醫科大學高職學院機能教研室,新疆烏魯木齊 830011;3.武警新疆總隊醫院,新疆烏魯木齊 830091)
目的探討硫氫化鈉(NaHS)預處理大鼠腎缺血再灌注損傷(RIRI)對肝臟組織的影響。方法清潔級雄性Wistar大鼠30只,體重250~300 g,采用隨機數字表法分為5組(n=6):假手術組(S組)、腎缺血90 min再灌注60 min組(I/R 1組)、腎缺血120 min再灌注60 min組(I/R 2組)、NaHS+腎缺血90 min組(A組)、NaHS+腎缺血120 min組(B組)。采用右腎切除后左腎分別缺血90和120 min再灌注60 min的方法制備RIRI模型。A、B組于再灌注前20 min腹腔注射NaHS 100μg/kg,其余同I/R 1、2組。再灌注結束時腹主動脈采血3 ml,檢測血清肌酐(Scr)、尿素氮(BUN)、丙氨酸氨基轉移酶(ALT)、門冬氨酸氨基轉移酶(AST)含量,并取腎、肝臟組織,光鏡下觀察病理結果,酶聯免疫法(ELISA)檢測硫化氫(H2S)含量,肝臟組織采用硫代巴比妥酸顯色法檢測丙二醛(MDA)含量,二硫二硝基苯甲酸法檢測谷胱甘肽過氧化物酶(GSH-Px)活性。結果與S組比較,I/R 1、2組血清中Scr、BUN、ALT、AST含量升高,腎、肝臟組織H2S含量降低,肝臟組織MDA含量升高,GSH-Px活性降低,差異有統計學意義(P<0.05),腎臟及肝臟組織出現病理損傷。與I/R 1組比較,I/R 2組血清中Scr、BUN含量升高,A組血清中ALT、AST含量降低,腎與肝臟組織H2S含量升高,肝臟組織MDA含量降低,GSH-Px活性升高,差異有統計學意義(P<0.05),腎臟及肝臟組織病理損傷減輕。與I/R 2組比較,B組血清中ALT、AST含量降低,腎與肝臟組織H2S含量升高,肝臟組織MDA含量降低,GSH-Px活性升高,差異有統計學意義(P<0.05),腎臟及肝臟組織病理損傷減輕。結論大鼠RIRI誘發遠隔器官肝臟組織損傷與組織內H2S含量降低有關,外源性NaHS可減輕大鼠RIRI引起的遠隔器官肝臟組織損傷,其機制與抗脂質過氧化作用有關。
硫氫化鈉;腎缺血再灌注損傷;肝臟組織;丙二醛;谷胱甘肽過氧化物酶
腎缺血再灌注損傷(renal ischemia-reperfusion injury,RIRI)即腎臟在缺血的基礎上恢復血流,組織損傷進一步加重[1]。腎臟由于其功能及血流分布特點,使其對缺血及缺血再灌注敏感,RIRI是臨床上導致急性腎小管壞死和腎移植失敗的重要因素[2]。許多研究顯示[3-4],RIRI不僅損傷原位組織器官,還會誘發遠隔器官損傷,嚴重影響疾病的轉歸及預后。因此,研究防治RIRI及對遠隔器官的影響,對解決臨床實際問題有積極的指導意義。
硫化氫(hydrogen sulfide,H2S)作為體內新型的氣體信號分子,廣泛參與機體多器官系統的功能調節。多項動物實驗研究顯示[5-6],外源性H2S供體硫氫化鈉(sodium hydrosulphide,NaHS)對組織器官缺血再灌注及遠隔器官有保護作用,但其機制尚不清楚。本研究通過給予NaHS溶液對不同時間RIRI模型大鼠進行缺血前預處理,擬探討H2S對不同時間RIRI大鼠肝臟組織的影響及機制,為RIRI的防治提供新手段。
1 材料與方法
1.1 實驗動物與分組
清潔級Wistar雄性大鼠30只,由新疆醫科大學實驗動物中心提供,體重250~300 g,采用隨機數字表法分為5組(n=6):假手術組(S組)、缺血90 min再灌注60 min組(I/R 1組)、缺血120 min再灌注60 min組(I/R 2組)、NaHS+腎缺血90 min組(A組)、NaHS+腎缺血120 min組(B組),實驗開始前禁食12 h,自由飲水。
1.2 不同時間RIRI模型制備
10 %水合氯醛(0.5 ml/100 g)腹腔注射麻醉大鼠后,鼠臺固定,沿腹白線開腹約5 cm,鈍性分離皮下組織與筋膜,暴露腹腔。S組游離雙側腎蒂,只穿線,不結扎。I/R 1組暴露右腎及腎蒂,雙線結扎后切除右腎作為自身對照,再暴露左腎及腎蒂,分離腎包膜及左腎動脈,用1根絲線將開口一面朝上的塑料軟管和動脈固定好,可見左腎顏色由鮮紅變為暗紅,腎缺血模型成功,缺血90 min后沿塑料管先前的切口剪開絲線,恢復動脈血供,若腎臟顏色逐漸由暗紅變成鮮紅色表明再灌注成功。I/R 2組缺血120 min后恢復組織血供,余操作與I/R 1組相同。A、B組于再灌注前20 min腹腔注射NaHS 100μg/kg(Sigma公司,美國),余操作同I/R 1、2組;S組、I/R 1組和I/R 2組以等容量生理鹽水替代NaHS。操作完成后關閉腹腔,并于腹部覆蓋紗布,手術燈光照射以保溫并計時。
1.3 觀察指標
再灌注60 min結束時打開腹腔,實驗各組大鼠均腹主動脈采血3 ml,緩慢注入EP管,TGL-20M離心機(成都泰盟儀器公司)4℃、3000r/min離心10min后取上清液。意大利AUTOLAB自動生化儀檢測血清肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen BUN)、丙氨酸氨基轉移酶(alanine amino transferase,ALT)和門冬氨酸氨基轉移酶(aepartate aminotransferase,AST)含量。采集完血樣,斷頭處死大鼠,取左腎后將切口向大鼠頭端延長,取肝臟左上葉。從中間剖開腎臟,與肝臟組織一同置于冷磷酸鹽溶液(0.1 mol/L,pH值7.4)中沖洗干凈并吸干表面水分,取腎下極和肝臟組織各一塊置于10%中性甲醛溶液中固定,常規石蠟包埋、切片,HE染色,光學顯微鏡BX51(Olympus公司,日本)觀察病理變化。冰板上留取相同部位腎、肝臟組織各0.5 g,MP-2002分析天平(上海梅特勒托利多儀器有限公司)稱重并以1∶9比例加入冷生理鹽水,ZS-83-1型內切式組織勻漿器(成都泰盟儀器公司)制備組織勻漿,低溫3 500 r/min離心10 min,取上清液,WD-2102A型自動酶標儀(北京六一儀器廠)、酶聯免疫法(enzyme linked immunosorbent assay,ELISA)檢測H2S含量,硫代巴比妥酸顯色法檢測肝組織中丙二醛(malonaldehyde,MDA)含量,二硫二硝基苯甲酸法檢測谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性(南京建成生物工程研究所)。
1.4 統計學方法
采用SPSS 17.0統計學軟件進行數據分析,計量資料用均數±標準差(±s)表示,方差齊比較用單因素方差分析,組間兩兩比較用LSD法,方差不齊用秩和檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 肝、腎組織形態學變化
2.1.1 肝臟組織①S組肝細胞結構組織正常,肝細胞排列整齊,細胞核染色較淺,核質分布均勻,呈球形(見圖1);②I/R 1組肝小葉結構存在,部分肝細胞核濃縮,部分肝竇擴張(見圖2);③I/R 2組肝小葉結構存在,肝細胞顯著水腫,肝細胞脂肪變性,肝竇擴張,枯否細胞輕度增生(見圖3);④A組肝小葉結構存在,個別肝細胞脂肪變性,枯否細胞輕度增生(見圖4);⑤B組肝小葉結構存在,肝細胞點、灶狀壞死,肝竇擴張,枯否細胞輕度增生,匯管區輕度擴大,見少許淋巴細胞及漿細胞增生(見圖5)。
2.1.2 腎臟組織①S組腎單位結構正常(見圖6);②I/R 1組腎小球毛細血管內皮輕度增生,腎小球球囊腔輕度增寬,腎小管上皮輕度水腫、空泡變性(見圖7);③I/R 2組腎小管上皮顯著水腫,空泡變性,個別腎小管上皮細胞核消失,間質血管增生、擴張充血(見圖8);④A組腎小囊擴張,腎小管細胞變性程度減輕,未見明顯異常(見圖9);⑤B組腎小球毛細血管內皮細胞輕度增生,腎小管上皮輕度水腫(見圖10)。
2.2 肝、腎組織功能變化
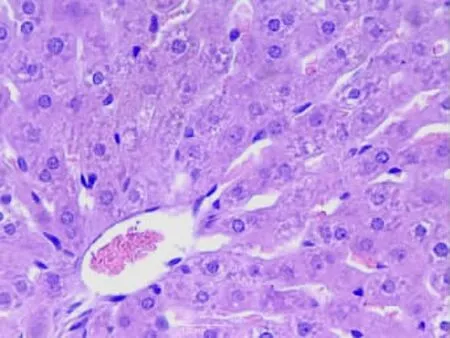
圖1 S組肝組織(HE×40)
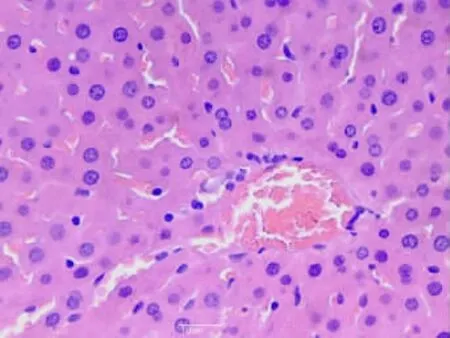
圖2 I/R 1組肝組織(HE×40)
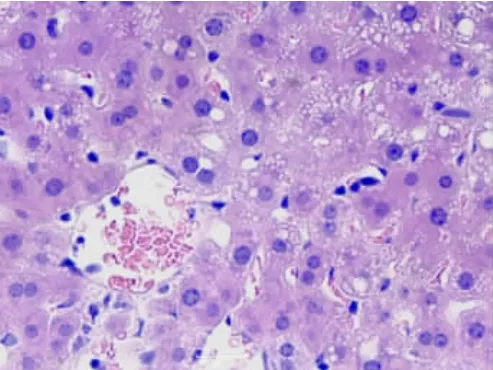
圖3 I/R 2組肝組織(HE×40)
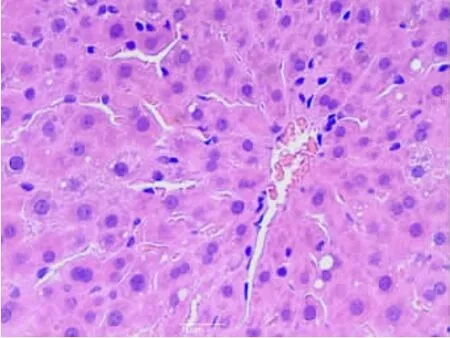
圖4 A組肝組織(HE×40)
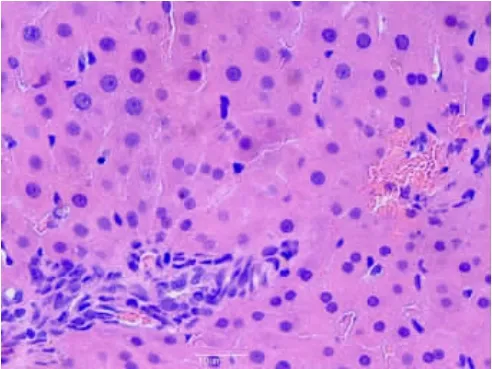
圖5 B組肝組織(HE×40)

圖6 S組腎組織(HE×40)

圖7 I/R 1組腎組織(HE×40)
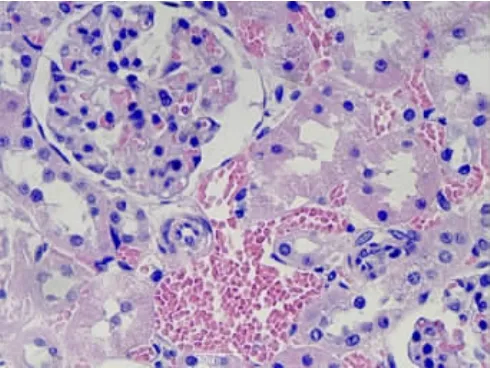
圖8 I/R 2組腎組織(HE×40)
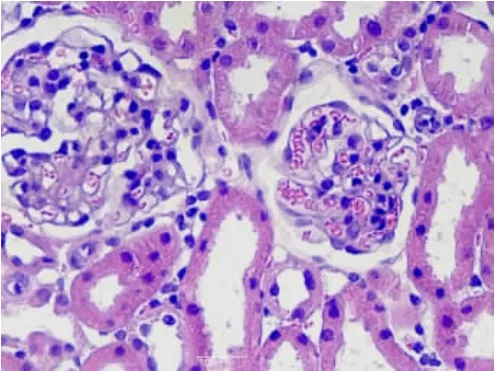
圖9 A組腎組織(HE×40)
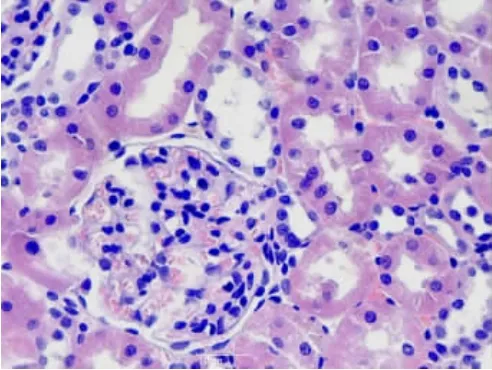
圖10 B組腎組織(HE×40)
與S組比較,I/R 1組和I/R 2組血清中Scr、BUN、ALT、AST含量升高;與I/R 1組比較,I/R 2組血清中Scr、BUN含量升高,A組血清中ALT、AST含量降低;與I/R 2組比較,B組血清中ALT、AST含量降低,差異有統計學意義(P<0.05)。方差齊性檢驗顯示,FScr=0.982,P=0.397;FBUN=0.316,P=0.734;FALT=0.181,P=0.947;FAST=1.595,P=0.207。單因素方差分析顯示,FScr=13.743,P=0.000;FBUN=155.072,P= 0.000;FALT=1235.374,P=0.000;FAST=1 254.459,P= 0.000。見表1、2。
2.3 肝、腎組織勻漿H2S含量
與S組左腎比較,I/R 1、2組自身對照右腎組織H2S含量差異無統計學意義(P>0.05);與S組左腎比較,肝、腎組織H2S含量降低;與I/R 1組比較,A組肝、腎組織H2S含量升高;與I/R 2組比較,B組肝、腎組織H2S含量升高,差異有統計學意義(P<0.05)。方差齊性檢驗顯示,F肝組織=0.925,P=0.464;F腎組織= 0.612,P=0.657。單因素方差分析顯示,F肝組織=35.805,P=0.000;F腎組織=11.077,P=0.000。見表3。
表1 大鼠血清Scr、BUN含量比較(n=6,±s)

表1 大鼠血清Scr、BUN含量比較(n=6,±s)
注:1)與I/R 1組比較,P=0.005;2)與I/R 1組比較,P=0.000;3)與I/R 2組比較,P=0.046;4)與I/R 2組比較,P=0.003;5)與S組比較,P=0.000
組別Scr/(μmol/L)BUN/(mmol/L)S組126.28±4.221)3.99±0.282)I/R 1組140.71±10.213)7.24±0.524)I/R 2組150.76±6.235)8.06±0.345)
表2 大鼠血清ALT、AST含量比較(n=6,u/L,±s)
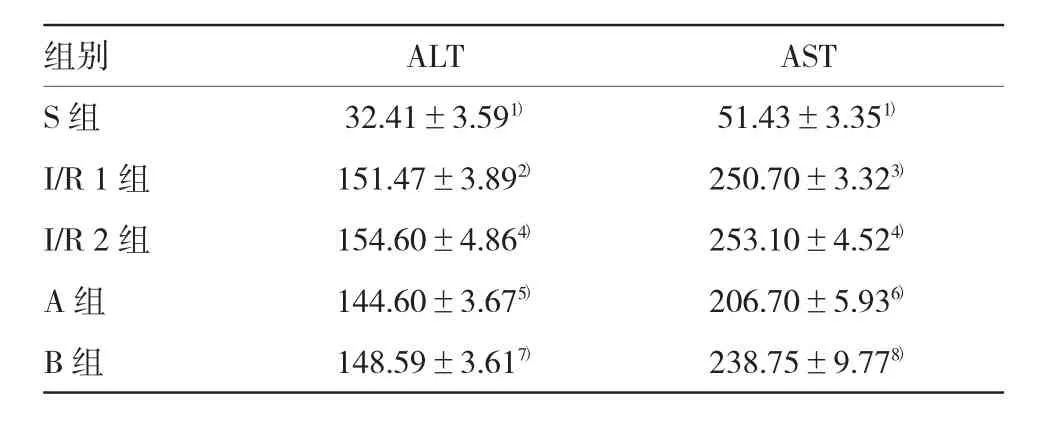
表2 大鼠血清ALT、AST含量比較(n=6,u/L,±s)
注:1)與I/R 1組比較,P=0.000;2)與I/R 2組比較,P=0.056;3)與I/R 2組比較,P=0.060;4)與S組比較,P=0.000;5)與I/R 1組比較,P=0.040;6)與I/R 1組比較,P=0.048;7)與I/R 2組比較,P= 0.047;8)與I/R 2組比較,P=0.000
組別ALTAST S組32.41±3.591)51.43±3.351)I/R 1組151.47±3.892)250.70±3.323)I/R 2組154.60±4.864)253.10±4.524)A組144.60±3.675)206.70±5.936)B組148.59±3.617)238.75±9.778)
2.4 肝臟組織勻漿MDA含量及GSH-Px活性
與S組比較,肝臟組織MDA含量升高,GSH-Px活性降低;與I/R 1組比較,A組肝臟組織MDA含量降低,GSH-Px活性升高;與I/R 2組比較,B組肝臟組織MDA含量降低,GSH-Px活性升高,差異有統計學意義(P<0.05)。方差齊性檢驗顯示,FMDA=2.535,P=0.65;FGSH-Px=2.489,P=0.076。單因素方差分析顯示,FMDA=8.599,P=0.000;FGSH-Px=18.407,P=0.000。見表4。
表3 大鼠肝、腎組織中H2S含量比較(n=6,pg/ml,±s)
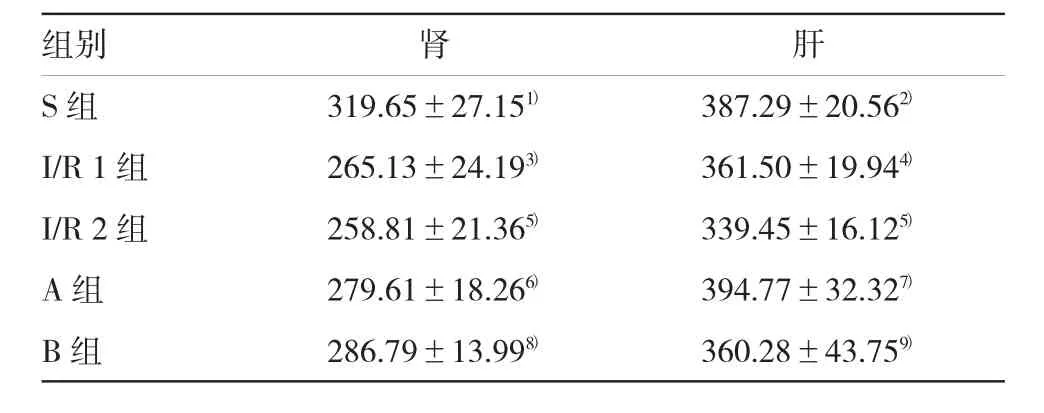
表3 大鼠肝、腎組織中H2S含量比較(n=6,pg/ml,±s)
注:1)與I/R 1組比較,P=0.001;2)與I/R 1組比較,P=0.000;3)與I/R 2組比較,P=0.524;4)與I/R 2組比較,P=0.041;5)與S組比較,P=0.000;6)與I/R 1組比較,P=0.046;7)與I/R 1組比較,P=0.000;8)與I/R 2組比較,P=0.000;9)與I/R 2組比較,P=0.046
組別腎肝S組319.65±27.151)387.29±20.562)I/R 1組265.13±24.193)361.50±19.944)I/R 2組258.81±21.365)339.45±16.125)A組279.61±18.266)394.77±32.327)B組286.79±13.998)360.28±43.759)
表4 大鼠肝臟組織MDA含量、GSH-Px活性比較(n=6,±s)
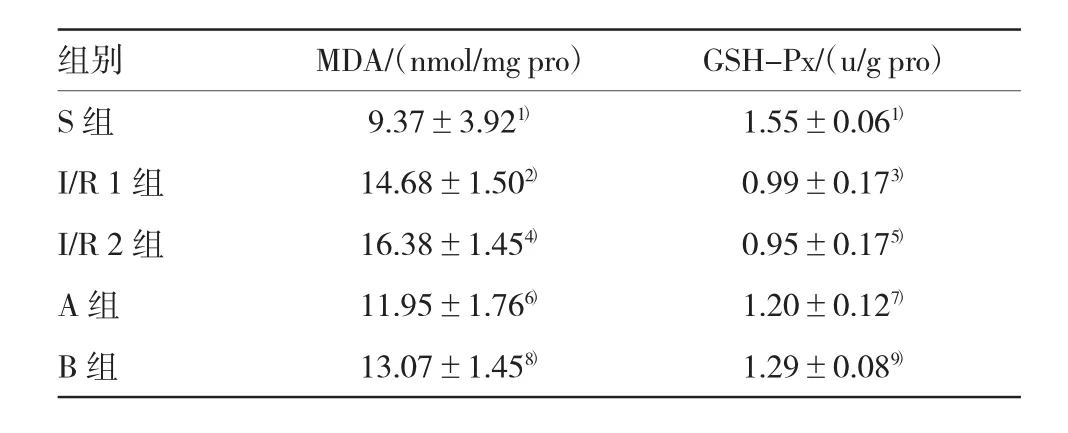
表4 大鼠肝臟組織MDA含量、GSH-Px活性比較(n=6,±s)
注:1)與I/R 1組比較,P=0.000;2)與I/R 2組比較,P=0.054;3)與I/R 2組比較,P=0.066;4)與S組比較,P=0.045;5)與S組比較,P= 0.000;6)與I/R 1組比較,P=0.044;7)與I/R 1組比較,P=0.036;8)與I/R 2組比較,P=0.039;9)與I/R 2組比較,P=0.030
組別MDA/(nmol/mg pro)GSH-Px/(u/g pro)S組9.37±3.921)1.55±0.061)I/R 1組14.68±1.502)0.99±0.173)I/R 2組16.38±1.454)0.95±0.175)A組11.95±1.766)1.20±0.127)B組13.07±1.458)1.29±0.089)
3 討論
本實驗采用右腎切除和左腎結扎后再灌注方法制備RIRI模型[7],張榮等[8]選擇腎缺血90和120 min后再灌注60min作為RIRI組,通過檢測血清Scr、BUN含量及腎組織病理形態學改變驗證制備模型。本研究中,與S組大鼠相比,I/R 1、2組血清Scr、BUN含量升高,腎組織有病理損傷,腎功能受損,與報道一致[9-10],說明RIRI模型制備成功。
RIRI是一個十分復雜的病理生理過程,氧自由基產量大于腎臟自身抗氧化防御系統可引起脂質、蛋白質和DNA損傷,進而導致細胞功能障礙以及組織損傷[11]。肝臟是人體內最大的實質性臟器,血流量大,易受循環中的有害物質影響而致肝臟病理及肝功能損傷,因此本實驗選擇肝臟作為RIRI的遠隔器官。RIRI造成遠隔器官肝臟組織損傷機制尚不明確,推測可能機制為來源于腎臟的各種化學物質包括氧自由基、細胞因子、黏附分子等大量進入體循環。
MDA是不飽和脂肪酸過氧化分解的終產物,其含量的高低不僅可以直接反映體內脂質過氧化的強度和速率,還可以間接反應組織或細胞損傷的嚴重程度,常被作為判斷缺血再灌注損傷的重要依據[12]。GSH-Px是機體內廣泛存在的一種重要的過氧化物分解酶,能催化還原型谷胱甘肽(glutathione,GSH)變為氧化型GSH,使有毒的過氧化物還原成無毒的羥基化合物,同時促進雙氧水H2O2的分解,從而保護細胞膜結構及功能不受過氧化物的干擾和損害[13]。本研究選擇上述2項指標,以探討RIRI對遠隔器官肝臟組織的影響是否與氧化應激有關,并以血清ALT、AST含量高低反映肝功能的受損程度。結果顯示,與S組比較,I/R 1、2組血清ALT、AST含量升高,肝臟組織MDA含量升高,GSH-Px活性降低,肝、腎組織形態學出現損傷,提示大鼠RIRI可誘發肝臟組織損傷,其機制與抗氧化有關。因此針對抗氧化進行的靶向治療可能對減輕RIRI誘發的遠隔器官損傷具有一定的作用。
H2S作為一種氣體信號分子,在體內1/3以氣體H2S形式,2/3以NaHS形式存在。NaHS在體內通過解離作用與H2S形成一種動態平衡,且NaHS濃度便于精確定量H2S濃度,因此本研究以NaHS作為H2S供體。本實驗前期研究中,外源性給予NaHS 100μg/kg能明顯升高腎臟組織中H2S濃度,但對正常大鼠腎功能無顯著影響,也不引起形態學改變。前期結果中H2S對RIRI大鼠腎組織及遠隔器官腦組織有保護作用,其在腎、腦組織的含量高低與其損傷程度有關,但其機制尚不清楚。多項研究表明[14-16],H2S可通過抗氧化作用減輕缺血再灌注組織、細胞損傷。本實驗中,分別給予I/R 1、2組大鼠再灌注前20 min腹腔注射NaHS溶液,檢測血清ALT、AST含量及肝臟組織MDA含量、GSH-Px活性,觀察肝、腎組織病理改變并檢測其H2S含量,研究RIRI大鼠引起的原位器官和遠隔器官肝臟組織損傷是否與內源性H2S含量變化有關,給予外源性H2S供體是否可改善原位器官和遠隔器官肝臟組織損傷,這種改善是否與抗氧化機制有關。研究結果顯示,與I/R1組比較,A組血清中ALT、AST含量降低,肝、腎組織H2S含量升高,肝臟組織MDA含量降低,GSH-Px活性升高,肝、腎組織病理損傷減輕。與I/R 1組比較,I/R 2組血清Scr、BUN含量升高,肝臟組織H2S含量下降,差異有統計學意義(P<0.05);I/R 2組肝、腎組織病理損傷表現更明顯。I/R 1、2組血清ALT和AST含量、肝臟組織MDA含量、GSH-Px活性、腎組織H2S含量比較,差異無統計學意義,考慮與I/R 1、2組缺血時間相差較小有關,為今后的實驗方向提供思路。與I/R 2組比較,B組血清中ALT、AST含量降低,肝、腎組織H2S含量升高,肝臟組織MDA含量降低,GSH-Px活性升高,肝、腎組織病理學損傷減輕,提示大鼠RIRI誘發的遠隔器官肝臟組織損傷與組織內H2S含量降低有關;外源性NaHS可減輕大鼠不同時間RIRI引起的遠隔器官肝臟組織損傷,其機制與抗氧化有關。
目前,H2S的抗氧化損傷作用機制尚不明確,近年來的實驗研究指出:①H2S可通過激活核因子網織紅細胞相關因子-2(nuclear factor cry-throid-2-related factor 2,Nrf-2)信號分子活性,調節細胞內氧化還原環境起到抗氧化作用[17-19];②H2S通過下調NADH氧化酶活性,抑制活性氧物質產生[20];③H2S通過提高細胞內還原型谷胱甘肽的生成能力及線粒體中谷胱甘肽的比重,提高抗氧化能力[14]。
綜上所述,大鼠RIRI誘發的遠隔器官肝臟組織損傷與組織內H2S含量降低有關,且隨著腎缺血時間延長,再灌注后腎組織及遠隔器官肝臟組織損傷加重,過氧化物水平升高。外源性NaHS可減輕不同時間RIRI引起的大鼠遠隔器官肝臟組織損傷,其機制與抗氧化有關。
[1]BORTHWICK E,FERGUSON A.Perioperative acute kidney injury:risk factors,recognition,management,and outcomes[J].BMJ, 2010,341(5):85-91.
[2]SHIFOW AA,KUMAR KV,NAIDU MUR,et al.Melatonin a pineal hormone with antioxidant property protects against gentamicin-induced nephrotoxicity in rats[J].Nephron,2000,85:167-174.
[3]張莉,張勇,唐曉,等.右美托咪定對腎缺血再灌注誘發大鼠心肌損傷的影響[J].中華麻醉學雜志,2014,34(8):1017-1021.
[4]GU J,CHEN J,XIA P,et al.Dexmedetomidine attenuates remote lung injury induced by renal ischemia-reperfusion in mice [J].Acta Anaesthesiol Scand,2011,55:1272-1278.
[5]覃志成,石媛媛,閏燕,等.硫化氫通過抑制NOD樣受體途徑減輕腎臟缺血再灌注損傷[J].中華腎病學雜志,2014,30(8):604-609.
[6]JOHANSEN D,YTREHUS K,BAXTER GF.Exogenous hydrogen sulfide(H2S)protects against regional myocardialIschemia reperfusion in-jury evidence for a role of KATP channels[J].Basic Res Cardiol,2006,101(1):53-60.
[7]杜靖,張冰,代紅燕,等.外源性硫化氫對大鼠腎缺血再灌注誘發心肌損傷的影響[J].中華麻醉學雜志,2014,34(12):1478-1480.
[8]張榮,張建龍,馬琪,等.中性粒細胞在大鼠腎缺血再灌注造成肺損傷中的作用研究[J].四川解剖學雜志,2008,16(3):4-9.
[9]黃海燕,陳克研,孫瑩杰,等.右美托咪定對大鼠腎缺血再灌注誘發肺損傷的影響[J].中華麻醉學雜志,2014,34(2):230-233.
[10]田明,馬宏仲,姜秀良,等.缺血后處理對大鼠腎缺血再灌注時cfos蛋白表達的影[J].中華麻醉學雜志,2014,34(6):758-762.
[11]KHANMORADI M,MARD SA,ABOUTALEB N,et al.The protective activity of noscapine on renal ischemia reperfusion injury in male wistar rat[J].Irannian Journal of Basic Medical Sciences,2014,17(1):244-249.
[12]葛緬,池信錦,劉德昭,等.大鼠自體原位肝移植模型中腸道羥自由基、丙二醛和總抗氧化能力的變化[J].中國病理生理雜志,2012, 28(4):723-726.
[13]耿亞松,杜津.反映H2S在肝缺血再灌注損傷中保護作用的檢測指標研究進展[J].國際檢驗醫學雜志,2012,33(22):2739-2742.
[14]KIMURA Y,GOTO Y,KIMURA H.Hydrogen sulfide increases glutathione production and suppresses oxidative stress in mitoehondria[J].Antioxid Redox Signal,2010,12(1):l-13.
[15]FU ZF,LIU XM,GENG B,et al.Hydrogen sulfide protects rat lung from ischemia-reperfusion injury[J].Life Sci,2008,82 (23/24):1196-1202.
[16]CALVERT JW,JHA S,GUNDEWAR S,et al.Hydrogen sulfide mediates cardioprotection through Nrf2 signaling[J].Circ Res, 2009,105(4):365-374.
[17]KUMAR A,TAKADA Y,BORIEK AM,et al.Nuclear factor-kappaB:its role in health and disease[J].J Mol Med,2004, 82:434-448.
[18]MANKAN AK,LAWLESS MW,GRAY SG,et al.NF-kappa B regulation:the nuclear response[J].J Mol Med,2009,13:631-643.
[19]JAISWAL AK.Nrf2 signaling in coordinated activation of antioxidant gene expression[J].Free Radic Biol Med,2004,36(10): 1199-1207.
[20]SAMHAN-ARIAS AK,GARCIA-BEREGUIAIN MA,GUTIERREZ-MERINO C.Hydrogen sulfide is a reversible inhibitor of the NADH oxidase activity of synaptic plasma membranes[J]. Biochem Biophys Res Commun,2009,388(4):718-722.
(申海菊編輯)
Effect of sodium hydrosulfide preconditioning on hepatic tissue following renal ischemia-reperfusion injury in rats*
Xiao-yan JIA1,Qin CHEN2,Fei LI3,Wei FENG1,Jing DU2
(1.Houbo College,Xinjiang Medical University,Urumqi,Xinjiang 830011,P.R.China;2. Department of Medical Physiology&Biochemistry,Higher Vocational College,Xinjiang Medical University,Urumqi,Xinjiang 830011,P.R.China;3.Xinjiang Corps Hospital of the Chinese People's Armed Police Force,Urumqi,Xinjiang 830091,P.R.China)
【Objective】To observe the effect of sodium hydrosulfide(NaHS)on hepatic tissue following renal ischemia-reperfusion injury(RIRI)in rats.【Methods】Thirty male Wistar rats weighing 250~300 g were randomized into 5 groups(6 in each group)using a random number table:sham operation group(group S); group I/R 1 with 60 min reperfusion following 90 min ischemia;group I/R 2 with 60 min reperfusion following 120 min ischemia;group A with NaHS+60 min reperfusion following 90 min ischemia and group B with NaHS+60 min reperfusion following 120 min ischemia.RIRI was induced by right nephrectomy and occlusion of the left kidney artery for about 90 min or 120 min followed by 60 min reperfusion in rats anesthetized with intraperitoneal chloral hydrate.NaHS 100 μg/kg was injected intraperitoneally 20 min before ischemia in the groups A and B,and the rest procedures were similar to those previously described in the groups I/R 1 and I/R 2.Blood samples were collected at the end of reperfusion to determine serum creatinine(Scr),blood urea nitrogen(BUN),alanine aminotransferase(ALT)and aspartate aminotransferase(AST)concentrations.Kidney and hepatic tissue were removed for microscopic examination.The content of H2S was determined in the renal and hepatic tissuethrough enzyme linked immunosorbent assay(ELISA).The content of malonaldehyde(MDA) was determined in the hepatic tissue through thiobarbituric acid method and the activity of glutathione peroxidase(GSH-PX)through 5,5-dithio-bis-2-nitrobenzoic acid(DTNB)method.【Results】Compared with the group S,serum Scr,BUN,ALT and AST concentrations were significantly increased,the content of H2S in the renal and hepatic tissue was significantly decreased,the MDA concentration of hepatic tissue was significantly increased and GSH-PX concentration was significantly decreased in the groups I/R 1 and I/R 2(P<0.05).Microscopic examination showed that both kidney tissue and hepatic tissue were severely damaged. Compared with the group I/R 1,serum Scr and BUN concentrations were significantly increased(P<0.05); ALT and AST concentrations were significantly decreased,the content of H2S in the renal and hepatic tissue was significantly increased,the MDA concentration of hepatic tissue was significantly decreased and GSH-PX concentration was significantly increased in the group I/R 2(P<0.05)and the pathological changes of both kidney tissue and hepatic tissue were significantly attenuated.Compared with the group I/R 2,ALT and AST concentrations were significantly decreased,the content of H2S in the renal and hepatic tissue was significantly increased,the MDA concentration of hepatic tissue was significantly decreased and GSH-PX concentration was significantly increased in the group B(P<0.05)and the pathological changes of both kidney tissue and hepatic tissue were significantly attenuated.【Conclusions】Hepatic tissue injury induced by renal ischemiareperfusion in rats is associated with decrease in hydrogen sulfide content of tissue.Exogenous NaHS can attenuate hepatic tissue injury induced by renal ischemia-reperfusion in rats and antioxidant system is involved in the mechanism.
hydrogen sulfide;renal ischemia-reperfusion injury;hepatic tissue;malonaldehyde;glutathione peroxidase
R364.1
A
1005-8982(2015)23-0007-06
2015-02-09
新疆醫科大學大學生創新性實驗計劃項目(No:CX2015085)
杜靖,E-mail:dujingzhw@qq.com

