低劑量靜脈注射米諾環素后處理對大鼠缺血再灌注心肌的保護作用
張利群,陳詠君,崔仁善,齊國先
(1.沈陽醫學院護理學院人文教研室,沈陽 110034;2.沈陽醫學院沈洲醫院檢驗科,沈陽 110002;3.中國醫科大學附屬第一醫院心內科,沈陽 110001)
·論著·
低劑量靜脈注射米諾環素后處理對大鼠缺血再灌注心肌的保護作用
張利群1,陳詠君2,崔仁善1,齊國先3
(1.沈陽醫學院護理學院人文教研室,沈陽 110034;2.沈陽醫學院沈洲醫院檢驗科,沈陽 110002;3.中國醫科大學附屬第一醫院心內科,沈陽 110001)
目的探討低劑量靜脈注射米諾環素后處理對大鼠心肌缺血再灌注損傷的保護作用及可能機制。方法48只雄性Wistar大鼠隨機均分為假手術組(SO組)、缺血再灌注組(IR組)、低劑量米諾環素組(3 mg/kg,IR+LM組)和高劑量米諾環素組(10 mg/kg,IR+HM組)。通過結扎大鼠左冠狀動脈前降支45 min,復灌120 min,建立心肌缺血再灌注損傷模型。再灌注后,檢測各組大鼠心臟血流動力學、血清肌酸激酶MB型(CK-MB)和心肌肌鈣蛋白Ⅰ(cTn-Ⅰ)的水平、血清及缺血心肌丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性、心肌凋亡指數(AI)以及HE染色,觀察心肌病理改變。結果與IR組比較,低、高劑量米諾環素均能降低左心室舒張末壓、CK-MB、cTn-Ⅰ、AI以及MDA含量,升高左心室收縮壓、左心室變化速率最大值及SOD活性(P均<0.05)。IR+HM組與IR+LM組比較上述指標差異均無統計學意義(P>0.05)。結論低劑量米諾環素后處理減輕大鼠心肌缺血再灌注損傷,其機制與清除氧自由基、抑制脂質氧化反應和抑制凋亡有關。
米諾環素;缺血后處理;心肌缺血再灌注損傷
近年發現米諾環素(minocycline,M)對缺血心肌細胞具有保護作用,研究中米諾環素多采用預處理與腹腔注射,應用劑量是臨床用于抗感染、抗炎常規劑量的30倍[1,2]。目前尚不清楚相當于人類安全應用的較低劑量米諾環素靜脈注射是否仍具有心肌保護作用。本研究首次采用低劑量米諾環素(3 mg/kg),相當于臨床應用標準劑量200 mg的給藥劑量[3],觀察其后處理對缺血再灌注(ischemia-reperfusion,IR)心肌的作用,探討其對氧化應激的影響,為米諾環素防治心肌再灌注損傷的可行性和臨床轉化提供理論依據。
1 材料與方法
1.1 實驗動物及分組
雄性Wistar大鼠48只,體質量250~280 g,由中國醫科大學實驗動物中心提供,生產許可證號SCXK(遼)2008-0005。隨機分為假手術(sham-operation,SO)組、缺血再灌注(IR)組、低劑量米諾環素后處理(IR+LM)組、高劑量米諾環素后處理(IR+ HM)組,每組各12只。(1)SO組:冠狀動脈左前降支只穿線,不結扎,穿線后35 min由股靜脈緩慢注入生理鹽水(1 mL/100 g);(2)IR組:結扎冠狀動脈左前降支45 min,再灌注120 min,再灌注前10 min由股靜脈緩慢注入生理鹽水(1 mL/100 g);(3)IR+LM組:再灌注前10 min由股靜脈緩慢注入鹽酸米諾環素(3 mg/kg,0.3 mg/mL生理鹽水,1 mL米諾環素溶液/100 g);(4)IR+HM組:再灌注前10 min由股靜脈注入鹽酸米諾環素(10 mg/kg,1 mg/mL生理鹽水,1 mL米諾環素溶液/100 g)。
1.2 試劑及儀器
鹽酸米諾環素(美國sigma公司),大鼠心肌肌鈣蛋白Ⅰ(cardiac troponin-Ⅰ,cTn-Ⅰ)酶聯免疫檢測試劑盒(北京尚柏生物醫學技術有限公司),肌酸激酶MB型(creatine kinase MB,CK-MB)、丙二醛(malondialdehyde,MDA)、超氧化物歧化(superoxide dismutase,SOD)試劑盒(南京建成生物工程研究所),TUNEL試劑盒(南京凱基生物科技發展有限公司)。小動物呼吸機(HX-300,成都泰盟科技有限公司),八導生理記錄儀(日本RM6000),石蠟切片機(德國LEICA公司),光學顯微鏡(日本OLYMPUS公司),酶標儀(MpltiskanMK3芬蘭Thermo Lab System),全自動生化分析儀(Cobase501德國Roehe)。
1.3 指標與方法
1.3.1 血流動力學指標測定:再灌注120 min經右側頸總動脈插管至左心室,連接至八導生理記錄儀,記錄心率(heart rate,HR)、左心室收縮壓(left ventricular systolic pressure,LVSP)、左心室舒張末期壓(left ventricular end diastolic pressure,LVEDP)、左心室變化速率最大值(±dp/dtmax)。
1.3.2 血清CK-MB和cTn-Ⅰ含量測定:再灌注120 min后收集右頸總動脈血4 mL,4℃下3 000 r/min,離心10 min,分離出血清,分別用全自動生化分析儀和ELISA法測血清CK-MB活性和cTn-Ⅰ含量。具體操作按試劑盒說明書進行。
1.3.3 心肌組織病理形態學的測定:再灌注結束,迅速留取左心室前壁心肌組織,于4%的多聚甲醛固定12 h,石蠟包埋,HE染色觀察再灌注心肌組織的病理變化。
1.3.4 心肌凋亡細胞原位測定:應用TUNEL凋亡測試試劑盒嚴格按照試劑盒說明書操作。光鏡下正常心肌細胞核呈藍色,棕色為TUNEL染色陽性細胞,每張切片隨機選取l0個視野(×400倍),計數凋亡陽性細胞,以凋亡細胞個數/所有細胞個數作為凋亡指數(apoptotic index,AI),AI反映各組心肌細胞凋亡的情況。
1.3.5 血清、心肌組織MDA含量及SOD活性測定:再灌注120 min頸動脈取血2 mL,靜置后3 000 r/min,離心10 min分離出血清;取大鼠左心室結扎線以下心尖部缺血區心肌組織,每20 mg組織加入150 μL裂解液,與生理鹽水混合后研磨勻漿,4℃15 000 g離心5 min,取上清液;硫代巴比妥酸法測定MDA含量,黃嘌呤氧化酶法測定超氧化物歧化酶SOD活性,根據說明書檢測。
1.4 統計學分析
采用SPSS17.0統計軟件進行分析,計量資料多組間比較采用單因素方差分析,多組間兩兩比較采用SNK法。P<0.05認為差異有統計學意義。
2 結果
2.1 米諾環素后處理對大鼠心臟血流動力學影響
與SO組比較,IR組HR、LVSP、±dp/dtmax指標均降低(P均<0.01),LVEDP升高(P<0.01);與IR組比較,IR+LM、IR+HM組顯著升高LVSP和±dp/dtmax(P<0.05或P<0.01),降低LVEDP(P<0.05)。IR+HM組與IR+LM組比較有進一步改善趨勢,但差異無統計學意義(P>0.05)。見表1。
2.2 米諾環素后處理對大鼠心肌組織病理形態學的影響
光鏡下觀察,SO組心肌細胞排列整齊,著色均勻,肌纖維橫紋清晰,無細胞腫脹,未見變性壞死和炎性細胞浸潤(圖1A);IR組心肌肌纖維排列紊亂,著色不均勻,細胞腫脹明顯,心肌細胞間隙水腫嚴重,肌纖維部分斷裂,橫紋模糊或消失,可見心肌細胞呈片狀壞死,壞死區細胞核碎裂或崩解,周圍有炎性細胞浸潤,紅細胞漏出明顯(圖1B);IR+LM組和IR+HM組心肌細胞排列基本規整,部分心肌細胞水腫變性,肌纖維間隙水腫,偶爾可見散在的紅細胞,但明顯少于IR組,少見炎性細胞浸潤;與IR組比較心肌組織結構明顯改善(圖1C、1D)。
表1 米諾環素后處理對大鼠心臟血流動力學的影響()Tab.1 Effects of minocycline postconditioning on the cardiac parameters of haemodynamics in rats()
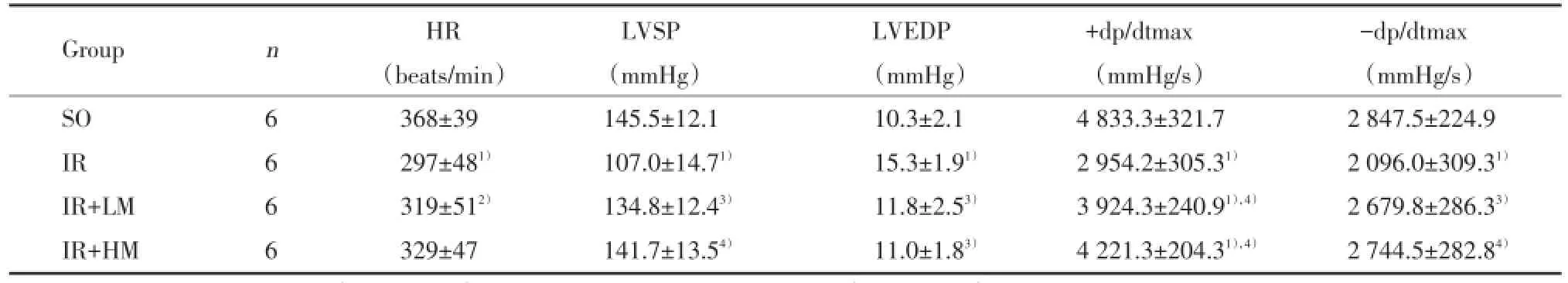
表1 米諾環素后處理對大鼠心臟血流動力學的影響()Tab.1 Effects of minocycline postconditioning on the cardiac parameters of haemodynamics in rats()
Compared with SO group,1)P<0.01,2)P<0.05;compared with I/R group,3)P<0.05,4)P<0.01.
Group n HR LVSP LVEDP +dp/dtmax -dp/dtmax(beats/min) (mmHg) (mmHg) (mmHg/s) (mmHg/s)SO 6 368±39 145.5±12.1 10.3±2.1 4 833.3±321.7 2 847.5±224.9 IR 6 297±481) 107.0±14.71) 15.3±1.91) 2 954.2±305.31) 2 096.0±309.31)IR+LM 6 319±512) 134.8±12.43) 11.8±2.53) 3 924.3±240.91),4) 2 679.8±286.33)IR+HM 6 329±47 141.7±13.54) 11.0±1.83) 4 221.3±204.31),4) 2 744.5±282.84)
2.3 米諾環素后處理對大鼠血清cTn-Ⅰ、CK-MB的影響
與SO組比較,IR組血清cTn-Ⅰ水平、CK-MB活性顯著升高(P<0.01);與IR組比較,IR+LM組和IR+HM組能顯著降低血清cTn-Ⅰ水平和CKMB活性(P<0.01)。IR+HM組與IR+LM組比較差異無統計學意義(P>0.05)。見表2。
2.4 米諾環素后處理對大鼠心肌細胞凋亡的影響
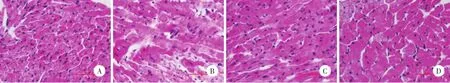
Fig.1 米諾環素后處理對大鼠心肌組織病理形態學的影響 HE染色×400Fig.1 Effects of minocycline postconditioning on the myocardial tissue morphology in rats HE dyeing×400
表2 米諾環素后處理對大鼠血清cTn-Ⅰ、CK-MB及AI的影響()Tab.2 Effects of minocycline postconditioning on the cTn-Ⅰ,CK-MB in serum and AI in rats()
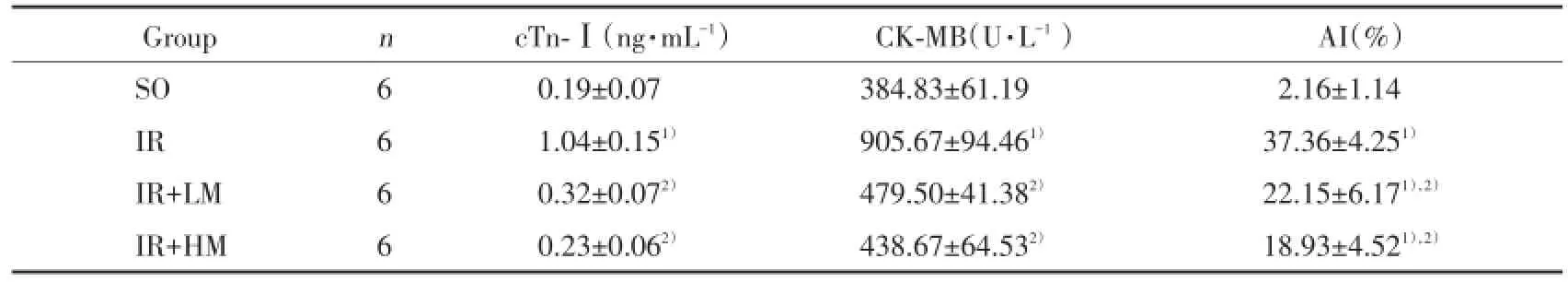
表2 米諾環素后處理對大鼠血清cTn-Ⅰ、CK-MB及AI的影響()Tab.2 Effects of minocycline postconditioning on the cTn-Ⅰ,CK-MB in serum and AI in rats()
Compared with SO group,1)P<0.01;compared with I/R group,2)P<0.01.
Group n cTn-Ⅰ(ng·mL-1) CK-MB(U·L-1) AI(%)SO 6 0.19±0.07 384.83±61.19 2.16±1.14 IR 6 1.04±0.151) 905.67±94.461) 37.36±4.251)IR+LM 6 0.32±0.072) 479.50±41.382) 22.15±6.171),2)IR+HM 6 0.23±0.062) 438.67±64.532) 18.93±4.521),2)
TUNNEL染色后正常細胞核染藍色,凋亡細胞核呈棕色。如圖2所示,SO組大鼠心肌中極少量TUNEL染色陽性細胞,與SO組比較,IR組大鼠染色陽性細胞明顯增多,AI明顯增高(P<0.01),與IR組比較,IR+LM組和IR+HM組染色陽性細胞明顯減少,AI明顯降低(P<0.01)。IR+HM組與IR+LM組比較差異無統計學意義(P>0.05)。見表2。
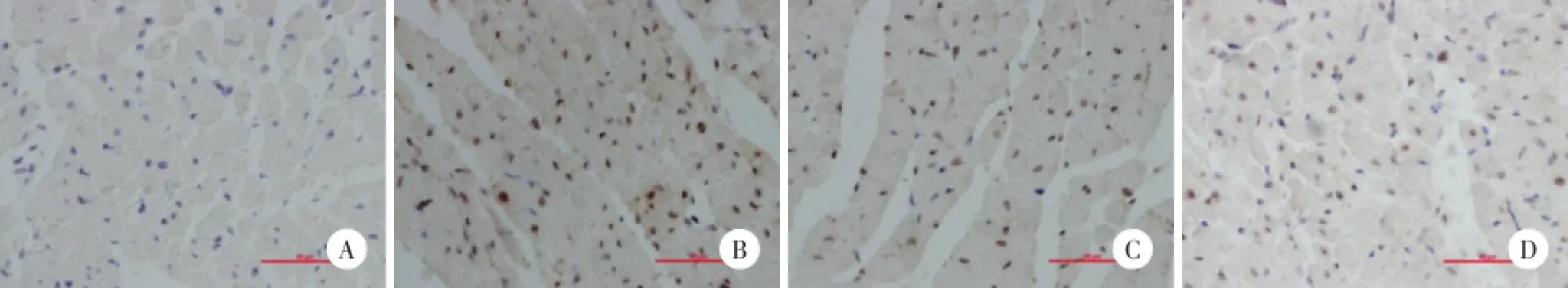
圖2 米諾環素后處理對大鼠心肌細胞凋亡的影響 TUNEL染色×400Fig.2 Effects of minocycline postconditioning on the myocardial apoptosis in rats TUNEL dying×400
2.5 米諾環素后處理對大鼠血清、心肌組織MDA含量和SOD活性的影響
與SO比較,IR組血清、心肌組織MDA含量均明顯增高(P<0.01),血清、心肌組織SOD活性明顯降低(P<0.01);與IR組比較,IR+LM組和IR+HM組血清、心肌組織MDA含量明顯降低(P<0.01),血清、心肌組織SOD活性明顯升高(P<0.05或P<0.01)。IR+HM組與IR+LM組比較差異無統計學意義(P>0.05)。見表3。
表3 米諾環素后處理對大鼠血清、心肌組織MDA含量和SOD活性的影響()Tab.3 Effects of minocycline postconditioning on the MDA and SOD in serum and myocardium in rats()

表3 米諾環素后處理對大鼠血清、心肌組織MDA含量和SOD活性的影響()Tab.3 Effects of minocycline postconditioning on the MDA and SOD in serum and myocardium in rats()
Compared with SO group,1)P<0.01;compared with I/R group,2)P<0.05,3)P<0.01.
Group n Serum MDA Serum SOD Myocardial MDA Myocardial SOD(nmol/mL) (U/mL) (nmol/mg pro) (U/mg pro)SO 6 1.96±0.78 117.35±12.01 2.96±0.48 198.7±17.24 IR 6 5.17±0.971) 51.36±10.631) 8.47±1.271) 97.4±8.631)IR+LM 6 2.45±0.83) 72.54±13.081),2) 6.15±1.091),3) 141.5±15.291),3)IR+HM 6 2.04±0.673) 81.67±12.201),3) 5.54±1.311),3) 167.1±13.373)
3 討論
心肌再灌注治療是限制急性缺血性心肌壞死最有效的方法,而伴隨再灌注出現的活性氧的產生、鈣超載、炎性介質釋放所介導的心肌缺血/再灌注損傷(myocardial ischemia-reperfusion injury,MIRI)削弱了再灌注治療的凈效益[4,5]。米諾環素是一種半合成的四環素衍生物,在臨床上主要用于治療關節炎及其它感染性疾病,除抗菌作用外還具有抗炎、抗凋亡、基質金屬蛋白酶抑制劑以及氧自由基清除等多效性,近年發現它對多種神經系統疾病具有顯著的神經保護作用[6,7]。動物試驗也證實了米諾環素預處理對腎臟[8]及心肌缺血再灌注損傷有保護作用。然而,在急性缺血性心肌損傷中米諾環素應用劑量(45~90 mg/kg)較高[1,2],而且多采用腹腔注射或經口途徑給藥,而研究發現腹腔注射米諾環素將導致藥物延遲吸收及腹膜激惹[9],而急性心肌保護中靜脈給藥途徑更能快速達到有效血藥濃度進而滲透心肌發揮作用。因此,本研究選擇與米諾環素臨床應用標準劑量200 mg相當的給藥劑量(3 mg/kg)[3],再灌注前10 min經靜脈注射給藥,檢測血清cTn-Ⅰ、CK-MB評價心肌組織損傷程度,cTn-Ⅰ特異性存在于心肌細胞內,是橫紋肌收縮的重要調節蛋白,在心肌細胞膜完整狀態下,cTn-Ⅰ不能透過細胞膜進入血循環,當心肌缺血缺氧,發生變性壞死、細胞膜破損時,cTn-Ⅰ因其分子量較小而彌散進入細胞間質,從而能較早釋放到外周血,對診斷心肌損傷具有高度的特異性和敏感性[10]。同時監測再灌注后心臟血流動力學參數-dp/dtmax和LVEDP評價心臟舒張功能,結果顯示,cTn-Ⅰ、CK-MB在IR組與米諾環素組均顯著高于SO組,提示缺血再灌注導致明顯的心肌損傷。MIRI使心臟舒張功能減低同時損害了心肌收縮能力,低、高劑量米諾環素后處理均明顯減少心肌壞死,同時改善了受損心肌的舒張、收縮功能,其心肌保護作用具有劑量依賴性。
凋亡是一種主動地、程序性細胞死亡,是在一定條件下,核細胞通過啟動內部機制,激活內源性DNA內切酶而發生的細胞自然死亡過程,主要表現為細胞核變化,包括:染色質斷裂、固縮、崩解、細胞質空泡變、凋亡小體形成。MIRI導致心肌細胞過度凋亡是心肌細胞死亡的重要因素,減少心肌細胞凋亡能減輕心肌損傷和改善心功能。本研究應用TUNEL法染色,結果表明SO組可見少量散在凋亡細胞,IR組凋亡細胞顯著增多,提示心肌缺血或再灌注過程有促進或加速心肌細胞凋亡的作用,而低、高劑量米諾環素后處理均能有效減少心肌細胞凋亡,米諾環素的心肌保護作用與抑制心肌細胞凋亡有關。
在MIRI過程中,大量氧自由基產生導致的氧化應激、脂質過氧化反應是造成心肌細胞損傷的重要因素之一[11]。MDA和SOD是反映自由基損傷的指標[12],MDA作為脂質過氧化的代謝產物,具有細胞毒性,其含量與體內脂質過氧化的速率和強度直接相關,在一定程度上能反映細胞損傷的程度。MDA通過促使蛋白質和DNA等生命大分子發生交聯聚合;與磷脂反應破壞生物膜結構,使膜通透性增大而引起一系列細胞損傷。SOD即為機體內抗氧化活性重要物質,能特異性清除超氧自由基,阻斷自由基產生,提高抗氧化物酶的活性,進而增強機體的抗氧化能力,SOD活性可間接反映機體清除自由基和抗氧化損傷的能力。抗氧化應激,抑制體內脂質過氧化反應,能保護缺血心肌,促進缺血再灌注心臟的心功能恢復[12]。本研究結果顯示,MIRI使血清與心肌內MDA含量明顯升高,SOD活性顯著降低,證明了氧自由基爆發在心肌再灌注的病理生理改變中起關鍵作用。而低、高劑量米諾環素后處理均能顯著維持再灌注期的SOD活性且不增加MDA的含量,提示米諾環素可改善缺血再灌注時機體的抗氧化能力,減輕心肌細胞的損傷程度。
大量證據表明,再灌注損傷是缺血后炎性反應的結果,再灌注損傷可能存在時間的依賴性,因此,缺血和再灌注的各自持續時間可以影響再灌注損傷的程度,同時也能影響藥物干預的有效性。本研究結果顯示再灌注2 h,高劑量較低劑量米諾環素組有進一步改善趨勢,但其差異無統計學意義,本研究為單次給藥,后續的研究考慮延長再灌注的時間至24 h,適當增加給藥次數,觀察高、低劑量米諾環素組的心肌保護作用是否存在差異。
本研究首次證實低劑量米諾環素后處理能減輕大鼠心肌缺血再灌注損傷,靜脈注射在大鼠急性心肌損傷模型中應用安全、可行,其心肌保護機制涉及對循環和心肌氧化應激狀態的調整,通過降低MDA含量與提升SOD的活性,減少心肌細胞的凋亡和壞死,進而改善心功能,以上結果對米諾環素的急性心肌保護的臨床應用具有指導意義。
[1]Scarabelli TM,Stephanou A,Pasini E,et al.Minocycline inhibits caspase activation and reactivation,increases the ratio of XIAP to smac/DIABLO,and reduces the mitochondrial leakage of cytochrome C and smac/DIABLO[J].Am Coll Cardiol,2004,43(5):865-874.
[2]Tao R,Kim SH,Honbo N,et al.Minocycline protects cardiac myocytes against simulated ischemia-reperfusion injury by inhibiting poly(ADP-ribose)polymerase-1[J].Cardiovasc Pharmacol,2010,56(6):659-668.
[3]Saivin S,Houin G.Clinical pharmacokinetics of doxycycline and minocycline[J].Clin Pharmacokinet,1988,15(6):355-366.
[4]Moens AL,Claeys MJ,Timmermans JP,et al.Myocardial ischemia/ reperfusion-injury,a clinical view on a complex pathophysiological process[J].Int J Cardiol,2005,100(2):179-190.
[5]鄒吉麗,尹照萍,張利群,等.大鼠心肌缺血再灌注早期心肌及血清中IL-6、TNF-α的表達[J].中國醫科大學學報,2013,42(9):830-833.
[6]Fagan SC,Cronic LE,Hess DC.Minocycline development for acute ischemic stroke[J].Transl Stroke Res,2011,2(2):202-208.
[7]Plane JM,Shen Y,Pleasure DE,et al.Prospects for minocycline neuroprotection[J].Arch Neurol,2010,67(12):1442-1448.
[8]Xia D,Shen K,Zhong W,et al.Administration of minocycline ameliorates damage in a renal ischemia/reperfusion injury model[J]. Clin Invest Med,2011,34(2):E55-63.
[9]Fagan SC,Edwards DJ,Borlongan CV,et al.Optimal delivery of minocycline to the brain:implication for human studies of acute neuroprotection[J].Exp Neurol,2004,186(2):248-251.
[10]Apple FS.Tissue specificity of cardiac troponin I,cardiac troponin T and creatine kinase MB[J].Clin Chim Acta,1999,284(2):151-158.
[11]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].N Engl J Med,2007,357(11):1121-1135.
[12]趙潤英,郝偉,孟祥軍,等.阿魏酸川芎嗪后處理對大鼠心肌缺血再灌注損傷的影響[J].中國醫科大學學報,2012,41(11):1081-1021.
(編輯 武玉欣)
Protective Effectof Intravenous Infusion ofLow Dose Minocycline Postconditioning on Myocardial Ischemia-reperfusion Injury in Rat
ZHANGLi-qun1,CHENYong-jun2,CUIRen-shan1,QIGuo-xian3
(1.Department of Humanity,School of Nursing of Shenyang Medical College,Shenyang 110034,China;2.Department of Clinical Lab,Shenzhou Hospital,Shenyang MedicalCollege,Shenyang 110002,China;3.DepartmentofCardiology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
Objective To evaluate the effects of low dose intravenous minocycline postconditioning on myocardial ischemia-reperfusion injury in rat,and to investigate the possible mechanisms.MethodsForty-eight male Wistar rats were randomly divided into four groups:sham-operation(SO)group,ischemia-reperfusion(IR)group,low-dose minocycline(3 mg/kg,LM)group and high-dose minocycline(10 mg/kg,HM)group. The rat model of myocardial IR was established by occlusion of the left anterior descending coronary artery for 45 minutes and reperfusion for 120 minutes.Afterthe reperfusion,the parameters ofhaemodynamicswere recorded;creatine kinase MB(CK-MB),cardiac troponin-I(cTn-I),malondialdehyde(MDA),superoxide dismutase(SOD)in serum and myocardium,myocardial apoptosis index(AI)and the myocardial tissue morphology were determined.ResultsCompared with IR group,LM and HM treatment significantly reduced the levels of CK-MB form,cTn-I,AI and MDA,lowered LVEDP,enhanced LVSP and±dp/dtmax,elevated the activity of SOD in serum and myocardium(P<0.05).The effect of HM is stronger than LM on these above mentioned indicators,but the difference was not statistical significance(P>0.05).ConclusionLM postconditioning can protect against myocardial IR injury,and the protective effect may be related to the scavenging of oxide free radical,which further restrain the reaction oflipid peroxidation and apoptosis.
minocycline;ischemia postconditioning;myocardial ischemia-reperfusion injury
R541.4
A
0258-4646(2015)08-0685-05
遼寧省教育廳科學研究一般項目(L2013399);沈陽醫學院博士科研啟動基金(20133050)
張利群(1970-),女,副教授,博士. E-mail:sunflowerzlq@163.com
2015-01-16
網絡出版時間:

