miR-155抑制HepG2.2.15細胞中乙型肝炎病毒復制與表達的研究
蔡啟茵,任廣立,張衛云,馬恒灝
(1.廣州軍區廣州總醫院,廣東 廣州 510010;2.廣州中醫藥大學,廣東 廣州 510405)
miR-155抑制HepG2.2.15細胞中乙型肝炎病毒復制與表達的研究
蔡啟茵1,2,任廣立1,張衛云1,馬恒灝1
(1.廣州軍區廣州總醫院,廣東 廣州 510010;2.廣州中醫藥大學,廣東 廣州 510405)

目的研究人miR-155對HepG2.2.15細胞中乙型肝炎病毒(HBV)的抑制作用,為miRNAs治療乙型肝炎提供理論依據。方法以HepG2.2.15細胞基因組為模板,PCR擴增人miR-155前體序列,雙酶切連接到pmR-mCherry質粒,構建pmiR-155真核過表達載體,并轉染到HepG2.2.15細胞。設重組組(pmiR-155質粒)、空載組(pmR-mCherry質粒)、轉染試劑組和空白組。轉染后24h、48h、72h,應用實時熒光定量PCR法檢測各組miR-155表達量和HBV DNA拷貝數,化學發光法定量檢測HBsAg和HBeAg變化情況。結果實時熒光定量PCR結果顯示,與空白組相比,重組組miR-155表達量明顯提高。化學發光法結果示在轉染后48h,過表達的miR-155對上清培養液所分泌HBsAg、HBeAg抑制作用明顯,抑制率分別為(83.96±1.52)%和(79.60±8.71)%。定量PCR檢測示過表達的miR-155對HBV DNA拷貝數的抑制率分別為(51.87±0.36) %、(43.67±1.51) %和(68.21±6.02)%。結論miR-155對HBV蛋白的抑制作用具特異性,呈負相關,在體外可抑制HepG2.2.15細胞中HBV的復制和表達。
乙型肝炎病毒;miR-155;HepG2.2.15細胞
乙型肝炎病毒(HBV)是引起病毒性肝炎的重要病原體之一。全球約4億人感染慢性HBV,可繼發為肝纖維化、肝硬化,甚至肝細胞癌,嚴重危及全球人類健康[1]。近年來藥物治療主要為干擾素和核苷類似物,在一定程度上可抑制病毒復制,減輕肝損傷程度,但無法徹底清除體內病毒[2]。microRNA-155(miR-155)是長度約為65bp的小分子RNA,表達于T細胞、B細胞、單核細胞及巨噬細胞等多種細胞,參與調控炎癥、抗病毒感染、免疫系統發育和應答[3-5]。Su等[6]研究表明miR-155異位表達可促進JAK/STAT(Janus kinases-signal transducers and activators of transcription)信號通路,增強抗病毒感染能力,降低乙型肝炎病毒X蛋白(Hepatitis X protein, HBx)的表達,從而達到干擾HBV復制效果。本研究通過構建miR-155真核過表達載體,并在體外轉染HepG2.2.15細胞,旨在從蛋白和基因水平評估miR-155對HBV的抑制效應。
1 實驗資料
1.1主要試劑和儀器 Lipofectamine2000、TRIzol總RNA提取試劑盒(美國Invitrogen公司),去內毒素質粒提取試劑盒(美國Omega公司),乙型肝炎病毒表面抗原和e抗原定量測定試劑盒(美國Abott公司),HBV DNA定量檢測試劑盒(上海科華生物工程股份有限公司)。熒光倒置顯微鏡(日本Olympus公司),實時定量PCR儀(美國QIAGEN公司),凝膠成像分析系統、高速低溫離心機(美國BioRad公司),Architect i system(美國Abbott公司)。
1.2載體構建 根據miRBase及GenBank數據庫查找到成熟miR-155序列、pre-miR-155序列及側翼序列,設計pre-miR-155正向引物:5’-tcgaGAATTCAGGTGGCACAAAC CAGGAA-3’,反向引物:5’-tcgaGGATCCGTTGAACATC CCAGTGACCAG -3’。以HepG2.2.15細胞基因組為模板PCR擴增pre-miR-155序列,經 EcoRⅠ和BamHⅠ雙酶切后,片段連入pmiR-mCherry載體EcoRⅠ和BamHⅠ位點間,構建pmiR-155。經克隆轉化、搖菌、雙酶切及測序鑒定后,去內毒素提取重組質粒用于轉染實驗[7]。
1.3轉染HepG2.2.15細胞 HepG2.2.15細胞培養于含200mg/L的G418、100g/L FBS的高糖DMEM培養液中, 同時含有100000IU/L 青鏈霉素(轉染時不加雙抗)和10g/L的L-谷氨酰胺,在37℃,5% CO2培養箱中培養。 細胞傳代培養3次后消化接種到6孔板內, 細胞密度為4.8×105/孔,培養24h后待細胞匯合度達底面積的80%左右準備轉染。設重組組(pmiR-155質粒)、空載組(pmR-mCherry質粒)、轉染試劑組、空白組,轉染試劑Lipofectamine 2000( μL)與質粒( μg)的比例為3∶1。
1.4實時熒光定量PCR法檢測各組miR-155表達 應用TRIzol法提取各組細胞中總RNA,經紫外分光計測定濃度及純度后,采用莖環法[8]逆轉錄得到cDNA后進行實時熒光定量PCR反應。miR-155及U6引物均為廣州銳博生物科技有限公司的特異性引物,反應程序為95℃變性10s, 60℃退火20s,70℃延伸10s,循環40次。所得數據采用2-△△Ct公示校正后用于評估樣本間的差異。
1.5HBV的抑制效應
1.5.1化學發光法定量檢測HBsAg和HBeAg變化 收集細胞轉染后24h、48h和72h的培養上清液,嚴格按乙型肝炎病毒表面抗原和e抗原定量測定試劑盒說明操作,在Architect system上檢測,結束后系統計算出HBsAg及HBeAg表達量。計算抗原抑制率。公式:抑制率(%)=(1-測試組抗原分泌量/空白組抗原分泌量)×100%。
1.5.2DNA檢測 收集細胞轉染后24h、48h和72h的培養上清液,應用Rotor-Gene Q進行實時熒光定量PCR檢測,反應程序為94℃預變性2min,94℃變性10s,60℃退火30s,循環40次。反應結束后由RG6000軟件分析計算出HBV DNA的拷貝數。
1.6統計學方法應用SPSS 17.0統計軟件進行統計分析,所有數據以均數±標準差表示,組間均數比較采用One-Way ANOVA檢測,2組間比較采用LSD檢驗,雙變量采用Person相關性分析,P<0.05為差異有統計學意義。
2 結 果
2.1各組miR-155表達情況 以空白組細胞內表達的miR-155量為基準,重組組miR-155表達量(22.35±1.27)明顯高于空載組(5.71±1.85)及轉染組(5.35±0.79)(P均<0.05)。
2.2各組HBsAg和HBeAg變化情況 轉染后重組組培養上清液的HBsAg、HBeAg表達水平明顯受到抑制,其中轉染后48h對HBsAg、HBeAg抑制最為明顯,分別為(83.96±1.52)%和(79.60±8.71)%,而其他組培養上清液中所分泌的HBsAg、HBeAg均未見明顯變化。見表1及表2。同時發現,miR-155對HBV蛋白的抑制作用具特異性,呈顯著負相關(r<0)。見表3。
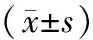
表1 各個時間段不同組細胞HBsAg分泌情況比較
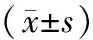
表2 各個時間段不同組細胞HBeAg分泌情況比較

表3 miR-155與HBsAg、HBeAg的相關性
2.3各組HBV DNA變化情況 轉染后24h、48h和72h,重組組上清液HBV DNA表達明顯受到抑制,與空載組、轉染試劑組及空白組比較差異均有統計學意義(P均<0.05)。3組HBV DNA表達情況見圖1,HBV DNA抑制情況見圖2。

圖1 各組轉染后不同時間HBV DNA拷貝數比較

圖2 各組轉染后不同時間HBV DNA抑制情況比較
3 討 論
HBV感染呈世界流行,全球有20億人感染過HBV,其中每年約100萬人死于HBV相關的肝衰竭或原發性肝癌,目前尚無特效藥物清除體內的HBV復制。HBV感染者易出現免疫耐受狀態,其機制可能為樹突狀細胞抗原提呈能力低下,T淋巴細胞免疫活化受限和肝靶細胞的應答能力下降等[9]。
miRNA通過降解靶細胞mRNAs或抑制蛋白翻譯來調控轉錄后期的基因表達。miR-155被認為是新興的炎癥遞質,具有抗感染、抗腫瘤和免疫調節等重要作用,在調節先天免疫和適應性免疫及維持系統穩定方面發揮著重要作用[10-11]。Rodriguez等[12]在敲除miR-155的轉基因小鼠動物模型中證明了miR-155的缺失使DC的抗原提呈能力和共刺激能力下降, T細胞傾向分化成Th2細胞,且miR-155作用于白細胞介素-2(IL-2)信號途徑抑制分子SOCS1的表達,從而調節T調節細胞的分化能力。IL-2、干擾素-γ(IFN-γ)是由Th1細胞分泌的細胞因子,可以加強細胞免疫反應,有利于清除病毒。由此可看出,miR-155參與T細胞分化及信號通路的改變,在抗病毒感染中扮演著重要角色。
本實驗通過構建人miR-155真核過表達載體,并成功轉染到HepG2.2.15細胞,經觀察發現miR-155的表達量與細胞HBsAg、HBeAg的分泌水平呈負相關性,即當miR-155呈過表達狀態時,HBsAg和HBeAg分泌量則相應下降,且HBV DNA的拷貝數明顯受到抑制,這充分證明miR-155過表達狀態下,可以顯著抑制HBV蛋白和基因的表達水平,從而降低HBV的表達。而miR-155干擾HBV表達的作用機制,結合上述前人的研究成果,筆者推測極有可能與某些細胞因子信號通路有關,這將是本實驗組下一步研究方向。
本次實驗成功構建了人miR-155真核過表達載體并轉染到HepG2.2.15細胞,為更好地在體外水平上進一步研究miR-155對HBV復制和免疫狀態的影響提供了實驗基礎,為miRNAs治療HBV感染提供了理論依據。今后將在此研究基礎上,針對miR-155對HBV的復制表達抑制機制進行深入研究。
[1] Hadziyannis SJ,Vassilopoulos D,Hadziyannis E.The natural course of chronic hepatitis B virus infection and its management[J].Adv Pharmacol,2013,67:247-291
[2] Mastroianni CM,Lichtner M,Citton R,et al.Current trendsin management of hepatitis B virus reactivation in the biologic therapy era[J].World J Gastroenterol,2011,17(34):3881-3887
[3] Ruan K,Fang X,Ouyang G.MicroRNAs:novel regulators in the hallmarks of human cancer[J].Cancer Letters,2009,285:116-126
[4] Hu YL,Fong S,Largman C,et al.HOXA9regulates miR-155in hematopoietic cells[J].Nuc Aci Rese,2010,38:5472-5478
[5] Singh RP,Massachi I,Manickavel S,et al.The role of miRNA in inflammation and autoimmunity[J].Autoimmu Rev,2013,12:1160-1165
[6] Su C,Hou Z,Zhang C,et al.Ectopic expression of microRNA-155enhances innate antiviral immunity against HBV infection in human hepatoma cells[J].Virol J,2011,8:354
[7] 蔡啟茵,任廣立,張衛云,等.人miR-155真核過表達載體的構建及其對HepG2.2.15細胞中HBeA的抑制效應[J].世界華人消化雜志,2014,22(28):4217-4222
[8] Chen C,Ridon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nuc Ac Res,2005,33(20):e179
[9] Wu S,Kanda T,Imazeki F,et al.Hepatitis B virus e antigen downregulates cytokine production in human hepatoma cell lines[J].Viral Immunology,2010,23(5):467-476
[10] 張波,田野蘋.microRNA-155的免疫調控作用[J].現代免疫學,2012,32(1):80-83
[11] Vigorito E,Kohlhaas S,Lu D.MiR-155: an ancient regulator of the immune system[J].Immunol Rev,2013,253:146-157
[12] Rodriguez A,Vigorito E,Clare S,et al.Requirement of bic/microRNA-155for normal immune function[J].Science,2007,316:608-611
Depressant effect of micro RNA-155on the expression and replication of Hepatitis B virus in HepG2.2.15cell
CAI Qiyin1,2, REN Guangli1, ZHANG Weiyun1, MA Henghao1
(1.General Hospital of Guangzhou Military Command, Guangzhou 510010, Guangdong, China; 2.Guangzhou University of Chinese Medicine, Guangzhou 510405, Guangdong, China)
Objective It is to investigate the depressant effect of microRNA-155(miR-155) on Hepatits B virus in HepG2.2.15cell, and provide a theoretical basis for the treatment of hepatitis B.Methods The pre-miR-155was amplified from total DNA of HepG2.2.14by PCR.The target gene fragment was digested and cloned into the pmR-mCherry plasmid.The pmiR-155was transfected into HepG2.2.15cells by liposome-mediated method.The empty plasmid, the reagent group and untreated cells were set as control.The expression of miR-155was detected by the real-time quantitive PCR.The expression of HBsAg and HBeAg were detected by chemiluminescent assay, and the changes of HBV DNA were investigated by real-time quantitive PCR.Results MiR-155level of HepG2.2.15cells which were transfected with the recombinant plasmid was obviously higher than controls.The chemiluminescent assay showed that over-expression of miR-155could inhibit the expression of HBsAg and HBeAg with (69.43±0.7) %, (45.89±0.74) % respectively on the 2nd day post-transfection.The HBV DNA was markedly suppressed with (51.87±3.74) %, (43.67±0.687) % and (68.21±0.47) % by real-time quantitive PCR.Conclusion The inhibition effect of HBV protein was specific and had a certain dependency on the expression of miR-155.MiR-155can suppress the replication and expression of HBV in vitro.
hepatitis B virus; microRNA-155; HepG2.2.15cell
蔡啟茵,女,碩士研究生,研究方向為兒科病毒感染性疾病。
任廣立,E-mail:guangliren@hotmail.com
廣州市科技計劃項目(2013J4100116)
10.3969/j.issn.1008-8849.2015.18.003
R-33
A
1008-8849(2015)18-1945-03
2015-02-12

