姜黃素對成骨細胞凋亡的影響
王雪梅,尚德浩
(1.中國醫科大學口腔醫學院牙體牙髓科,中國醫科大學口腔醫學院中心實驗室,遼寧省口腔醫學研究所牙體牙髓病學研究室;2.中國醫科大學口腔醫學院種植中心,沈陽 110002)
姜黃素對成骨細胞凋亡的影響
王雪梅1,尚德浩2
(1.中國醫科大學口腔醫學院牙體牙髓科,中國醫科大學口腔醫學院中心實驗室,遼寧省口腔醫學研究所牙體牙髓病學研究室;2.中國醫科大學口腔醫學院種植中心,沈陽 110002)
目的研究姜黃素對腫瘤壞死因子α(TNF-α)處理成骨細胞引起凋亡的影響。方法將原代培養的大鼠成骨細胞分為3組:對照組(不做處理)、TNF-α處理組(10 ng/mL TNF-α處理24 h)、姜黃素預處理組(10 μmol/L姜黃素預處理2 h,10 ng/mL TNF-α處理24 h),通過Western blot方法檢測Fas、TRAIL、caspase-2、caspase-3、caspase-8及Bcl-2的蛋白水平,熒光顯微鏡下觀察并計數成骨細胞的凋亡情況。結果與對照組相比,12和24 h時TNF-α處理組caspase-2、caspase-3、caspase-8、Fas、TRAIL的蛋白水平均升高(P<0.01),Bcl-2的蛋白水平無明顯變化(P>0.05);12和24 h時姜黃素預處理組caspase-2、caspase-3、caspase-8、Fas、TRAIL的蛋白水平均較TNF-α處理組明顯降低(P<0.01)。20倍熒光顯微鏡下觀察可見,對照組凋亡的成骨細胞數目非常少,TNF-α處理組凋亡的成骨細胞數目明顯增多,姜黃素預處理組凋亡的成骨細胞數目明顯減少。結論姜黃素可以抑制TNF-α引起的成骨細胞凋亡。
腫瘤壞死因子α;成骨細胞;凋亡
與其他組織細胞相同,骨組織中的細胞凋亡是骨代謝的一種形式,成骨細胞參與了骨改建的過程。由于成骨細胞凋亡可減少成骨細胞數目,進而可以引發骨重建[1,2]。姜黃素是從一些植物根莖中提取的化學成分,可作為食品著色劑,具有抗炎、抗腫瘤、降血脂、抗氧化等作用。近年來研究發現姜黃素對不同種類細胞所起的凋亡作用不同,對許多腫瘤細胞具有促進凋亡的作用[3~6],而對白細胞介素1引起的關節軟骨細胞凋亡具有抑制作用[7]。研究發現,腫瘤壞死因子α(tumor necrosis factor α,TNF-α)通過腫瘤壞死因子受體1、腫瘤壞死因子受體2和死亡受體如Fas的相互作用,激活半胱氨酸蛋白酶(caspase)誘導成骨細胞凋亡[8,9]。本研究通過在成骨細胞中加入TNF-α,模擬根尖周炎或牙周炎時骨質所處的微環境,建立骨細胞的凋亡模型,通過Western blot方法檢測加入姜黃素后凋亡相關蛋白水平的變化,探討姜黃素對成骨細胞凋亡的影響,為牙周炎及根尖周炎的臨床藥物治療提供理論依據。
1 材料與方法
1.1 實驗動物
新生24 h內的SD胎鼠,雌雄不限,體質量約6 g,由中國醫科大學實驗動物部提供。
1.2 主要材料與試劑
兔抗鼠Bcl-2抗體,兔抗鼠活性caspase-2、caspase-3、caspase-8抗體,兔抗鼠Fas抗體,兔抗鼠TRAIL抗體,購自美國Santa Cruz公司;姜黃素,購自美國Sigma公司;TNF-α,購自華美公司。
1.3 原代培養成骨細胞
進行成骨細胞培養,以1∶2進行傳代,每隔2 d換液1次,5~7 d進行傳代[10]。
1.4 Western blot實驗
取第3~4代的成骨細胞以5×106/mL密度接種于6孔板,分為3組:對照組(不做處理);TNF-α處理組(10 ng/mL TNF-α處理24 h);姜黃素預處理組(10 μmol/L姜黃素預處理2 h,10 ng/mL TNF-α處理24 h)。分別在TNF-α處理成骨細胞12 h和24 h時收集細胞,細胞中加入蛋白裂解緩沖液,20 min后轉移至EP管。每孔進行加樣,轉膜后在室溫下將兔抗鼠Bcl-2抗體、兔抗鼠caspase-2、caspase-3、caspase-8抗體、兔抗鼠Fas抗體、兔抗鼠TRAIL抗體、稀釋于封閉液中,與膜孵育4℃過夜。在室溫下將辣根過氧化物酶標記的二抗稀釋于封閉液中,與膜孵育60 min,加入顯色液避光至條帶出現。
1.5 應用TUNEL法原位觀察成骨細胞凋亡
將無菌的蓋玻片置于6孔板中,每孔1片。取對數生長期細胞以0.05%胰酶消化后,稀釋成5×107/L,取0.5 mL滴于蓋玻片上,37℃孵育2 h后,每孔加2 mL培養基,4%多聚甲醛固定細胞60 min,加配制好的生物素標記液,37℃孵育60 min,在樣品上加50 μL過氧化物酶-鏈親和素復合物工作液,室溫孵育30 min,加入FITC標記的二抗,封片后熒光顯微鏡下觀察。
1.6 統計學分析
2 結果
2.1 Fas、TRAIL、caspase-2、caspase-3、caspase-8及Bcl-2的蛋白水平
Western blot檢測發現,對照組成骨細胞基礎表達Fas、TRAIL、caspase-2、caspase-3、caspase-8以及Bcl-2,TNF-α處理組在12和24 h時caspase-2、caspase-3、caspase-8c、Fas、TRAIL的蛋白水平均較對照組明顯升高(P<0.01),Bcl-2的蛋白水平無明顯變化(P>0.05)。姜黃素預處理組在12和24 h時caspase-2、caspase-3、caspase-8、Fas、TRAIL的蛋白水平都較TNF-α處理組明顯降低(P<0.01或0.05),Bcl-2的蛋白水平無明顯變化(P>0.05)。見圖1,表1。
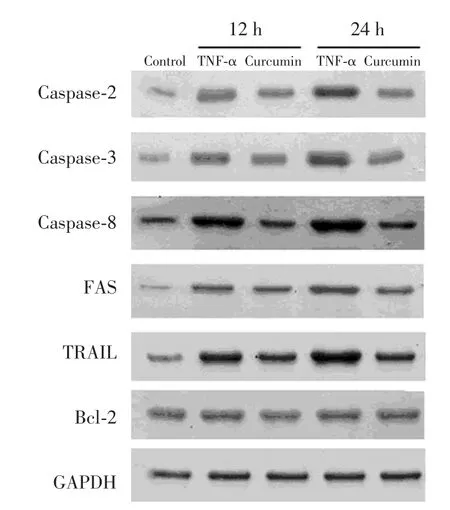
圖1 Western blot檢測caspase-2、caspase-3、caspase-8、Fas、TRAIL和Bcl-2蛋白的表達Fig.1 Western blot analysis for caspase-2,caspase-3,caspase-8,Fas,TRAIL,and Bcl-2
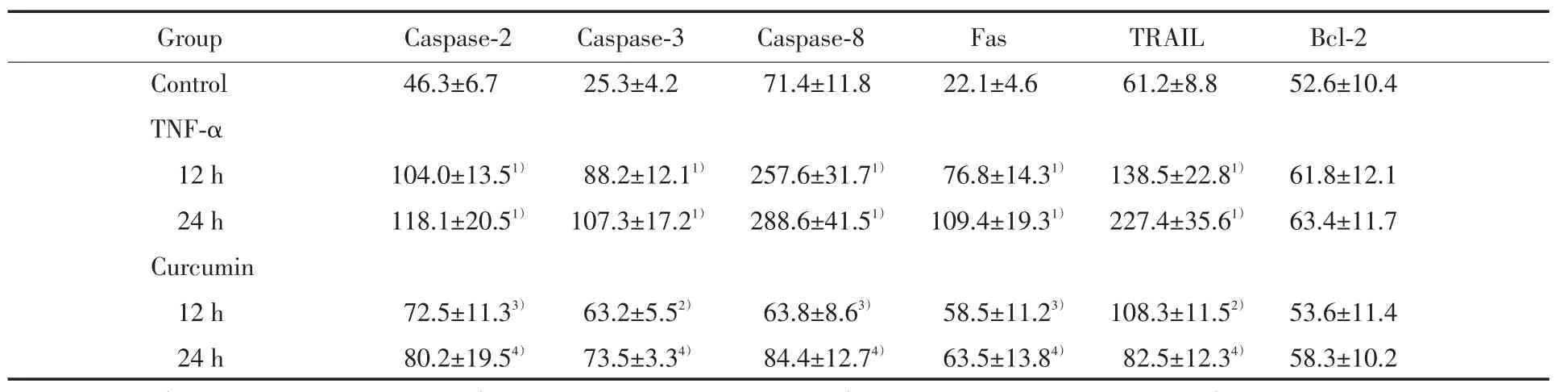
表1 Western blot檢測caspase-2、caspase-3、caspase-8、Fas、TRAIL和Bcl-2的表達水平Tab.1 Expressions of caspase-2,caspase-3,caspase-8,Fas,TRAIL,and Bcl-2 detected by Western blot
2.2 TUNEL法觀察凋亡的成骨細胞
凋亡的成骨細胞標志為核染色質濃縮或形成各種形狀的碎塊。20倍熒光顯微鏡下觀察可見:在無任何刺激存在的對照組凋亡的成骨細胞數目非常少(圖2A),TNF-α處理組凋亡的成骨細胞數目明顯增多(圖2B),姜黃素預處理組凋亡的成骨細胞數目較TNF-α處理組明顯減少(圖2C)。
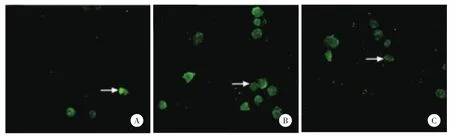
圖2 TUNEL法觀察凋亡的成骨細胞 ×20Fig.2 Apoptosis of osteoblasts detected by TUNEL×20
3 討論
成骨細胞是參與根尖周骨質改建的主要細胞之一,成骨細胞最終有3種轉歸:一部分被埋于其自身分泌的骨基質中轉換為骨細胞;一部分轉變為靜止的骨襯細胞;其余的則以凋亡的形式死亡[11,12],成骨細胞的凋亡在骨重建中發揮重要作用[13,14]。研究證明,TNF-α可以引起成骨細胞凋亡[15~17]。本研究通過在成骨細胞中加入TNF-α,模擬根尖周炎或牙周炎時骨質所處的微環境,建立骨細胞凋亡模型。TNF-α引起成骨細胞凋亡的機制包括:(1)TNF-α受體死亡結構域需要通過Fas相關受體死亡結構域來激活caspase的級聯反應;(2)TNF-α增強Fas配體或放線菌酮引起的凋亡刺激。Fas通過競爭抗體或者其成熟配體可以導致受體低聚反應,以及銜接蛋白和caspase-8前體的募集反應,進而形成誘導死亡的信號復合物,然后caspase-8前體被蛋白水解激活并分解為多種底物,包括caspase-3前體,從而完成凋亡過程。
由于TNF-α引起的成骨細胞凋亡與Fas、caspase-2、caspase-3、caspase-8等有關,所以本研究通過Western blot方法檢測加入10 ng/mL TNF-α培養24 h時caspase-2、caspase-3、caspase-8、Fas、TRAIL的蛋白水平變化,結果發現蛋白水平均升高,Bcl-2作為抑制凋亡的蛋白表達無明顯變化。姜黃素預處理組caspase-2、caspase-3、caspase-8和Fas、TRAIL的蛋白水平均較TNF-α處理組明顯降低,此結果提示caspase-2、caspase-3、caspase-8、Fas、TRAIL凋亡相關蛋白參與了TNF-α誘導的成骨細胞凋亡,而姜黃素可以抑制TNF-α誘導的成骨細胞凋亡。Bcl-2與TNF-α誘導的成骨細胞凋亡無關,caspases-2和caspase-8由于含有較長的氨基端前結構域,作為啟動子發揮作用,而caspases-3由于含有較短的氨基端前結構域,作為執行子發揮作用,普遍認為caspase-3是細胞凋亡蛋白酶級聯反應的必經之路。因此TNF-α通過激活Fas、TRAIL、caspase-2、caspase-8進而啟動caspase-3降解caspase的底物分子,發生不可逆轉的凋亡。姜黃素通過抑制這些凋亡活化蛋白進而抑制了成骨細胞的凋亡。TUNNL結果顯示,TNF-α處理成骨細胞24 h時凋亡的成骨細胞數目明顯增多,而姜黃素預處理組凋亡的成骨細胞數目與TNF-α處理組相比明顯減少(P<0.01),與Western blot結果一致。
正常的根尖周組織和牙周組織處于一種平衡狀態,這種平衡狀態受機體內環境包括細胞因子網絡系統制約。當細菌感染時,牙周袋或根管內細菌的毒素及其代謝產物誘導細胞產生大量的細胞因子,打破平衡,出現骨喪失。到目前為止,沒有抑制牙周炎和根尖周炎引起骨喪失的理想藥物。本研究發現姜黃素可以通過抑制TNF-α引起的成骨細胞凋亡,進而增加成骨細胞的數目,減少骨破壞的發生,為根尖周炎及牙周炎引起骨破壞的治療提供實驗依據。
[1]Hock JM,Krishnan V,Onyia JE,et al.Osteoblast apoptosis and bone turnover[J].Bone Miner Res,2001,16(6):975-984.
[2]Manolagas SC.Birth and death of bone cells:basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis[J].Endocr Rev,2000,21(2):115-137.
[3]Cao F,Liu T,Xu Y,et al.Curcumin inhibits cell proliferation and promotes apoptosis in human osteoclastoma cell through MMP-9,NF-κB and JNK signaling pathways[J].Int J Clin Exp Pathol,2015,8(6):6037-6045.
[4]Xu X,Chen D,Ye B,et al.Curcumin induces the apoptosis of nonsmall cell lung cancer cells through a calcium signaling pathway[J].Int J Mol Med,2015,35(6):1610-1616.
[5]Zhu L,Han MB,Gao Y,et al.Curcumin triggers apoptosis via upregulation of Bax/Bcl-2 ratio and caspase activation in SW872 human adipocytes[J].Mol Med Rep,2015,12(1):1151-1156.
[6]Nair P,Malhotra A,Dhawan DK.Curcumin and quercetin trigger apoptosis during benzo(a)pyrene-induced lung carcinogenesis[J]. Mol Cell Biochem,2015,400(1-2):51-56.
[7]Csaki C,Mobasheri A,Shakibaei M.Synergistic chondroprotective effects of curcumin and resveratrol in human articular chondrocytes:inhibition of IL-1beta-induced NF-kappaB-mediated inflammation and apoptosis[J].Arthritis Res Ther,2009,11(6):165-174.
[8]Feng X.Regulatory roles and molecular signaling of TNF family members in osteoclasts[J].Gene,2005,350(1):1-13.
[9]Horowitz MC,Xi Y,Wilson K,et al.Control of osteoclastogenesis and bone resorption by members of the TNF family of receptors and ligands[J].Cytokine Growth Factor Rev,2001,12(1):9-18.
[10]袁月,哈斯達萊,祝海霆,等.大鼠胎鼠成骨細胞原代培養方法研究[J].中國實用口腔科雜志,2010,10(3):619-621.
[11]Chua CC,Chua BH,Chen Z,et al.TGF-β1 inhibits multiple caspases induced by TNF-α in murine osteoblastic MC3T3-E1 cells[J].Biochim Biophys Acta,2002,1593(1):1-8.
[12]Jilka RL,Weinstein RS,Bellido T,et al.Osteoblast programmed cell death(apoptosis):modulation by growth factors and cytokines[J].J Bone Miner Res,1998,13(5):793-802.
[13]Ambrogini E,Almeida M,Martin-Millan M,et al.FoxO-mediated defense against oxidative stress in osteoblasts is indispensable for skeletal homeostasis in mice[J].Cell Metab,2010,11(2):136-146.
[14]Miura M,Chen XD,Allen MR.et al.A crucial role of caspase-3 in osteogenic differentiation of bone marrow stromal stem cells[J].J Clin Invest,2004,114(12),1704-1713.
[15]Parfitt AM.Osteonal and hemi-osteonal remodeling:the spatial and temporal framework for signal traffic in adult human bone[J]. J Cell Biochem,1994,55(3):273-286.
[16]Kitajima I,Soejima Y,Takasaki I,et al.Ceramide-induced nuclear translocation of NF-kappa B is a potential mediator of the apoptotic response to TNF-alpha in murine clonal osteoblasts[J].Bone,1996,19(3):263-270.
[17]Nanes MS.Tumor necrosis factor-alpha:molecular and cellular mechanisms in skeletal pathology[J].Gene,2003,321(12):1-15.
(編輯 陳 姜)
Effect of Curcumin on Tumor Necrosis Factor α-induced Osteoblast Apoptosis
WANG Xue-mei1,SHANG De-hao2
(1.Departments of Endodentics,Experimental Center,School of Stomatology,China Medical University,Institution of Oral Medicine,Shenyang 110002,China;2.Departments of Implant,School of Stomatology,China Medical University,Shenyang 110002,China)
ObjectiveTo study the effect of curcumin on tumor necrosis factor α(TNF-α)-induced osteoblast apoptosis.MethodsPrimary osteoblast cells were divided into three groups:control group(no treated),group treated with TNF-α(treated with TNF-α for24 h),and group pretreated with curcumin(treated with curcumin for 2 h,and then treated with TNF-α for 24 h).Western blot analysis was carried out with primary antibodies against caspase-2,caspase-3,caspase-8,Bcl-2,Fas,and TRAIL.Apoptosis cells were observed by immunofluorescence microscope.ResultsIn group treated with TNF-α,the protein levels of caspase-2,caspase-3,caspase-8,Fas,and TRAIL increased(P<0.01),whereas the protein level of Bcl-2 remained unchanged(P>0.05).In group pretreated with curcumin,the protein levels of caspase-2,caspase-3,caspase-8,Fas,and TRAIL were lower than those in group treated with TNF-α(P<0.01).The number of apoptotic cells was dramatically increased after the administration of TNF-α.While the number of apoptotic cells decreased in the presence of curcumin.ConclusionThe present study clearly demonstrated that curcumin can suppress osteoblast apoptosis induced by TNF-α.
tumor necrosis factor α;osteoblast;apoptosis
R781.4
A
0258-4646(2015)12-1094-04
遼寧省科技計劃項目(2013225090)
王雪梅(1976-),女,副主任醫師,博士. E-mail:wangxuemeisdh@hotmail.com
2015-09-13
網絡出版時間:

